人工智能在肿瘤三级预防中的应用 机遇与挑战*
2021-12-17金昱潘凯枫张艺宝李文庆
金昱 潘凯枫 张艺宝 李文庆
近年来,高通量组学技术的不断发展和真实世界研究理念的逐渐普及为肿瘤精准预防和治疗带来了前所未有的发展机遇,但相关医疗健康大数据的复杂性是制约信息挖掘和肿瘤防控相关策略制定的关键问题。人工智能(artificial intelligence,AI)和以AI 为基础的计算机辅助检测及诊断技术在处理图像、多组学、电子医疗信息等高维数据时具有显著优势,不仅在高危人群筛查和恶性肿瘤早诊早治策略研究中彰显成效(二级预防),亦在协助判断肿瘤分型、预测疗效以延长患者生存方面展现出价值(三级预防),还有望为系统阐明恶性肿瘤病因和实现人群精准风险评估提供证据(一级预防)。在推进恶性肿瘤防控战略关口前移、贯彻“预防为主”工作方针的实践中有着广阔的应用前景。尽管取得了许多突破性的研究成果,AI 应用于肿瘤防控仍面临提高预测准确性、鲁棒性(robustness)和泛化(外推)能力以及结果解读等诸多挑战,需要不断开发、完善和验证AI 新技术,建立系统完备的大数据平台。本文概述了AI 的基本原理、在肿瘤预防中的应用进展和面临的挑战,为更好地将AI 应用于肿瘤预防、高危人群判定和人群分级干预,为降低肿瘤病死率的公共卫生和临床实践提供参考。
1 AI 概述
AI 的概念在20 世纪50年代被提出,是利用计算机算法模拟人类智能行为并完成相关任务的技术。机器学习(machine learning,ML)是AI 最重要的一个分类,即基于数学规则和统计假设对计算机进行编程,使计算机自动从数据中学习模式和特征。ML 的目标是开发一个基于给定数据集特征之间统计关联的预测模型,用于预测所关注问题的结果。医学研究中有许多ML 方法,如Logistic 回归、决策树、随机森林(random forest, RF)、支持向量机(support vector machine,SVM)等。相比于传统分析方法,ML 最突出的优点是可以筛选大量的数据来寻找其他方法可能忽略的特征。ML 主要包括监督学习、无监督学习、半监督学习、弱监督学习、强化学习等类型(表1)[1]。此外,迁移学习是以其他任务的模型为基础重新开发训练模型以完成另一任务,集成学习用于整合多个表现较好的模型,使之整体更为稳定和可靠。使用迁移学习与集成学习也可以优化AI 模型构建并提升模型的泛化性能。
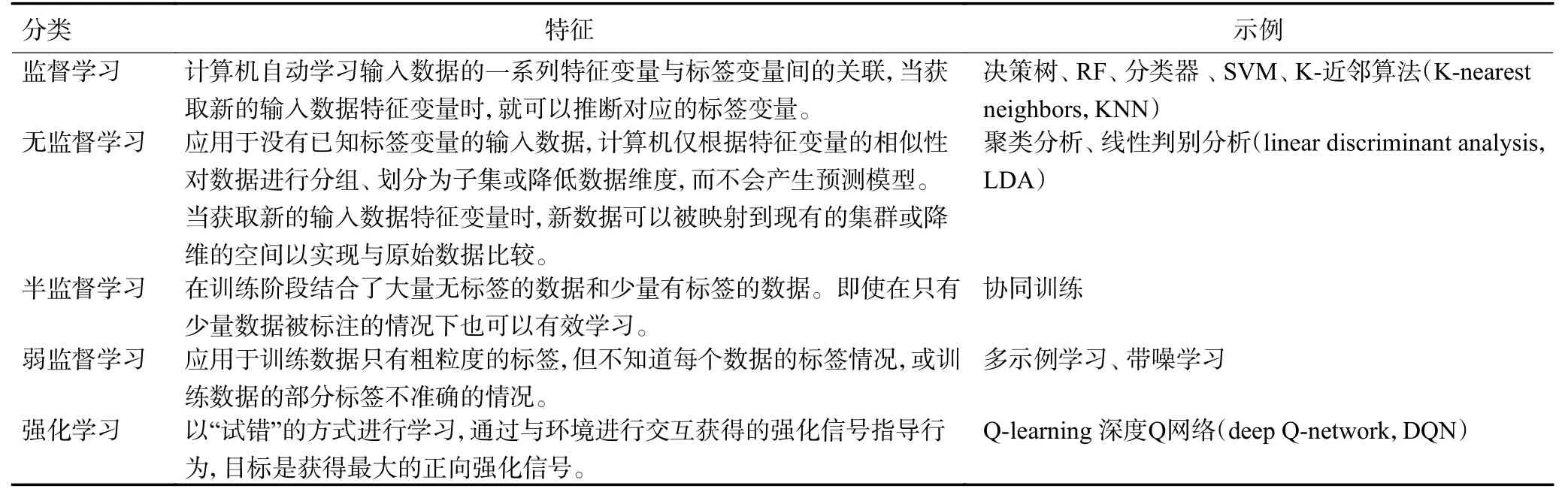
表1 常见的ML 分类
深度学习(deep learning,DL)是利用人工神经网络(artificial neural network,ANN)实现的新一代ML方法,模拟人脑神经元的原理构建不同的层,通过层层加权、相互连接的计算单元或“神经元”来传递信息。简单的ANN 架构通常包括输入层、隐藏层和输出层各1 个。DL 模型则具有复数个隐藏层,比如递归神经网络(recurrent neural network,RNN)具有相对较少的隐藏层,可以处理如DNA 碱基序列等一维数据[2];而卷积神经网络(convolutional neural network,CNN)则有复杂的隐藏层来处理非结构化数据或多维数据[3]。近年来,不断有新的DL 方法被开发和应用于医学研究,如生成对抗网络模型(generative adversarial network,GAN)可生成与训练数据相似的模拟数据提高训练能力[4];多任务学习神经网络可同时对多个分类任务进行学习[5];胶囊网络可聚合多个层次的神经网络,将基因组、转录组、蛋白组等单个生物信息层视为不同的胶囊,每个胶囊内的CNN 独立训练学习各自的特性,胶囊之间的信息传递可用于了解不同生物信息层之间如何相互作用[6]。
AI 特别是DL 方法能够直接处理包括图像在内的非结构化数据和复杂高维数据,这一优势促进了AI 在肿瘤防控中的巨大应用潜力和广阔发展前景。目前,AI 不仅在肿瘤二级预防研究领域进展迅速,而且在一级预防和三级预防方面也取得了积极的进展。
2 AI 与肿瘤一级预防
AI 技术结合流行病学研究方法有望助力阐明恶性肿瘤病因和危险因素,为消除致癌物、保护易感人群和增加机体对致癌物作用的抵抗能力提供支持,并为识别潜在病因预防靶点和明确最适干预人群提供证据,从而预防肿瘤的发生。
研究表明,AI 应用于海量遗传测序数据分析有更准确的读取对齐、可靠的变体识别和变体注释等优势,并用于识别和分类基因组功能元件,将其分为不同功能类别,描述这些类别的特征、鉴定癌症关键转录驱动因素以及进行基因组注释[7]。除应用于识别遗传易感性以外,AI 也可以结合暴露组学技术从环境污染物、饮食、生活方式等角度探索肿瘤发生的危险因素。例如,Neveu 等[8]结合AI 分析技术建立了饮食和污染物的暴露组学数据库,为寻找肿瘤危险因素提供了平台。基于基因组、转录组、蛋白组和代谢组等高通量组学数据,AI 技术可用于探索肿瘤发生过程的代谢改变和病理生理变化,实现早诊生物标志物的筛选和高危人群选择[9-10]。尽管AI 在肿瘤一级预防研究中的应用报道较少,但AI 与传统数据分析方法的结合有望成为未来肿瘤一级预防研究的主流之一,更好地阐明肿瘤发生过程病因和危险因素的系统性和复杂性,整合宿主、遗传和环境特征构建高危人群筛选的策略。
3 AI 与肿瘤的二级预防
二级预防致力于在肿瘤发展的早期阶段通过筛查等手段实现早发现、早诊断和早治疗,从而有效降低肿瘤的临床进展和患者的死亡率,降低肿瘤疾病负担。近年来,AI 技术实现了突破性发展,其基于影像学、病理学、电子健康数据和组学等数据平台,已逐渐应用于肿瘤二级预防的研究和实践。
3.1 影像学资料
随着深度CNN 等DL 方法与计算机辅助检测/诊断(computer-aided detection/diagnosis,CADe/CADx)的发展,应用AI 自动化处理肿瘤影像学资料成为可能。Mckinney 等[11]利用25 856 例英国女性的乳房X 射线筛查图像训练乳腺癌诊断模型,并在3 097 例美国女性中进行验证,发现AI 算法的诊断准确性和对疑似病变区域的识别能力优于放射科医师,应用该系统进行辅助读片能有效降低医师的工作负担,可为乳腺癌筛查提供支持。Kakileti 等[12]将AI 结合热成像技术,基于体表发热和血管分布等构建乳腺癌风险评分,并在一般人群中证明该预测模型可用于乳腺癌筛查(AUC=0.89)。基于核磁共振成像(magnetic resonance imaging,MRI)的肿瘤诊断也受益于AI 的发展,已有多项研究证明应用DL 方法可实现胶质细胞瘤和前列腺癌的肿瘤区域分割和诊断[13]。相较于使用不易获得的病理标本进行诊断,该方法增强了肿瘤早期发现和诊断的能力。AI 还可与内镜技术结合,显著提高肠镜下腺瘤的检出率,并可以优化检测流程和减少漏诊风险[14]。将AI 辅助系统结合胃十二指肠镜可将未观察到胃底和胃窦的概率分别降低至<20%和<4%,显著降低了胃十二指肠镜的盲点率(5.86%vs.22.46%,P<0.001),并增加了筛查准确性[15]。AI 也应用于阴道镜检进行宫颈癌筛查相关研究[16]。此外,AI和DL 技术在正电子发射计算机断层显像(positron emission tomography CT,PET/CT)影像组学领域展现了良好的应用前景,结合AI 分析技术的PET/CT 可在临床诊疗中用于评估全身肿瘤负担[17-18]。
除临床影像学资料,AI 处理图像的优势也体现在与体液活检技术的结合上。Tsvetkov 等[19]使用AI 技术直接识别血浆的纳米级差示扫描荧光(nanodifferential scanning fluorimetry,nanoDSF)特征,可以用于区分胶质细胞瘤患者,一致率达0.92。Shin 等[20]尝试将AI 技术结合受激拉曼光谱分析,发现肺癌患者的血浆外泌体和肿瘤细胞系的外泌体的相似程度与肺癌临床进展有关,因而基于外泌体相似度特征的DL 方法有望指导肺癌分型。Hollon 等[21]在多中心临床试验中使用基于神经网络的受激拉曼组织学(stimulated Raman histology,SRH)在脑肿瘤术中实时诊断,其诊断准确率与病理学专家相当且速度更快。
基于图像纹理特征,影像组学研究也可通过DL方法自动提取图像特征,挖掘影像信息与分子生物学特征之间的关联,识别基因突变、微卫星不稳定、全基因组复制、染色体突变和代谢改变等[22]。相比于传统的实验室检测方法,直接基于图像推测遗传和分子特征具有快速、低成本的优势,不仅可在一定程度揭示分子标志物特征,还有助于阐明分子水平变化对表型影响的生物学机制。然而这些识别方法的理论依据是基因型-表型之间具有足够强的相关性,因此其主要局限性在于影像组学对分子生物学特征识别的准确性仍有限,不能有效改善完整的分子和临床测定结果。
3.2 病理学资料
AI 技术革新也使得作为“金标准”的病理学诊断不断改进。全视野数字化切片图像(whole slide image, WSI)已成为DL 方法和计算机视觉的理想应用场景,通过对传统病理切片进行高分辨率扫描并合成数字化图像,克服了传统切片易损、检索困难和可重复性差的缺点。Esteva 等[23]使用GoogLeNet inception v3CNN 架构对约13 万张皮肤病理图像进行训练,可实现对皮肤角质细胞癌(AUC=0.96)和恶性黑色素瘤(AUC=0.94)的准确识别,并开发了移动端应用以利于患者自我筛查。同样应用v3CNN 算法,Coudray 等[24]可准确诊断病理学家无法判断的部分非小细胞型肺癌(AUC=0.97);且该算法对基于活检、手术、福尔马林固定等不同标本的WSI 数据均能保持一定的准确性。Ma 等[10]基于胃组织病理学图像,使用CNN 和RF 分类器识别出正常胃黏膜、慢性胃炎和肠型胃癌的形态学特征,支持了胃癌发生的多阶段演变过程。AI 与WSI 结合,可准确地检测乳腺癌淋巴结转移情况(AUC=0.99),并显著高于相同工作时间下病理学专家的准确性(AUC=0.81);该研究对比多种AI 算法发现,CNN 模型普遍优于人工特征工程的AI 算法,且对切片染色差异进行标准化、利用不变量增加训练数据和采用不同抽样策略解决分类不平衡问题等辅助性策略均可以增加AI 模型的性能和泛化能力[25]。Campanella 等[26]应用弱监督学习方法表明,即使没有对WSI 训练数据在像素级别进行标注,AI 算法仍可以准确识别出WSI 中潜在病变部位。
当前AI 应用于病理诊断也存在挑战。首先是获取高质量WSI 对于很多医疗机构和不发达地区仍相对困难。由于拍摄图像受到变焦、角度、光线等影响,实现不同标本来源、不同拍摄设备、不同操作人员的WSI 图像标准化需要制定统一的行业标准。对此,Chen 等[27]尝试直接将AI 与数字化显微镜整合,开发了增强现实显微镜,在显微镜视野中实时、准确标注潜在病变位置,可用于优化病理学家工作流程。另外,由于病理特征的复杂性,依托单一数据库的代表性(外推能力)不足,从中训练出AI 算法的鲁棒性受限,因此AI 算法客观上需依托多中心和大样本量研究开发,或进一步提升模型的泛化能力。
3.3 电子健康记录资料
电子健康记录(electronic health records, EHR)包含了常规医疗活动和监测过程中收集的患者人口学信息、药物处方、合并症和其他疾病诊断、医疗资源使用、生命体征、实验室数据以及医嘱中关键词等与患者健康有关的各层面信息,相对容易获得且不需要昂贵的检测设备。Miotto 等[28]通过对7 万余例患者的EHR 数据进行训练学习,对78 种疾病进行了预测,结果显示,结合了DL 方法的预测模型优化了对直肠癌和肛门癌、肝癌和肝内胆管癌、前列腺癌等疾病的预测能力。Ioannou 等[29]依托前瞻性队列的EHR 数据构建RNN 模型,表明基于AI 的风险预测模型能够有效预测肝硬化患者的肝细胞癌发生风险(AUC=0.75)。
AI 应用于EHR 数据对数据质量有较高要求,且通常需要审慎的数据转化,在某些条件下其表现可能不如传统模型。Appelbaum 等[30]研究发现,在一般人群中应用数据驱动的神经网络模型,对胰腺癌的识别准确性不如人工选择变量所构建的Logistic 回归模型。因此,使用AI 方法建模前可参考专业意见,进行初步的变量筛选。
3.4 高通量组学数据
AI 应用于高通量组学数据挖掘提高了肿瘤诊断能力,基于基因组、转录组、蛋白组和代谢组数据进行分析,可选取有意义的生物标志物建立诊断模型。Huang 等[9]检测血清代谢组学,并利用RF 分类器发现一组指示胃黏膜病变进展和早期胃癌的生物标志物,为胃癌高危人群筛查和早期体液活检诊断提供了重要证据。Kouznetsova 等[31]基于神经网络模型,通过识别唾液代谢物差异性,对口腔癌和牙周炎进行鉴别诊断。Zheng 等[32]应用神经网络模型对TCGA 和GEO数据库的肿瘤组织和肿瘤细胞系甲基化数据区分不同组织来源的肿瘤细胞(灵敏度为0.93,特异度为0.99),提示DNA 甲基化信息可应用于鉴定循环肿瘤细胞,为体液活检应用于癌症早期诊断提供理论支持。
目前,AI 在多组学数据分析中的应用仍然偏少。随着AI 技术的不断革新,基于大规模前瞻性研究队列的多组学研究的涌现,组学数据的挖掘深度和预测模型的鲁棒性也有望进一步提高,在肿瘤早发现和早诊断中发挥更大的优势。
4 AI 与肿瘤的三级预防
在患者确诊恶性肿瘤之后,AI 有望辅助制定医疗决策、提高肿瘤治愈率、延长患者生命并提高生存质量。目前,已有很多研究利用AI 进行肿瘤分型、识别相关遗传易感性和分子水平改变、进行生存预测、用于指导临床用药和治疗等。
AI 应用于临床大数据推动了肿瘤患者风险评估和生存预测领域的快速发展。AI 结合影像组学可通过图像信息识别与肿瘤预后相关的分子生物学特征,实现肿瘤分子分型、耐药性预测和判断预后有重要价值。Saillard 等[33]基于WSI 图像数据训练CNN 模型发现微血管侵入和缺乏免疫浸润特征与预后较差有关,对肝癌切除术后生存预测有一定指导性。Kim 等[34]应用肺癌切除术前胸部CT 数据建立DL 模型预测肺腺癌患者无病生存期。Jin 等[35]则利用纵向图像数据,使用新辅助化疗治疗前和治疗后的MRI 图像训练深度神经网络模型,在结合血液中动态变化的癌胚抗原水平的信息后,模型能够准确预测化疗的有效性(AUC=0.97),表明前瞻性随访数据中含有的动态变化信息可显著提高对肿瘤治疗结果的预测能力。Elfiky等[36]使用EHR 数据建立ML 模型准确预测肿瘤患者接受化疗后30 天内(AUC=0.94)和180 天内(AUC=0.83)的死亡风险。Rajkomar 等[37]将DL 方法应用于EHR 数据,在入院早期就可以较为准确地预测住院死亡率(AUC:0.93~0.94)、30 天非计划再入院(AUC:0.75~0.76)、住院延长时间(AUC:0.85~0.86)和患者出院诊断(AUC=0.90),为患者预后预测提供参考。Li 等[38]使用RF、SVM 等ML 方法,利用基因表达谱数据筛选出特征基因构建肺腺癌的生存预测模型,有效实现高危人群分类。Mitchel 等[39]整合了基因组、DNA 甲基化、miRNA 和拷贝数变异的多组学数据,提出了特征水平整合与决策水平整合相结合的多组学DL 框架,实现了准确预测乳腺癌生存率(AUC=0.87)。Tong 等[40]基于互补原则与共识原则相结合构建多组学DL 的生存分析框架,应用于乳腺癌患者生存预测。研究还表明,将DL 方法结合时间序列数据和多次重复测量数据也可应用于竞争风险预测,为未来纵向、多层次数据的生存分析提供方法支持[41]。
在精准医学理念指引下,AI 应用于多学科联合诊疗(multi-disciplinary treatment,MDT)和提供个体化临床诊疗建议是大势所趋。Xu 等[42]开发的DL 算法识别出对肺腺癌有较好预测效果(准确度97.14%)的少量关键基因(CDH5、CAV1、SPP1 等),并对这些基因对应的药物治疗靶点进行选择。IBM 开发的Watson 肿瘤支持系统通过对肿瘤患者诊疗数据进行学习后提出治疗建议,可在MDT 讨论中提供既往的治疗方案资源、指导方向和第三方意见,尽管该系统目前还未完善,但已在临床实践中应用于协助医师选择合适的治疗方案[43]。
5 总结与展望
尽管AI 在肿瘤预防相关研究中已取得许多突破,但其进一步应用于临床仍需克服诸多挑战:1)AI 是数据驱动的研究方法,因此质量良好、大样本量的数据是建立可靠AI 算法的前提。应鼓励在多中心人群中开展AI 有关的研究,并在独立的人群中进行验证,以确保结论的准确性,从而指导肿瘤预防和临床诊疗规范的建立;2)目前,绝大多数AI 依赖外部标准(如已有的病理学诊断“金标准”)来建立基础事实,而AI 对肿瘤诊断的准确性无法超越外部标准,因此不能改善当前“金标准”方法对肿瘤诊断的准确性;3)基于DL方法的模型普遍存在“黑匣子”问题,其内部决策过程往往不可解释,开发可解释性高的AI 方法将为理解疾病过程和指导临床决策提供更多参考;4)将AI 用于肿瘤筛检或预测人群发病风险时不仅需要在医院就诊人群来源的研究中有较高的灵敏度和特异度,更需要在发病率较低的一般人群中筛查时有足够可靠的阳性预测值和阴性预测值,以提高筛检收益;5)AI 的研究和应用需要考虑伦理问题,包括大数据时代的隐私问题、避免受试者被强迫或诱导做非必要检查及其产生的成本效益问题、过度诊断问题、以及不同种族或地区之间数据不平衡导致AI 在不同人群中产生性能差异,最终可能导致医疗保健差异的问题[44]。
未来的AI 研究应遵循《人工智能试验报告统一标准》(CONSORT-AI)等指南,提高研究的标准和报道规范性[45];可使用多位专家小组意见建立更先进的外部标准进行模型训练;整合多维数据库(如多组学数据库、临床资料、社会人口资料、重复测量资料)的AI 方法,实现多层次、纵向数据的准确分析;开发实时学习的AI 系统,在应用中实现自动优化。未来随着AI 技术的不断革新,及与更多学科知识交叉融合,将为肿瘤的病因探索、高危人群识别、人群分级干预、早诊早治以及预后的改善,提供更多的可能性。为完善和提高肿瘤的三级预防策略提供证据支持,从而降低我国肿瘤疾病的负担。
