一株固氮菌的筛选、鉴定及混菌发酵制备复合型菌糠菌肥的研究
2021-12-17李凌凌陆雅琳汪汉正周予西左振宇杨忠华
李凌凌,陆雅琳,汪汉正,周予西,左振宇,杨忠华
(1. 武汉科技大学化学与化工学院,湖北 武汉,430081;2. 武汉科技大学煤转化与新型炭材料湖北省重点实验室,湖北 武汉,430081)
微生物肥料是一种环境友好新型活体肥料,由单一或多种功能微生物与动植物残体或者腐熟有机质经无害化处理后获得[1],该类肥料中有益微生物的生命代谢能够实现固氮、解磷、解钾等效应,不仅可以改善土壤理化性质、提高土壤肥力,而且能够促进植物对营养元素的吸收,产生多种生理活性物质以调节植物生长,并拮抗细菌或真菌等病原微生物的侵害,从而实现对不同作物的增产作用[2]。
功能微生物是实现微生物肥料肥力和功效的核心,开发植物根际促生菌(plant growth promoting rhizobacteria,PGPR)菌肥以及利用多种功能微生物混合制备复合型菌肥是目前微生物肥料研究领域的主要趋势。PGPR是一类生活在植物根际的微生物,能够促进植物生长,防治病害和增加作物产量[3],以其为原料制备菌肥不仅能有效促进植物根系的吸收,而且还可保护植物根部免受病菌的侵袭,从而提升菌肥的功效[4]。菌肥中的微生物主要有固氮菌、溶磷菌、解钾菌、光合细菌、促生菌等[5],由这些微生物混合制备的复合型菌肥,能够综合各菌种不同的代谢能力,并通过它们之间的相互作用来实现菌肥的多功能融合。此外,基质载体也是影响菌肥质量的关键因素。微生物肥料的载体不仅要为微生物生存和释放提供适当环境[6],还需具有较高的有机质和养分含量以保证接种微生物的生长[7]。菌糠又称菇渣或蘑菇渣,是收获食用菌子实体之后的废弃基质,其主要成分为菌丝残体、菌体生长代谢过程中的产物以及食用菌分解后的木质素、纤维素和半纤维素等碳水化合物[2,8]。菌糠经食用菌分解以后,其中氮、磷、钾的有效性优于栽种前的培养基质,而且菌糠疏松透气,持水性好,施用于土壤可以提高土壤肥力和保水保肥性能[5,8],因此,以菌糠作为载体制备微生物肥料,不仅能以较低的生产成本提供足够的植物营养,而且可实现废弃资源的循环利用,促进食用菌产业及其它相关农业的可持续发展。基于此,本研究从辣椒根际采集的土壤样品中分离出固氮菌,研究了菌株的固氮、溶磷和分泌植物生长激素的能力,并将所筛选的固氮菌与几种溶磷微生物两两混合,以菌糠为载体制备出复合型菌糠菌肥,利用植物的盆栽实验,研究了所制复合型菌肥对辣椒苗的促生作用,以期为此类复合型菌肥在农业生产中的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 培养基
Ashby无氮液体培养基:甘露醇10.0 g,CaCO35.0 g,MgSO4·7H2O 0.2 g,KH2PO40.2 g,CaSO4·2H2O 0.1 g,NaCl 0.2 g,加去离子水定容至 1000 mL。在配制相应固体培养基时,另加入琼脂20.0 g[3,9]。
LB培养基:参照文献[10]配制,用于鉴定菌株与氧气的关系。
半固态发酵培养基:平菇菌糠 25.0 g,玉米粉5.0 g,初始水含量为60%~70%。
NBRIP培养基:Ca3(PO4)25.0 g,葡萄糖10.0g,(NH4)2SO40.15 g,KCl 0.2 g,MgCl2·6H2O 0.5 g,MgSO4·7H2O 0.25 g,加去离子水定容至1000 mL,pH值调至7.0,用于培养溶磷细菌[11]。
1.1.2 菌株
台湾假单胞菌(Pseudomonastaiwanensis)P1和P3、成团泛菌(Pantoeaagglomerans)ZB和Talaromycespurpureogenus(TP)菌,均为实验室从植物根际筛选所得具有溶磷能力的菌株。
1.1.3 酶和化学试剂
Salkowski比色液:FeCl34.5 g,溶于1 L浓度为10.8 mol/L浓硫酸中[3]。
PCR产物纯化回收试剂盒(Cycle-pure kit)为美国OMEGA公司产品;通用型柱式基因组DNA提取试剂盒、DNA Marker和2×ES Taq MasterMix(含染料)为康为世纪生物科技有限公司产品;引物合成和测序工作均由武汉擎科创新生物科技有限公司完成。
1.2 方法
1.2.1 菌株YX的筛选
取5 g采集自湖北省广水市杨寨菜园所种植辣椒根际处的土壤样品(采集深度5~15 cm),加入到100 mL的Ashby无氮液体培养基中富集培养。以Ashby培养基为选择性培养基,在其上稀释涂布土壤富集液,置于30 ℃恒温生化培养箱中培养。待培养一段时间后,从Ashby平板上挑选生长旺盛的菌落,采用平板划线分离法进行菌种的纯化,重复3~4次,直至显微镜中观察到形态、大小基本一致的细菌,该菌种命名为YX。
1.2.2 菌株YX的鉴定
菌株YX的个体形态观察和生理生化特征检测参照文献[10]进行操作。按照通用型柱式基因组DNA提取试剂盒说明书,提取菌株YX的基因组DNA。菌株YX的16S rDNA的PCR扩增、回收、测序和系统发育树的构建参照文献[11]进行。
1.2.3 菌株溶磷能力的测定
采用磷钒钼黄比色法测定培养液中可溶磷的含量[11]。
1.2.4 培养液pH值的检测
采用pH计测量培养液的pH值,培养基的初始pH值为7.0。
1.2.5 菌株固氮能力的检测
用接种环挑取菌株YX的菌落在Ashby琼脂平板上划线后,置于30 ℃恒温生化培养箱中培养一段时间,观察菌株的生长状况。若菌株生长良好,初步判断菌株具有一定的固氮能力。菌株YX在Ashby液体培养基中生长7 d后,离心获取上清液,以不接菌种的液体培养基为对照,采用半微量凯氏定氮法测定上清液中的含氮量,以此确定菌株YX的固氮量[9,12]。
1.2.6 菌株产吲哚乙酸能力的检测
以1%接种量接种菌株YX于L-色氨酸浓度为100 mg/L的液体Ashby无氮培养基中,在30 ℃、180 r/min的恒温摇床中避光振荡培养24 h后,取菌悬液测定菌液中的IAA含量。将菌悬液离心后所得上清液按体积比1∶1与Salkowski比色液混合,混合液在室温下避光静置30 min后,于530 nm处测定吸光度值[3,13],空白对照为未接种的培养基与Salkowski比色液的等体积混合液。
1.2.7 菌株的拮抗实验
将菌株YX分别与台湾假单胞菌P1和P3、TP、成团泛菌ZB在LB琼脂平板上借助双划线法两两混合接种,即先将菌株YX沿平板表面横向划线接种,再将另一菌种沿平板表面纵向划线接种。将接种样品在30 ℃培养箱内培养20 min后再倒置培养3 d,每天定时观察平板纵横划线交叉处的细菌生长状况,若交叉点处出现明显生长抑制现象,则表明两菌株间有拮抗作用,不能混合培养;若交叉点处未显现生长抑制作用,则表明两菌株生长良好,菌株之间不发生拮抗作用,可以混合培养[14]。
1.2.8 菌肥发酵
以平菇菌糠作为菌肥的基质载体,采用半固态发酵工艺制备菌糠菌肥。将菌种按5%的接种量接种至已灭菌的半固态发酵培养基中,置于30 ℃、200 r/min的恒温摇床中发酵 6 d即得复合微生物菌肥[3,15-16],而阴性对照组中仅加入5%的NBRIP培养基。实验共制得9种不同的单一菌或混合菌发酵的菌肥及1个阴性对照组肥料,编号分别为G1~G10,其中G1~G5为单一菌制备的菌肥,分别接种的是菌株YX、台湾假单胞菌P1、台湾假单胞菌P3、成团泛菌 ZB、TP菌;G6~G9为混合菌制备的菌肥,分别接种的是菌株YX和台湾假单胞菌 P1的等体积混合菌、菌株YX和台湾假单胞菌 P3的等体积混合菌、菌株YX和成团泛菌ZB的等体积混合菌、菌株YX 和TP菌的等体积混合菌;阴性对照组编号为G10。
1.2.9 菌肥的含氮量、可溶性磷含量和活菌数检测
黏稠的半固体状菌肥加入等体积的去离子水,密封经充分振荡后离心取上清液,采用磷钒钼黄比色法测定上清液中的可溶性磷含量,并采用稀释涂布平板法对其中的微生物数量进行计数,称取一定量的菌肥,采用凯氏定氮法测定样品中的总氮量[9]。
1.2.10 盆栽实验
盆栽用土取自武汉科技大学青山校区图书馆后方空地,采集深度距地表约10 cm,将所采土壤除去石块等杂物后研磨,过2 mm筛。选择20株株高为2.5~4.5 cm、茎直径为0.25~0.35 cm、叶数为10~15片、根长为5~7 cm的辣椒苗,随机分为 10组,每组2株辣椒苗种植于同一个花盆中,每个花盆中填入土壤4 kg,并浇水350 mL,在距土壤表层60~100 mm以下,加入40 g经不同处理制备的菌肥,实验均在室外自然条件下进行。此外,在移栽辣椒苗前,测量辣椒苗的株高、茎直径、叶片数、叶长、叶片最大宽度和根长等参数,记为初始数据,叶片面积按照0.75倍叶片长度与叶片最大宽度的积计算[17]。辣椒苗的根部浸润半小时后种到土壤中,辣椒苗生长期间不再加入菌肥,仅根据土壤情况浇水。当辣椒苗长出新叶之后,每隔3 d进行一次数据测量,减去初始数据以求得相关参数的变化量。培养12 d以后,将辣椒苗拔起测量其株高和根长,并烘干称量获得总干重数据。
2 结果与分析
2.1 菌株YX的筛选及鉴定
从辣椒根际处采集的土壤中,以稀释涂布的方式分离纯化获得可以在Ashby无氮琼脂平板上生长的菌株YX,初步推断菌株YX具有固氮能力。
菌株YX在LB固体培养基上培养2 d后,形成淡黄色且不透明、圆形、中间隆起、边缘整齐、表面光滑湿润、易于挑取的菌落,在LB半固体培养基中的穿刺实验表明该菌株为好氧菌。
光学显微镜观察显示,菌株YX为可运动的杆状细菌,其革兰氏染色及孔雀绿染色结果均呈阴性。
菌株YX及嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia)[18-21]的生理生化特征如表1所示。由表1可见,菌株YX接触酶为阳性,氧化酶为阴性,它不能水解淀粉和尿素,但能水解明胶、脂肪和酪素。菌株YX能够还原硝酸盐生成亚硝酸盐,但不能水解培养基中的含硫氨基酸生成H2S,也不能酵解葡萄糖产酸产气。IMViC试验结果显示菌株YX可以产生色氨酸酶分解色氨酸产生吲哚,但其柠檬酸利用试验、伏普反应和甲基红反应的结果均呈阴性。此外,LB培养基中的菌株YX在37 ℃下生长状况最好,在4 ℃和40 ℃条件下,光学显微镜中未观察到该菌株的生长迹象。
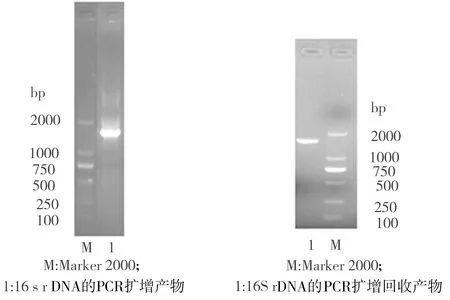
提取菌株YX的基因组DNA为模板,进行16S rDNA的PCR扩增,对所得PCR产物进行1.0%琼脂糖凝胶电泳,结果如图1(a)所示,可见PCR产物位于1000 bp和2000 bp之间。将PCR扩增产物切胶回收获得的产物(电泳结果见图1(b))送交武汉擎科创新生物科技有限公司进行测序,获得一段长为1447 bp的核苷酸序列,利用NCBI数据库提供的BlastN功能对此序列进行核苷酸比对,结果显示菌株YX与窄食单胞菌属Stenotrophomonas多株细菌的16S rDNA基因序列一致性均高达99%。根据16S rDNA序列的相似性,利用Clustal Omega和Mega 6软件构建系统发育树(如图2所示),可见菌株YX在系统发育上最接近于嗜麦芽窄食单胞菌。
根据伯杰氏手册[19],嗜麦芽窄食单胞菌归属于原核生物界变形菌门γ-变形菌纲黄单胞菌目黄单胞菌科窄食单胞菌属(PhylumProteobacte-riaClassGammaproteobacteriaOrder Xanthomonadales FamilyXanthomonadaceaeGenusStenotrophomonas),其菌体是直或略弯的杆菌,有鞭毛,可以运动,不能积累PHB,菌落颜色为黄色或绿黄色。该菌能够将硝酸盐还原成亚硝酸盐,但不发生反硝化作用。菌株的氧化酶、精氨酸双解酶检测结果均为阴性,但接触酶、脂肪水解、明胶液化检测结果为阳性。在LB培养基中,菌株的最适生长温度为35 ℃,菌株在4 ℃和41 ℃温度下不能生长。由Bashandy等[20]的报道可知,分离的嗜麦芽窄食单胞菌SR1是革兰氏阴性杆菌,不能产芽孢,可运动,该菌在琼脂平板上培养48 h后,形成圆形、光滑、有凸起、有完整边缘的菌落,可以水解明胶、酪蛋白,不能水解淀粉和尿素,菌株的接触酶和氧化酶检测结果为阳性,精氨酸双解酶检测结果为阴性,该菌能够产生吲哚,硫化氢试验和反硝化试验结果呈阴性。此外,Amoli等[21]对分离的20株嗜麦芽窄食单胞菌生理生化特征的研究表明,菌株的吲哚、甲基红、伏普、硫化氢、糖酵解、淀粉和尿素水解实验结果均为阴性,接触酶和精氨酸双解酶检测结果均为阳性,20株测试菌的氧化酶检测结果中25%呈阳性,其余为阴性。本研究中菌株YX的形态学、生理生化特征与上述报道中有关嗜麦芽窄食单胞菌的描述几乎一致,结合16S rDNA鉴定结果,菌株YX应归属于嗜麦芽窄食单胞菌。
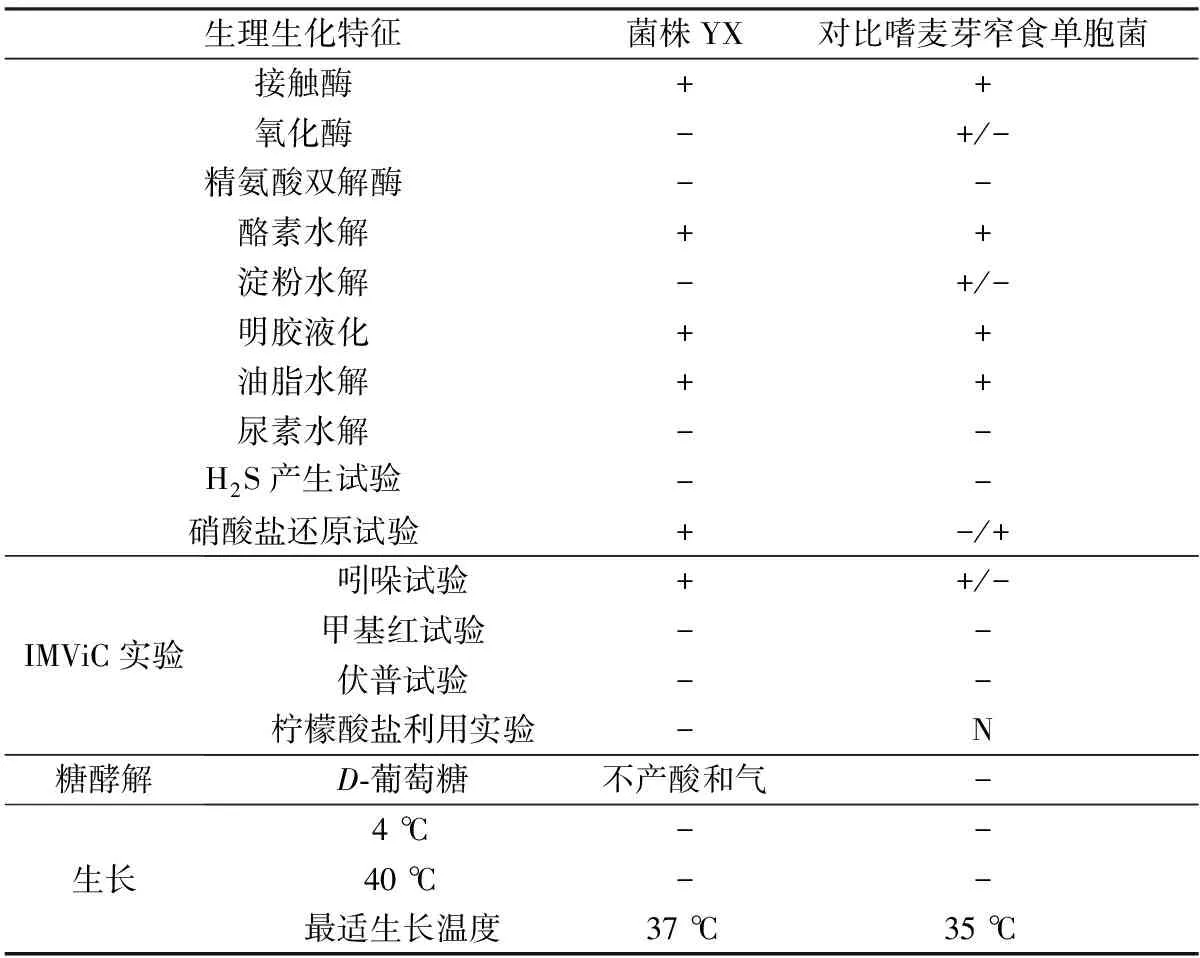
表1 菌株的生理生化特征
(a)16S rDNA PCR扩增产物 (b)回收产物

图2 根据菌株YX的16S rDNA基因序列构建的系统发育树
2.2 菌株YX的溶磷、固氮、产吲哚乙酸能力
2.2.1 菌株YX的溶磷能力
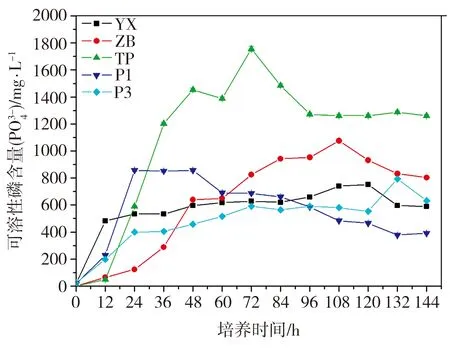
在初始pH值为7.0的NBRIP液体培养基中,菌株YX、台湾假单胞菌P1和P3、成团泛菌ZB、TP菌等的溶磷量及菌液pH值随培养时间的变化如图3所示。由图3(a)可见,当培养时间不超过12 h时,菌株YX的溶磷量随时间的增加而迅速增大,继续增加培养时间,菌株YX的溶磷量增幅减缓直至培养时间为120 h时达到峰值(750.53±8.2 mg/L),之后,菌株YX的溶磷量随时间的延长逐渐降低。从整体来看,5种菌株的溶磷能力以TP为最强,P3最弱,YX略胜于后者。此外,5种菌株溶磷量达到峰值所对应的培养时间各不相同,这表明若不存在菌株间的拮抗效应,当菌株YX与其它4种菌株混合发酵时,交错出现的溶磷高峰将有助于提升混合菌对难溶性磷的溶解能力。由图3(b)可见,在接种后的12 h以内,菌株YX的菌液pH值从初始时的7.0急剧降至4.81,之后随时间的延长呈缓慢下降趋势,直至培养时间为108 h时达到最低值(4.56),继续增加培养时间,该值几乎不变。至于另外4种菌株,P1、P3、ZB及TP菌液pH值最低时所对应的培养时间分别为24、60、84、60 h,5种菌株中,TP菌的培养液pH最低值最小。综合菌株的溶磷量及菌液pH变化曲线可以看出,菌株溶磷量与菌液pH值之间存在一定的负相关性。
(a)可溶性磷含量
2.2.2 菌株YX的固氮及产吲哚乙酸能力
已有研究发现,嗜麦芽窄食单胞菌具有较强的固氮能力[20,22-24],经检测,本研究筛选分离的菌株YX固氮量达到28.27±2.4 mg/L,且该菌株具有一定的产吲哚乙酸能力,吲哚乙酸分泌量可达35.67±1.6 μg/mL。
2.3 菌株的拮抗反应结果
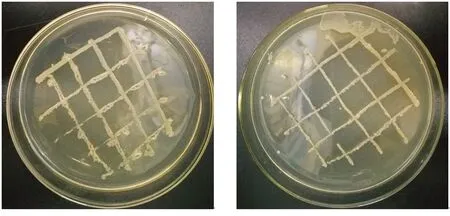
菌株YX分别与台湾假单胞菌P1和P3、成团泛菌ZB、TP在LB琼脂平板上两两混合接种培养3 d时的生长状况如图4所示。由图4可见,菌株YX分别与P1、P3、ZB和TP等菌株在LB琼脂平板上划线的交叉部位都没有出现生长抑制现象,这表明菌株间不存在拮抗作用,可以两两混合培养以发酵菌肥。
2.4 发酵菌肥的含氮量、可溶性磷含量及活菌数
单一菌和混合菌菌肥发酵完成后,取一定量的菌肥测定其中的总氮量、可溶性磷含量及活菌数,结果如表2所示。由表2可见,G1~G9菌肥组的总氮量、可溶性磷含量都比阴性对照组G10相应值高,且差异性显著(P<0.05),表明所添加的功能微生物通过固氮、溶磷等代谢活动,提高了以菌糠为载体的肥料中可以利用的氮、磷含量。此外,两两混合型菌肥组G6~G9的总氮量、可溶性磷含量及活菌数除个别测量值外普遍高于单一型菌肥组G1~G5相应值,表明利用功能微生物混合发酵制备的菌糠菌肥更具有优势,这些功能微生物通过综合各自的代谢活动,相互影响和促进,能够更高效地发挥固氮、解磷效应,菌体生长繁殖也因此更为明显。
(a)YX+P1 (b)YX+P3
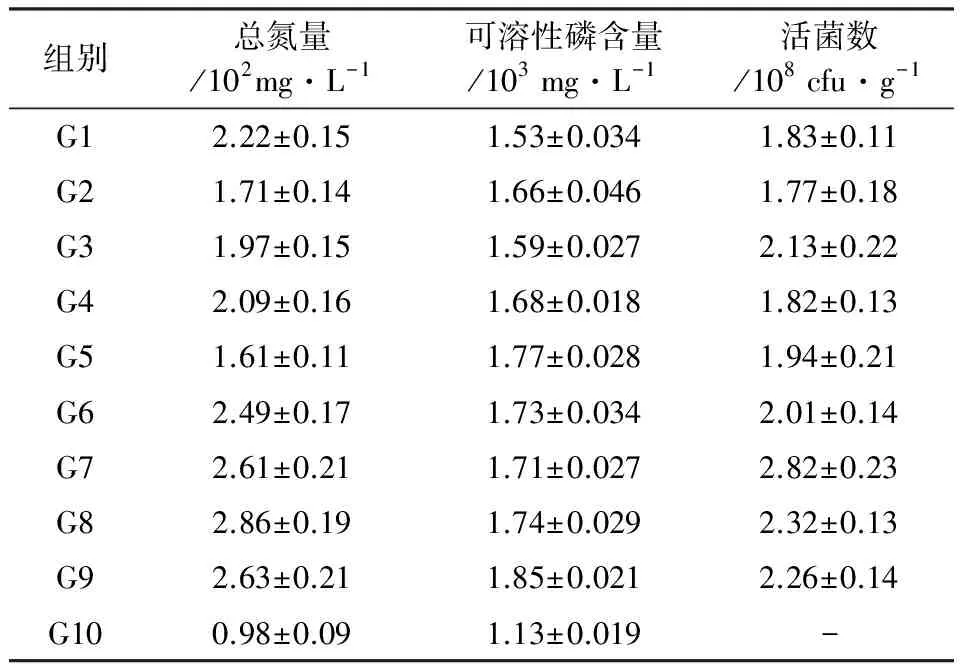
表2 菌糠菌肥中氮含量、可溶性磷含量和活菌数
2.5 盆栽实验结果
盆栽实验所测相关参数值如表3所示。从表3可见,与G10组肥料相比,G1~G9组肥料均能明显地促进辣椒苗的生长,其中效果最好的是G9组(YX+TP)肥料,利用该组肥料进行盆栽实验培养12 d时,辣椒苗叶片数、叶片最大面积、株高、茎直径及根长的变化量较G10组相应值分别增大了466.67%、617.56%、134.07%、38.81%和195.84%,且所有的差异均达到显著水平(P<0.05)。同时注意到,当盆栽实验进行12 d时,复合型菌糠菌肥G6组(YX +P1)辣椒苗的叶片数、叶片最大面积、株高及根长变化量较单一型菌糠菌肥G1组(YX)相应值分别增大了28.57%、121.53%、77.35%、45.99%, G7组(YX +P3)相应值较后者分别增大了28.57%、289.40%、55.13%、61.16%,G8组(YX +ZB)辣椒苗的叶片最大面积、株高及根长变化量较G1组相应值分别增大了111.57%、35.47%、55.81%,以上差异均达到显著水平(P<0.05),而促生效果最明显的G9组辣椒苗的叶片数、叶片最大面积、株高、茎直径及根长变化量较G1组相应值也分别增大了142.86%、757.03%、82.06%、10.06%、121.88%,其中叶片最大面积、株高、根长的差异达到了显著水平(P<0.05)。G6组辣椒苗的叶片数、叶片最大面积、株高、茎直径及根长变化量较单一型菌糠菌肥G2组(P1)相应值分别增大了12.5%、86.86%、30.10%、109.09%、18.48%,除叶片参数和根长变化量外,其余生长参数差异均达到显著水平(P<0.05),G9组相应值较G5组(TP)相应值分别增大了41.67%、117.71%、13.6%、2.77%、62.95%,其中叶片最大面积和根长的差异均达到显著水平(P<0.05)。G7组辣椒苗的叶片最大面积、株高、茎直径及根长变化量较G3组(P3)相应值分别增大了108.16%、33.46%、58.17%、49.18%,除根长变化量外,其余生长参数差异均达到显著水平(P<0.05),G8组相应值也比G4组(ZB)相应值分别增大了26.46%、0.96%、39.32%、37.95%,其中叶片最大面积和茎直径差异均达到显著水平(P<0.05)。此外,通过比较各组盆栽实验进行12 d时植物的总干重可知,与G10组相比,G1~G9组菌糠菌肥能明显地增加辣椒苗的干重,相应增幅分别为106.01%、10.51%、49.18%、97.40%、248.42%、252.35%、200.62%、170.47%和308.29%,差异均达到了显著水平(P<0.05),进一步分析增幅数据发现,相比单一型菌肥,复合型菌肥能更显著地增加辣椒苗的干重,差异均达到显著水平(P<0.05)。
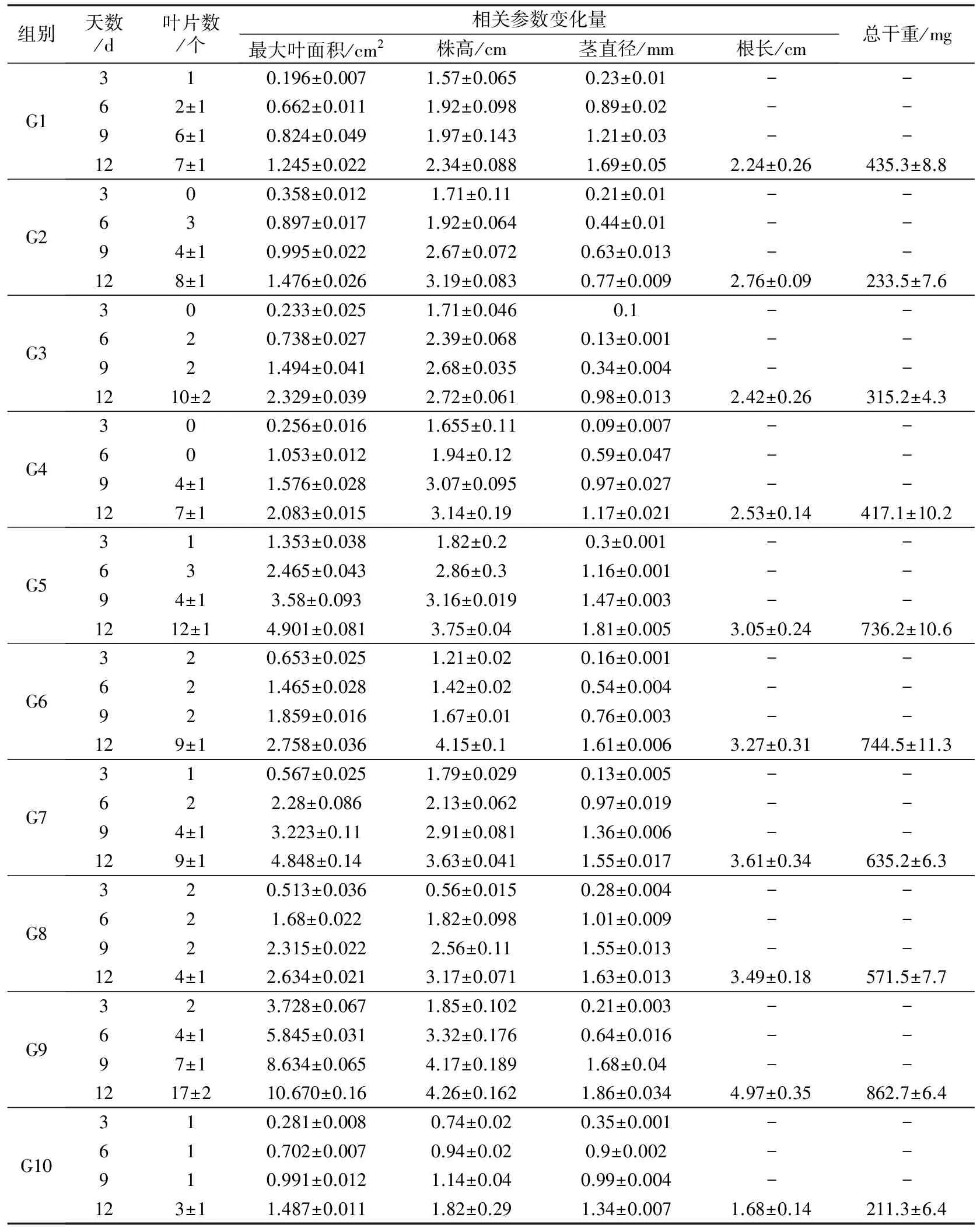
表3 盆栽实验结果
综合盆栽实验结果表明,无论是单一型还是复合型菌糠菌肥,其对植物的促生效应都比作为对照的菌糠组更加明显,其中,以嗜麦芽窄食单胞菌YX和溶磷真菌TP混合发酵所制复合型菌肥对辣椒苗的促生作用最佳。另外,复合型菌糠菌肥对植物的促生效果较相应的单一型菌糠菌肥更加明显。
3 结论
(1)从辣椒根际采集的土样中分离得到菌株YX,经鉴定该菌株为嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia)。
(2)菌株YX除了可以固氮(固氮量高达28.27±2.4 mg/L)外,还能够溶解难溶性磷酸盐(溶磷量高达750.53±8.2 mg/L)以及分泌植物生长激素吲哚乙酸(分泌量高达35.67±1.6 μg/mL)。
(3)固氮菌株YX与四种溶磷微生物之间不存在拮抗作用,由菌株YX分别与四种溶磷微生物两两混合发酵制备的复合型菌糠菌肥组的总氮量、可溶性磷含量及活菌数要高于单一型菌糠菌肥组相应值,表明复合型菌糠菌肥能够更高效地发挥固氮、解磷效应,并促进菌体的生长繁殖。
(4)固氮菌株YX和溶磷微生物混合发酵所制复合型菌糠菌肥对植物的促生效果明显优于单一型菌糠菌肥,本研究中以固氮菌株YX和溶磷真菌Talaromycespurpureogenus混合发酵所制复合型菌肥对辣椒苗的促生效果最佳。
