体外模拟消化对暗纹东方鲀鱼皮胶原蛋白肽结构特征及抗氧化活性的影响
2021-12-17曹振海乐彩虹陶宁萍邓尚贵
曹振海,乐彩虹,陶宁萍,2*,邓尚贵
1(上海海洋大学 食品学院,上海,201306) 2(上海水产品加工及贮藏工程技术研究中心,上海,201306) 3(浙江海洋大学 食品与药学学院,浙江 舟山,316000)4(浙江兴业集团有限公司,浙江 舟山,316000)
胶原蛋白肽是以胶原蛋白或明胶为原料,在物理、化学和酶解的作用下得到水解物。与胶原蛋白相比,低分子质量的胶原蛋白肽表现出了更广泛的生物活性和更强的生物利用度而受到市场的青睐,如抗氧化、抑菌,降血压、抑制肥胖以及增强骨质特性等[1-2]。水生动物由于其优异的生物相容性和功能性以及无宗教信仰问题已成为胶原蛋白肽的最佳来源,被广泛应用于食品、医药、化妆品行业。前人[3]等研究了来源于金枪鱼、凤尾鱼、鱿鱼等的混合副产物中不同级分的酸溶性胶原蛋白肽的生物功能活性,发现分子质量<1 kDa组分其抗氧化活性最高,DPPH自由基清除率可达81.6%,·OH清除活性高达91.0%,且乳化活性指数高达130 m2/g;JIN等[2]使用胰蛋白酶水解三文鱼皮胶原,并从中筛选出了具备抑制与糖尿病发病机制有关的DPP-IV活性肽组分,其IC50为(0.79±0.13)mg/mL。LIU等[4]发现泥鳅皮胶原蛋白肽可通过Wnt/β-catenin通路减轻小鼠骨质疏松症,并增强其骨生物力学特性。
随着养殖暗纹东方鲀技术的成熟,规模化养殖暗纹东方鲀的需求日益增长,其鱼皮是生产加工中主要的副产物之一,据前期实验表明,暗纹东方鲀鱼皮中胶原蛋白含量丰富,可达到总蛋白含量80%以上,是胶原蛋白肽理想来源。周瑞等[5]使用不同酶处理暗纹东方豚鱼皮以提取胶原蛋白,结果表明胃蛋白酶提取的胶原蛋白得率最高,且能较好地保留胶原蛋白三股螺旋结构,但目前国内外对于暗纹东方鲀鱼皮中的胶原蛋白活性肽的提取及其活性的探讨研究极少。
研究表明,在体外显示出生理活性的活性肽只有一小部分在体内被证明是有效的[6]。体内胃肠道消化会改变多肽的结构,进而影响其生物利用度。本实验使用INFOEGEST体外模拟消化系统模型对不同分子质量的自制暗纹东方鲀鱼皮胶原蛋白肽(Takifuguobscurusskin collagen peptide,TOSCP)和市售鱼皮胶原蛋白肽(commercial fish skin collagen peptide,CFSCP)进行体外消化实验,探究了胶原蛋白肽在消化过程中的结构特征变化(微观结构、分子质量、二级结构以及氨基酸含量)及其对抗氧化活性的影响。
1 材料与方法
1.1 材料和试剂
暗纹东方鲀鱼皮胶原蛋白肽,实验室自制;市售鱼皮胶原蛋白肽,山东迈德丰生物科技有限公司。
胃蛋白酶(V900497,750 U/mg)、牛血清蛋白(色谱级),美国sigma公司;胰蛋白酶(YT7553,250 U/mg),合肥博美生物科技有限责任公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC),北京索莱宝科技有限公司;乙腈(色谱级),德国默克公司;其他试剂均为分析纯,上海麦克林生物科技有限公司。
1.2 仪器和设备
SW22SET1恒温振荡水浴锅,北京优莱博技术有限公司;H1850台式高速离心机,长沙湘仪离心机仪器有限公司;L—8800氨基酸自动分析仪,日本日立公司;SU5000扫描电子显微镜,日立高新技术公司;Spotlight 400傅里叶变换红外光谱仪,英国PerkinElmer公司;LSM710 NL0激光共聚焦显微镜,德国蔡司股份公司;Waters e2695高效液相仪,美国沃特世公司。
1.3 实验方法
1.3.1 TOSCP的制备
将1 cm×1 cm的暗纹东方鲀鱼皮与3倍鱼皮质量的水混合,于95 ℃水浴锅中热水浸提3 h,取出并冷却后,调节浸提液的pH至6.0,在50 ℃下预热10 min,加入复合蛋白酶(鱼酶质量比50∶1)酶解1.5 h,待酶解反应完成后,将酶解液放入90 ℃水浴锅中灭酶15 min,冷却至室温后以10 000 r/min转速离心10 min,冷冻干燥上清液得TOSCP,得率为93.80%。
1.3.2 体外消化模拟
按INFOGEST体外模拟消化系统[7]对胶原蛋白肽进行消化,该模型包括胃、肠2个阶段。胃液模拟液(simulated gastric fluid,SGF)和肠液模拟液(simulated intestinal fluid,SIF)的配制具体见表1。
模拟胃液消化液的配制以200 mL为例:称取1.20 g胃蛋白酶与150 mL SGF浓缩液混合后,加入0.1 mL 0.3 mol/L的CaCl2·2H2O并用去离子水定容至200 mL,然后调节pH至2.0。模拟肠液消化液的配制同样以200 mL为例,分别称取0.16 g胰蛋白酶和1.70 g胆盐与150 mL SIF浓缩液混合后,加入0.4 mL 0.3 mol/L的CaCl2·2H2O并定容至200 mL,调节pH至7.0。

表1 模拟消化液的配制Table 1 Preparation of simulated digestion fluids
将TOSCP和CFSCP溶解于去离子水中(5 g/L),预备等体积模拟胃液消化液并37 ℃水浴预热5 min后,加入样品,37 ℃恒温振荡(120 r/min)2 h。将胃消化后的消化液用1 mol/L NaOH调节pH至7.6,加入等体积模拟肠液消化液(37 ℃),37 ℃恒温振荡(120 r/min)2 h,完成消化。样品经模拟胃、肠道消化,立即取出,通过沸水浴(5 min)灭酶,调节pH至7.0,10 000 r/min离心10 min,冷冻干燥,备用。
1.3.3 消化前后多肽表面微观结构观察
参考余韵[8]的方法并稍作修改,取少量粉末涂抹于贴有导电胶的样品盘上,置于离子溅射仪的样品舱中,喷金2 min,将样品盘放入扫描电子显微镜观察室,选取清晰视野进行观察。
1.3.4 消化前后多肽微观结构观察
参考王笑涵等[9]的方法并稍作修改,取1 mL样品和10 μL FITC溶液(1 mg/mL)混匀,静置20 min。取10 μL染色液于载玻片上,静置20 min,晾干后在FITC通道,20倍激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)下进行观察,溶液配制及实验操作全程避光。
1.3.5 消化前后多肽分子质量测定
参照GB 31645—2018《食品安全国家标准 胶原蛋白肽》中附录A进行测定。
1.3.6 消化前后多肽消化率测定
参照JIANG等[10]的方法测定多肽消化率,计算方法如公式(1)所示:

(1)
式中:ρ0,消化前多肽含量,mg/mL;ρ1,消化后多肽含量,mg/mL。
标准曲线的绘制参考汪旭[11]的方法并稍作修改。用牛血清蛋白构建蛋白定量标准曲线,于540 nm下测定其吸光值。
样品测定:取2.5 mL样品,加入2.5 mL体积分数10%三氯乙酸溶液,振荡混匀,静置10 min,5 000 r/min离心10 min,取上清液1 mL,加4 mL双缩脲试剂,振荡混匀,放置30 min,于540 nm下测定其吸光值,将吸光值带入标准曲线,可得样品中的多肽含量。
1.3.7 消化前后多肽氨基酸测定
氨基酸含量:参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》进行测定。
1.3.8 消化前后多肽红外光谱测定
利用单点衰减全反射(attenuated total reflection,ATR)模式对样品信息进行采集,室内干燥(空气湿度<40%)。样品的红外谱图以空气为背景,去除干扰。谱图扫描波数为4 000~600 cm-1,分辨率为±4 cm-1,信号累加32次。使用软件PeakFit v 4.12对1 600~1 700 cm-1的区域进行基线校正以及二阶导数拟合对胶原蛋白肽的二级结构进行分析[10]。
1.3.9 抗氧化活性的测定
参考乐彩虹等[12]的方法并稍作修改,取不同消化阶段多肽产物,分别配制成1、5、10 mg/mL的多肽水溶液。
DPPH自由基清除率:取不同消化阶段多肽水溶液各1 mL,分别加入1 mL DPPH溶液(0.4 mg/mL),混合均匀,室温反应30 min后,取200 μL于96孔板中,于517 nm处测其吸光值A1,计算方法如公式(2)所示:
(2)
式中:A0,超纯水代替样品吸光值;A1,样品吸光值;A2,超纯水代替DPPH溶液吸光值。
总还原能力:取不同消化阶段多肽水溶液各0.5 mL,加入2.5 mL PBS缓冲液(0.2 mol/L,pH 6.6)和2.5 mL K4Fe(CN)6(体积分数1%)混匀,在50 ℃的水浴中反应20 min,迅速冷却后加入2.5 mL 三氯乙酸(trichloroacetic acid,TCA)(体积分数10%),混匀后在3 000 r/min下离心10 min,取上清液2 mL,加入2 mL H2O和1 mL FeCl3(体积分数0.1%)混匀,室温放置10 min后于700 nm处测其吸光值。
1.4 数据分析
所有实验均重复3次,结果以平均值±标准偏差(mean±SD)表示。使用SPSS 23.0软件对数据进行差异显著性分析,P<0.05表示数据间存在显著性差异;使用Origin 8.6(Origin Lab,USA)软件处理和生成图像。
2 结果与分析
2.1 消化前后多肽表面微观结构
扫描电子显微镜(scanning electron microscope,SEM)是使用聚焦电子束观察物质微纳米尺度范围的特征技术[13]。由扫描电镜图可知,TOSCP在120倍下呈大小不一的片状并紧密排列,而CFSCP呈大小均一的小球状排列,更加均匀细小,放大到1 000倍后,TOSCP呈不规则片状、且表面带有裂痕;CFSCP呈大小不一的球状,且表面凹陷,这可能是CFSCP经过造粒等工艺处理,外观更加细腻光滑。由图1-b可知,TOSCP胃消化后在120倍下呈不规则的块状、小球状,放大到1 000倍后,呈大小不一的球状黏着在一起,光滑程度不一,可能是胶原蛋白肽为抵抗胃蛋白酶水解发生了皱缩以及冻干造成的;由图1-e可知,CFSCP胃消化后形状不规则,孔隙大小不均,放大到1 000倍后呈现不均一块状且表面有孔洞;这可能是大分子质量的CFSCP在胃蛋白酶作用下发生剧烈水解,肽链间作用力减小的原因导致,这与FANG等[14]体外模拟消化鲢鱼蛋白后所观察的结果相似。由图1-c可知,TOSCP和CFSCP肠消化后在120倍下表面松散,呈絮状,放大到1 000倍后呈排列不规则蜂窝网状结构,表面有大小不一的孔隙,这一结构可有利于蛋白酶进入TOSCP和CFSCP内部,提高多肽消化程度。

图1 TOSCP和CFSCP消化前后扫描电镜图Fig.1 SEM image of TOSCP and CFSCP during each digestion stage注:A~C为TOSCP各消化阶段在×120的SEM图;a~c为TOSCP各消化阶段在×1 000的SEM图;D~F为CFSCP各消化阶段在×120的SEM图;d~f为CFSCP各消化阶段在×1 000的SEM图,比例尺表示400 μm
2.2 消化前后多肽微观结构
采用FITC对2种胶原蛋白肽样品进行染色,使用CLSM观察了胶原蛋白肽体系在胃肠消化过程中的微观结构变化。从TOSCP和CFSCP消化前的CLSM图(图2-A、图2-a)中可以看出,2种样品在未消化前均可观察到明显的绿色荧光(多肽)区域,但CFSCP的形状更规则,接近于球形,与SEM显示的结果一致,这可能是多肽粉末处理方式不同所致。从图2-B、图2-b可观察到荧光显色区域明显减少,与傅丹宇[15]消化乳蛋白后荧光标记物的变化相一致,说明胶原蛋白肽经胃消化后含量均减少。TOSCP和CFSCP进一步经肠消化后(图2-C、图2-c),荧光物质基本消失。
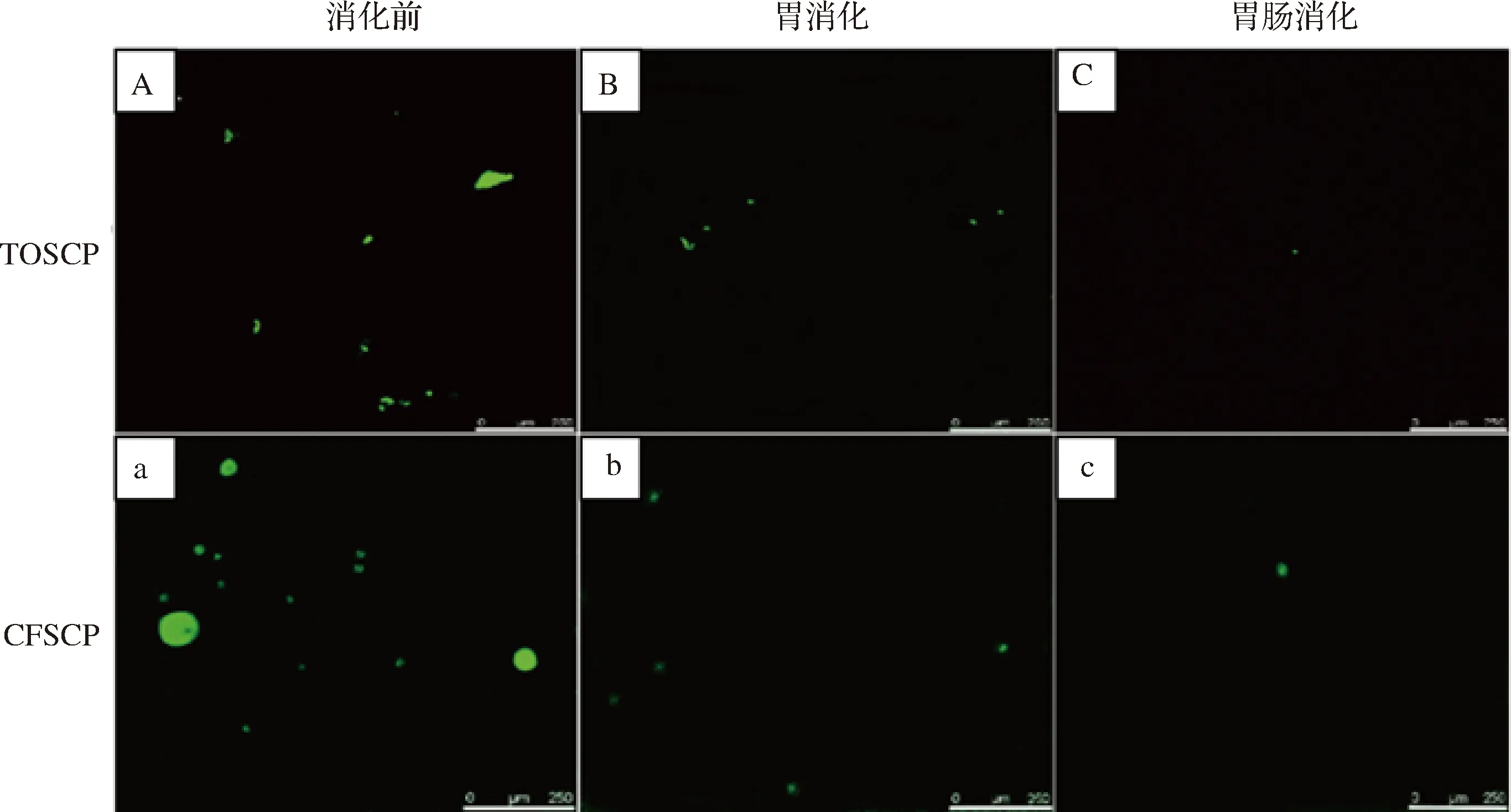
图2 TOSCP和CFSCP消化前后激光共聚焦图Fig.2 CLSM image of TOSCP and CFSCP during each digestion stage注:比例尺表示250 μm
2.3 消化前后的分子质量分布以及多肽消化率
胶原蛋白肽分子质量大小与生物利用度直接相关,低分子质量的多肽在消化过程中可尽可能的保持完整并在组织中发挥活性[6]。多肽分子质量分布和多肽消化率可直观体现在不同消化阶段中多肽肽键断裂情况及氨基酸存在形式。由TOSCP和CFSCP消化前后的分子质量比例分布图(图3)可知,TOSCP在消化前分子质量主要集中在0.2 k~1 kDa,比例为63.49%,其次为3 k~10 kDa和1 k~3 kDa,比例为19.22%和13.22%;CFSCP消化前分子质量>10 kDa的比例为27.82%,3 k~10 kDa为25.17%,1 k~3 kDa为21.37%,0.2 k~1 kDa为24.81%,其1 kDa以上的高分子质量多肽远高于TOSCP。
TOCSP和CFSCP经胃消化后多肽消化率如图4所示,分别为(22.40±1.57)%和(25.55±0.20)%,无显著性差异(P≥0.05),TOSCP在胃消化阶段显示出了较好的抗消化性,且分子质量分布在各范围内并无明显变化;CFSCP经过胃消化后>10 kDa和1 k~3 kDa比例明显减少,其他范围比例增加,这可能因为CFSCP自身分子质量较大,更易在胃中被胃蛋白酶识别断键,释放小分子质量多肽和游离氨基酸,所

图3 TOSCP和CFSCP消化前后分子质量比例分布Fig.3 Molecular weight ratio distribution of TOSCP和CFSCP during each digestion stage
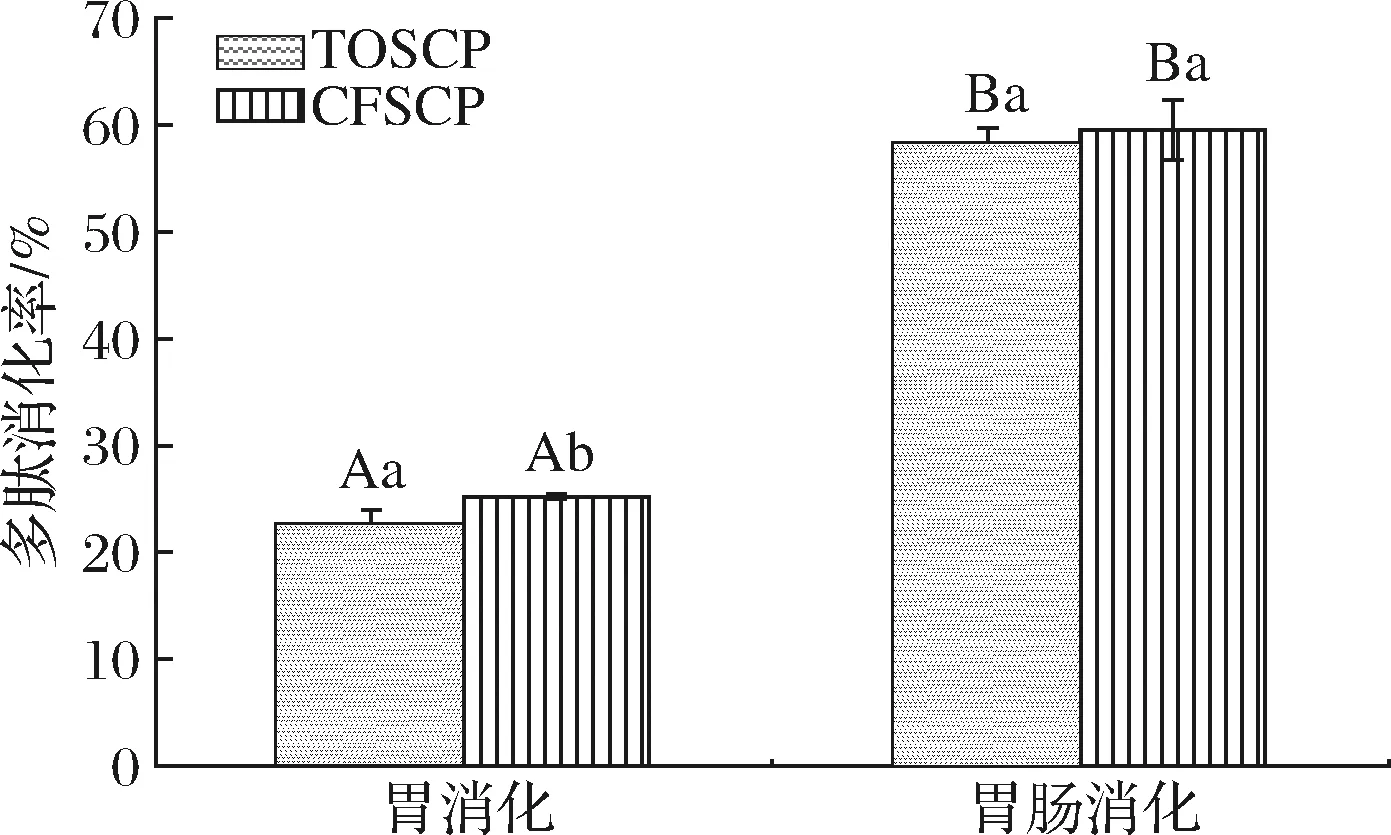
图4 TOSCP和CFSCP的多肽消化率Fig.4 Peptide digestibility of TOSCP and CFSCP during each digestion stage注:大写字母不同代表不同胶原蛋白肽,同种处理差异显著;小写字母不同代表同种胶原蛋白肽,不同处理差异显著(P<0.05),下同
以多肽消化率高于TOSCP,这说明胃蛋白酶对高分子质量多肽(>1 kDa)具有更强的嗜好性,其更加趋向于断键大肽为小肽,破坏其可能形成的空间结构,并释放部分游离氨基酸,这与大豆水解蛋白的体外模拟消化结果相似[16]。
TOSCP和CFSCP经肠消化后多肽消化率进一步增加,分别为(58.26±0.68)%和(59.57±2.81)%,两者无显著性差异(P>0.05)。但两者之间分子质量分布存在区别,CFSCP中0.2 k~3 kDa的多肽含量显著上升,这是因为CFSCP自身分子质量较大,且经胃蛋白酶作用可有效增加胰蛋白酶识别和切割位点数量[17],使肽键更易断裂;而TOSCP经肠消化后,发现3 kDa以上的多肽比例大量减少,说明该组分更倾向于在肠道内被胰蛋白酶水解。值得注意的是,2种活性肽<1 kDa比例在2段消化过程中均出现明显提高,TOSCP经肠消化后<1 kDa为85.39%,而CFSCP<1 kDa的比例明显少于TOSCP,为52.55%,因此分子质量在1 kDa以下的胶原蛋白活性肽可有效抵制胃蛋白酶作用,并有效减少胰蛋白酶的水解。先前的研究证实,1 kDa以下的寡肽组分更易被吸收[18],因此经肠消化后的TOSCP<1 kDa比例更多,分子质量更小,更易吸收。
2.4 消化前后多肽红外光谱分析及二级结构变化

TOSCP和CFSCP经胃肠消化后,2种胶原蛋白肽峰形均发生了变化。由于C—N伸缩和N—H弯曲振动,酰胺Ⅱ带分别在TOSCP和CFSCP的1 537和1 528 cm-1处出现吸收峰。经胃消化后,TOSCP中酰胺Ⅱ带的出峰位置不变,但CFSCP发生红移,经肠消化后,二者均发生红移,峰形也发生了变化,推测胶原蛋白肽亚基结构发生了变化。酰胺Ⅲ带分别在TOSCP和CFSCP的1 244和1 241 cm-1处有明显吸收峰,经胃消化后,TOSCP和CFSCP均无显著变化,经肠消化后,均发生红移,2种胶原蛋白肽变化趋势一致,具体变化还有待进一步研究[20]。

图5 TOSCP和CFSCP消化前后红外光谱图Fig.5 Infrared spectra of TOSCP and CFSCP during each digestion stage
二级结构可从侧面反映多肽分子的松散程度,多肽分子有序刚性结构的基础可归因于具备较多氢键的α-螺旋与β-折叠[20]。由图6可知,TOSCP和CF-SCP在消化前二级结构主要以β-折叠为主,含量分

图6 TOSCP和CFSCP消化前后二级结构含量Fig.6 The secondary structure contents of TOSCP and CFSCP during each digestion stage
别为29.64%和34.56%,表明2种胶原蛋白肽肽链间多以平行或反平行排列,这种有序的二级结构由于具备较大的氢键表面积而有利于多肽稳定性。经过胃消化后,2种胶原蛋白肽在酸性条件下经胃蛋白酶处理,β-折叠和无规卷曲含量减少,α-螺旋和β-转角含量增加。这类变化可有效促进分子内部聚合,缩减肽链长度增强其机械强度,使其链间变得更加稳定以增强其对胃蛋白酶消化抵抗力[19],这与扫描电镜图(图1)结果相对应。TOSCP和CFSCP进一步经肠消化后,2种多肽β-折叠进一步减少,而α-螺旋和β-转角含量增加,这可能是因为β-折叠含量减少有助于α-螺旋的形成[21],同时多肽链反转180°形成β-转角[22],使消化期间多肽消化产物β-折叠含量减少,β-转角含量增加。这一结构变化表明经胰蛋白酶作用后肽链间变得松散,而链内部收缩[21],形成蜂窝网状结构。VANGA等[23]发现胰蛋白酶活性与β-折叠的含量呈负相关,与α-螺旋的含量呈正相关,由二级结构变化而引发的空间结构的改变可能会进一步改变酶的作用位点进而影响活性肽的消化,这可解释TOSCP和CFSCP在肠消化阶段的多肽消化率和氨基酸释放率更高的原因。胶原蛋白活性肽经胃肠道消化后并不会完全水解成氨基酸,而是以一部分稳定的空间结构存在,并以α-螺旋结构为主。α-螺旋具备跨越生物膜磷脂双分子层的能力可直接被人体吸收[24],因此胶原蛋白活性肽会在胃肠道酶的诱导下逐渐转化为具备刚性结构的α-螺旋结构,进而被吸收。
2.5 消化过程中多肽氨基酸含量变化
胶原蛋白活性肽的氨基酸组成是影响其消化特性的重要因素,可通过各消化阶段过程中各类氨基酸相对含量变化来揭示胶原蛋白肽的消化特性和对生物可及性的影响[6]。表2为TOSCP和CFSCP在模拟胃肠消化过程中氨基酸的相对含量。经胃消化,TOSCP和CFSCP的疏水性氨基酸的相对含量显著降低(P<0.05),分别为2.26%和1.93%,这与酶的专一性有关,胃蛋白酶更嗜好于苯丙氨酸、缬氨酸等疏水性氨基酸残基[25],这类氨基酸作为β-折叠结构的重要组成部分,它们的减少将进一步导致β-折叠结构的含量减少,与二级结构变化相对应[21]。经胃肠消化后,TOSCP和CFSCP中碱性氨基酸和疏水性氨基酸含量进一步降低,且具有显著性差异(P<0.05),这可能与多肽序列差异有关,胰蛋白酶的反应位点一般是紧邻精氨酸或赖氨酸的肽键[25],因此含有更多碱性氨基酸的多肽比含有更多酸性氨基酸的肽更易被消化。经过胃肠消化,TOSCP和CFSCP两种多肽在消化过程中的各类氨基酸含量变化相似,且脯/羟脯氨酸可有效抵制胃肠蛋白酶作用(P<0.05)[26],呈现了较强的抗消化性,这与ZHONG等[27]的研究结果相似。结合多肽消化率和氨基酸含量、分子质量的变化可知,胶原蛋白活性肽在胃消化阶段主要以大肽断键为主,而在肠消化阶段,多肽的疏水性、碱性氨基酸残基作为特异性反应位点被水解,释放大量1 kDa以下的多肽。
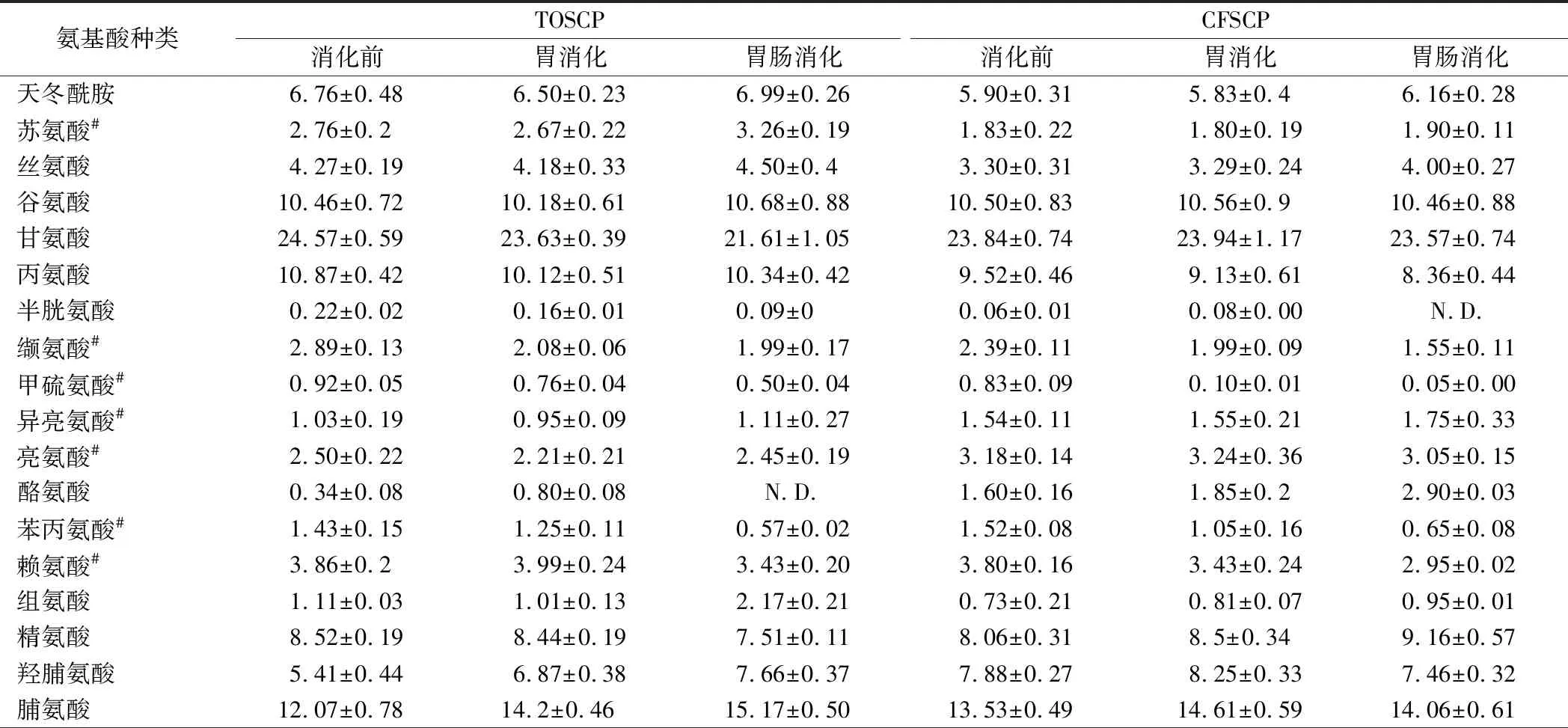
表2 TOSCP和CFSCP在各消化阶段氨基酸相对含量变化 单位:%

续表2
2.6 消化前后多肽抗氧化性变化
抗氧化活性是胶原蛋白活性肽的重要功能特性之一,可有效遏制心血管疾病的发生,抵制由自由基引发的脂质过氧化所导致的各类疾病[6,12],故选取抗氧化性作为消化过程中多肽生物稳定性的判断指标。抗氧化活性与多肽结构特征密切相关,如分子质量、特定氨基酸组成以及二级结构[6]等,通过对不同消化阶段中多肽的DPPH自由基清除率和总还原力的测定,探究胶原蛋白活性肽消化过程中结构特征变化对胶原蛋白肽生物稳定性的影响。
DPPH自由基作为一种稳定自由基,其中心结构中的氮原子可与多肽自由基清除剂配对,使其还原为DPPH-H非自由基形式,以此来判断其抗氧化活性。在各浓度梯度下,TOSCP和CFSCP在不同消化阶段展现出相同的变化趋势,在消化前,TOSCP和CFSCP抗氧化活性差异较大,在5 mg/mL质量浓度下,TOSCP和CFSCP的DPPH自由基清除率分别为49.59%和7.89%(P<0.05)。经胃消化后,TOSCP和CFSCP的抗氧化活性均出现显著提高(5 mg/mL,P<0.05),在10 mg/mL质量浓度下,CFSCP的DPPH自由基清除率可达28.77%,较未消化前活性上升3.60倍,这可能是因为胃蛋白酶的作用,使先前未表现或潜在的活性肽从亲本序列中释放出来生成新的抗氧化多肽,或经水解后更多具备抗氧化活性的疏水性氨基酸残基被暴露,使抗氧化活性升高[6];经过胃肠消化后,TOSCP的抗氧化活性出现小幅度下降(P>0.05),这是因为特定的氨基酸相对含量的变化以及其序列中位置的改变所导致,由于胰蛋白酶作用,使具备抗氧化活性的疏水性氨基酸从肽链完整结构中释放致使抗氧化活性降低;同时已有研究证明,多肽α-螺旋结构增加可降低其抗氧化性,因此在消化过程中,α-螺旋结构的增加也是降低其抗氧化活性原因之一[13]。
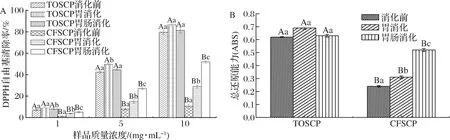
A-DPPH自由基清除率;B-总还原能力(样品浓度为5 mg/mL)图7 TOSCP和CFSCP消化前后抗氧化活性变化Fig.7 Antioxidant activity changes of TOSCP and CFSCP during each digestion stage
多肽的总还原能力强弱可通过吸光度的大小来反映,并与吸光度数值呈正比[12]。在5 mg/mL质量浓度下TOSCP和CFSCP在不同消化阶段中总还原能力变化趋势和DPPH自由基清除率相似,但在消化前或消化中任何一阶段TOSCP还原能力显著高于(P<0.05)CFSCP,这可能与分子质量大小有关,小分子质量的TOSCP更易在N末端暴露出更多具备抗氧化活性的疏水性氨基酸和支链氨基酸[25],另外,TOSCP中高含量甘氨酸、谷氨酸、丙氨酸等氨基酸可通过作为H+供体促进肽与自由基的反应,表现出较高的抗氧化活性[3]。BUSTAMANTE等[28]使用碱性蛋白酶、糜蛋白酶和风味酶水解乳清蛋白制备的不同分子质量多肽,发现低分子质量水解物具备更高的抗氧化活性;WU等[1]从鲑鱼皮中截取分子质量<3 kDa的胶原蛋白肽组分,该组分DPPH自由基清除率可达73.29%;CHI等[29]从蓝鳍金枪鱼皮中制备纯化了3种具有抗氧化性能的胶原蛋白肽,其分子质量均<1 kDa。因此多肽分子质量集中分布于1 kDa以下的TOSCP在胃肠消化过程中的抗消化性和结构完整性优于CFSCP,由此表现出较高的抗氧化活性。
3 结论与讨论
本文利用INFOGEST体外消化模型探究了TOSCP和CFSCP在不同消化阶段中结构特征变化及其对抗氧化活性的影响。结果表明,小分子质量的TOSCP表现出了更好的抗消化性和生物稳定性。TOSCP和CFSCP在胃消化阶段中多肽消化率分别为22.40%和25.55%,胃蛋白酶主要以断键大肽为小肽为主,且对高分子质量胶原蛋白活性肽(>1 kDa)具有更强的选择专一性;消化过程中发现,1 kDa以下多肽能有效抵制胃肠蛋白酶作用,且由于酶的专一性,脯氨酸和羟脯氨酸表现出了优越的抗消化性能,疏水性氨基酸和碱性氨基酸更易释放;多肽会在胃肠道酶诱导下逐渐转化为具备刚性结构的α-螺旋结构,并在扫描电镜下可观察到蜂窝网状结构。1 kDa以下的多肽在胃肠消化过程中可保持结构完整性并发挥其抗氧化活性,因此集中分布于1 kDa以下的TOSCP在不同消化阶段中其抗氧化活性始终较高;胃消化过程中小分子质量多肽的释放均促进了TOSCP和CFSCP抗氧化活性提高,但经过胃肠2个阶段消化后,α-螺旋结构的增加、具有抗氧化活性的疏水性游离氨基酸的大量释放将导致抗氧化活性下降,该研究为胶原蛋白多肽功能性制品的研发提供实验依据。
