低升糖指数饮食对老年女性脂联素和血脂以及血糖指标的影响
2021-12-17谭跃李哲曾惠燕陈冰莹刘东升王三贵
谭跃 李哲 曾惠燕 陈冰莹 刘东升 王三贵
据统计,目前我国老年女性中心性肥胖的发生率超过20%,中心性肥胖是心脑血管疾病、糖尿病等慢性疾病的主要高危因素,易导致脑卒中、残疾等严重后果,极大威胁着老年人的健康[1]。血糖指数(glycemic index,GI)是衡量食物引起人体餐后血糖反应的一项有效指标,反映食物引起血糖上升速度的快慢,而GI≤55的食物被称为低升糖指数饮食(low glycemic index diet,LGID)[2]。国内有研究表明,持续4周以上的LGID能够在一定程度上降低研究对象的血脂水平,也可以降低体质量、体质量指数(body mass index,BMI)和腰围等体格参数,并降低心血管疾病和糖尿病的发生率和严重程度[2-3]。但目前国内外关于LGID是否能影响脂联素(adiponectin,ADPN)水平的研究较少。本研究分析持续3个月LGID对老年女性BMI、血脂指标、ADPN、糖化血红蛋白(glycosylated hemoglobin,HbA1c)和空腹胰岛素(insulin,INS)水平的影响,现报告如下。
1 资料与方法
1.1 研究对象 选择2020年1—6月在东莞市南城医院体检的200名老年女性作为研究对象,年龄60~69岁,分为研究组和对照组,每组100名,研究周期为3个月。研究周期内失访25名,最终研究组85名、对照组89名体检者完成了本研究。两组人员入组时的年龄、BMI和血脂指标等一般资料比较差异均无统计学意义(均P>0.05)。见表1。
表1 对照组和研究组体检者入组时一般资料及实验室检查指标比较(±s)

表1 对照组和研究组体检者入组时一般资料及实验室检查指标比较(±s)
注:对照组维持原有的饮食习惯,研究组给予低升糖指数饮食(LGID);BMI为体质量指数,LDL-C为低密度脂蛋白胆固醇,HDL-C为高密度脂蛋白胆固醇,TG为三酰甘油,TC为总胆固醇,ADPN为脂联素,HbA1c为糖化血红蛋白,INS为空腹胰岛素
组别 人数(名) 年龄(岁) BMI(kg/m2) LDL-C(mmol/L) HDL-C(mmol/L) TG(mmol/L) TC(mmol/L)对照组 89 65.15±2.69 25.06±2.28 3.16±0.87 1.33±0.28 1.90±1.06 5.24±1.06研究组 85 65.32±2.63 24.95±2.49 3.37±0.89 1.34±0.25 1.85±0.96 5.46±1.01 t值 0.525 0.986 1.566 0.255 0.341 1.388 P值 0.671 0.336 0.119 0.799 0.733 0.167组别 人数(名) TG/HDL-C LDL-C/HDL-C ADPN(mg/L) HbA1c INS(mU/L)对照组 89 1.60±1.21 2.41±0.63 4.60±2.12 0.063±0.014 11.54±5.99研究组 85 1.52±1.05 2.57±0.71 4.87±2.23 0.063±0.010 10.51±5.97 t值 0.482 1.506 0.817 0.245 1.144 P值 0.630 0.134 0.415 0.807 0.254
1.2 研究方法 所有研究对象入组时测量身高、体质量,并计算BMI;入组时和研究结束后抽取空腹静脉血检测血脂指标、ADPN、HbA1c和INS水平。
1.2.1 饮食方式 对照组人员维持原有的饮食习惯,研究组人员每月参加1次LGID相关科普教育,主要讲授LGID的相关知识。本课题组向研究对象提供了1份低GI含碳水化合物的食物列表,要求其从列表中选择谷物、水果、蔬菜和奶制品等碳水化合物。此外,强调限制高脂肪食品、快餐、油炸食品、工业饮料和不健康脂肪摄入。每2周进行1次电话随访,调整研究对象的日常饮食结构,鼓励其多进食低GI食物。3个月后所有研究对象复查入组时实验室指标,计算相应数据差值(研究结束时—入组时)。
1.2.2 体格指标测量 研究对象的身高和体质量均于上午空腹时测量,受试者排空尿便,测量时仅穿背心、短裤。采用上禾SH-200G智能医用身高体重秤进行测量,每位受试者测量3次,取平均值。体质量精确到0.1 kg,身高精确到0.1 cm,计算BMI。
1.2.3 实验室检查 采集所有研究对象空腹静脉血,检测血脂指标、ADPN、HbA1c和INS。① 血脂指标包括高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、三酰甘油(triacylglycerol,TG)和总胆固醇(total cholesterol,TC),均采用罗氏cobas C501全自动生化分析仪进行检测,获取数据后计算TG/HDL-C和LDL-C/HDL-C比值;② INS检测使用罗氏cobas e601全自动生化分析仪,采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA);③ ADPN、HbA1c检测标本通过冷链运送至广东优尼德生物科技有限公司,ADPN采用乳胶增强免疫比浊方法进行检测,HbA1c采用高效液相色谱法进行检测。
1.3 伦理学 本研究符合医学伦理学标准,经东莞市南城医院医学伦理委员会审批(审批号:2021-6),所有检测均获得受检者或家属的知情同意。
1.4 统计学方法 采用SPSS 24.0统计软件对数据进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验;入组时和研究结束时组内数据比较采用配对t检验。各指标差值均通过(研究结束时—入组时)计算所得。相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 两组研究结束时的ADPN、血脂和血糖代谢指标比较 研究组的BMI、TG、HbA1c、TG/HDL-C、LDL-C/HDL-C和INS水平均明显低于对照组,而HDL-C和ADPN水平均明显高于对照组,差异均有统计学意义(均P<0.05);两组LDL-C和TC比较差异均无统计学意义(均P>0.05)。见表2。
表2 对照组和研究组体检者研究结束时BMI和实验室检查指标比较(±s)
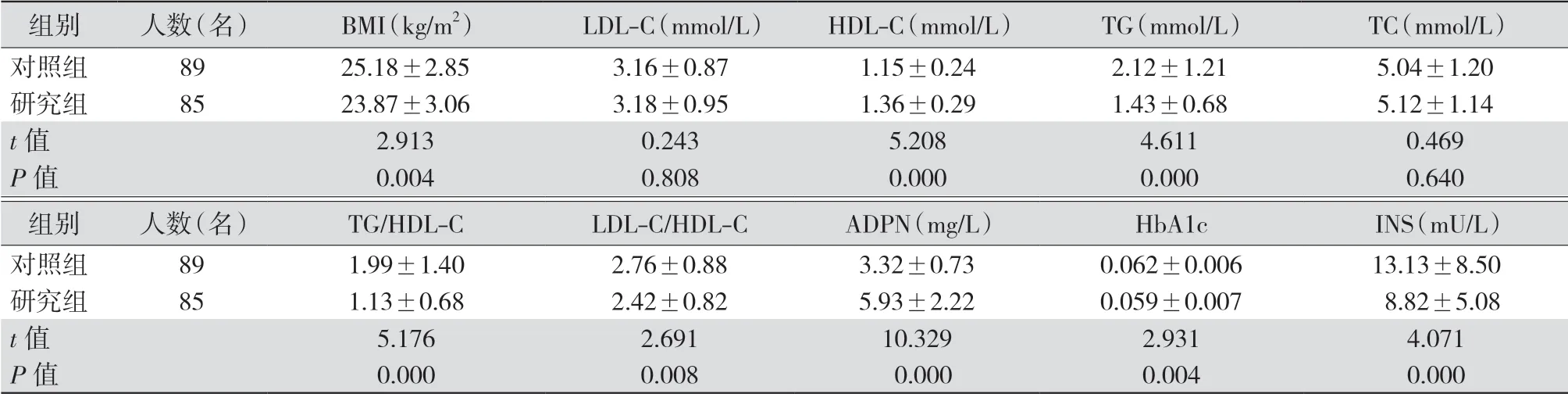
表2 对照组和研究组体检者研究结束时BMI和实验室检查指标比较(±s)
注:对照组维持原有的饮食习惯,研究组给予低升糖指数饮食(LGID);BMI为体质量指数,LDL-C为低密度脂蛋白胆固醇,HDL-C为高密度脂蛋白胆固醇,TG为三酰甘油,TC为总胆固醇,ADPN为脂联素,HbA1c为糖化血红蛋白,INS为空腹胰岛素
组别 人数(名) BMI(kg/m2) LDL-C(mmol/L) HDL-C(mmol/L) TG(mmol/L) TC(mmol/L)对照组 89 25.18±2.85 3.16±0.87 1.15±0.24 2.12±1.21 5.04±1.20研究组 85 23.87±3.06 3.18±0.95 1.36±0.29 1.43±0.68 5.12±1.14 t值 2.913 0.243 5.208 4.611 0.469 P值 0.004 0.808 0.000 0.000 0.640组别 人数(名) TG/HDL-C LDL-C/HDL-C ADPN(mg/L) HbA1c INS(mU/L)对照组 89 1.99±1.40 2.76±0.88 3.32±0.73 0.062±0.006 13.13±8.50研究组 85 1.13±0.68 2.42±0.82 5.93±2.22 0.059±0.007 8.82±5.08 t值 5.176 2.691 10.329 2.931 4.071 P值 0.000 0.008 0.000 0.004 0.000
2.2 对照组入组时和研究结束时实验室检查指标的变化 对入组时和研究结束时实验室检查指标进行配对t检验,结果表明,对照组研究结束时HDL-C和ADPN水平均明显低于入组时,LDL-C/HDL-C明显高于入组时,差异均有统计学意义(均P<0.05);其他指标入组时和研究结束时比较差异均无统计学意义(均P>0.05)。见表3。
表3 对照组体检者入组时和研究结束时BMI与实验室指标比较(±s)

表3 对照组体检者入组时和研究结束时BMI与实验室指标比较(±s)
注:对照组维持原有的饮食习惯;BMI为体质量指数,LDL-C为低密度脂蛋白胆固醇,HDL-C为高密度脂蛋白胆固醇,TG为三酰甘油,TC为总胆固醇,ADPN为脂联素,HbA1c为糖化血红蛋白,INS为空腹胰岛素
时间 人数(名) BMI(kg/m2) LDL-C(mmol/L) HDL-C(mmol/L) TG(mmol/L) TC(mmol/L)入组时 89 25.06±2.28 3.16±0.87 1.33±0.28 1.90±1.06 5.24±1.06研究结束时 89 25.18±2.85 3.15±1.07 1.15±0.24 2.12±1.21 5.04±1.20差值 0.11±0.71 -0.01±1.40 -0.18±0.40 0.22±1.69 -0.20±1.57 t值 1.483 0.089 4.256 1.227 1.205 P值 0.142 0.929 0.000 0.223 0.231时间 人数(名) TG/HDL-C LDL-C/HDL-C ADPN(mg/L) HbA1c INS(mU/L)入组时 89 1.60±1.21 2.42±0.63 4.60±2.12 0.063±0.013 11.54±5.99研究结束时 89 1.99±1.40 2.76±0.88 3.32±0.73 0.062±0.006 13.13±8.51差值 0.39±1.95 0.35±1.06 -1.28±2.34 -0.001±0.015 1.58±9.04 t值 1.867 3.074 5.163 0.351 1.651 P值 0.065 0.003 0.000 0.727 0.102
2.3 研究组入组时和研究结束时实验室检查指标的变化 对入组时和研究结束时实验室检查指标进行配对t检验,结果表明,研究结束时,研究组BMI、TG、TC、TG/HDL-C、HbA1c、INS水平均明显低于入组时,ADPN水平明显高于入组时,差异均有统计学意义(均P<0.05),其余参数比较差异均无统计学意义(均P>0.05)。见表4。
表4 研究组体检者入组时和研究结束时BMI与实验室指标比较(±s)
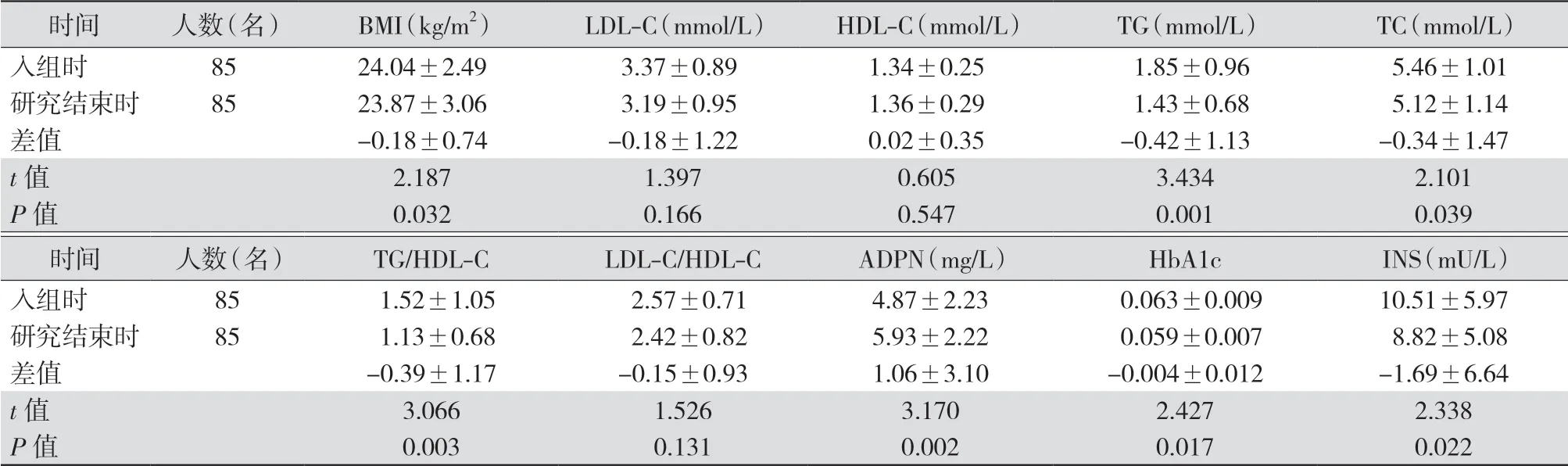
表4 研究组体检者入组时和研究结束时BMI与实验室指标比较(±s)
注:研究组给予低升糖指数饮食(LGID);BMI为体质量指数,LDL-C为低密度脂蛋白胆固醇,HDL-C为高密度脂蛋白胆固醇,TG为三酰甘油,TC为总胆固醇,ADPN为脂联素,HbA1c为糖化血红蛋白,INS为空腹胰岛素
时间 人数(名) BMI(kg/m2) LDL-C(mmol/L) HDL-C(mmol/L) TG(mmol/L) TC(mmol/L)入组时 85 24.04±2.49 3.37±0.89 1.34±0.25 1.85±0.96 5.46±1.01研究结束时 85 23.87±3.06 3.19±0.95 1.36±0.29 1.43±0.68 5.12±1.14差值 -0.18±0.74 -0.18±1.22 0.02±0.35 -0.42±1.13 -0.34±1.47 t值 2.187 1.397 0.605 3.434 2.101 P值 0.032 0.166 0.547 0.001 0.039时间 人数(名) TG/HDL-C LDL-C/HDL-C ADPN(mg/L) HbA1c INS(mU/L)入组时 85 1.52±1.05 2.57±0.71 4.87±2.23 0.063±0.009 10.51±5.97研究结束时 85 1.13±0.68 2.42±0.82 5.93±2.22 0.059±0.007 8.82±5.08差值 -0.39±1.17 -0.15±0.93 1.06±3.10 -0.004±0.012 -1.69±6.64 t值 3.066 1.526 3.170 2.427 2.338 P值 0.003 0.131 0.002 0.017 0.022
2.4 研究组ADPN变化与其他指标变化的相关性本研究分析研究组ADPN变化与血脂及血糖代谢指标变化的相关性,结果显示,在给予LGID后,ADPN的变化与HDL-C的变化呈正相关,与TG、TG/HDL-C、INS的变化均呈负相关,结果均有统计学意义(均P<0.05),即ADPN水平升高越多,则HDL-C水平升高越多,TG、TG/HDL-C、INS水平降低越多;ADPN与BMI、LDL-C、TC、LDL-C/HDL-C、HbA1c均无显著相关性(均P>0.05)。见表5。

表5 研究组ADPN变化与血脂及血糖代谢指标变化的相关性分析
3 讨论
近年来,随着人们生活水平的提高,加之不良的饮食习惯和运动量减少以及老年人基础代谢率降低等因素,老年人超重和肥胖的比例明显升高,超重与肥胖也成为糖尿病、高血压等慢性非感染性疾病高发的重要危险因素[4]。因此,通过改变膳食结构(如LGID)或服用调节血脂的药物来控制体质量,是目前预防和控制老年人慢性病发病和减少疾病损伤的主要手段[5-6]。
肥胖人群可伴有脂肪组织对胰岛素的敏感性降低,甚至出现胰岛素抵抗,从而导致一系列的代谢紊乱[7-8]。既往研究报道,LGID可能影响糖尿病或肥胖人群的胰岛素、HbA1c、炎症标志物等胰岛素抵抗相关指标水平,并通过降低高胰岛素血症患者的胰岛素水平和改善胰岛素敏感性来降低2型糖尿病患者的TG、TC和LDL-C[9],同时改善代谢综合征患者的脂质分布和脂蛋白比值[10],但对HDL-C水平无影响[11]。
本研究结果表明,在给予3个月LGID后,研究组的BMI、TG、TG/HDL-C、LDL-C/HDL-C、HbA1c和INS水平均明显低于对照组,而HDL-C则明显高于对照组,这与上述研究结果不相符。为此,本课题组进一步比较了两组研究对象入组时和研究结束时各指标的变化,结果表明,两组BMI、TG、HbA1c和INS水平出现差异是由于研究组长期LGID引起的各指标下降,但HDL-C的差异则来源于对照组HDL-C的降低,并非LGID可以提升血浆中的HDL-C水平。本研究结果还显示,LGID可降低TG/HDL-C的比值,而TG/HDL-C比值综合了血脂调控两方面的指标,可以作为非糖尿病患者高胰岛素血症和胰岛素抵抗的一个简单有效的预测因子[12],提示LGID可能通过降低胰岛素水平及胰岛素抵抗来改善非糖尿病患者的血糖代谢指标,甚至能够降低糖尿病的发生率。这一假想是否成立,仍需要通过前瞻性队列研究来进行验证。
ADPN是一种由脂肪组织合成并释放的内分泌因子,作为导致肥胖的抗炎因子的一部分,可增强组织对胰岛素的敏感性,同时还有抗动脉粥样硬化和抗炎特性,这就使得ADPN可能成为预防及治疗慢性代谢性疾病(如2型糖尿病、代谢综合征、心血管疾病和肥胖等)的新方法[13]。有学者针对老年人的饮食习惯进行了1年的随访,结果表明,饮食的GI与人体内ADPN水平呈负相关,接受高GI饮食的受试者血浆ADPN水平下降更多[14]。而另一项针对肥胖和超重青少年女性的研究结果却显示,接受不同GI饮食的受试者10周后血浆ADPN水平变化无显著差异[15],提示食物GI对血浆ADPN水平的影响可能存在年龄和性别差异,甚至研究时间的长短也可能对结果产生影响。
本研究结果表明,老年女性进行3个月LGID之后,血浆ADPN水平升高,而维持原有饮食结构的人群ADPN水平反而降低。ADPN水平升高一方面能促进糖原合成,降低血糖水平,增加各组织对胰岛素的敏感性,降低INS水平;另一方面,通过激活其下游的腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路,可增加TG分解和脂肪酸氧化,同时抑制脂肪合成,起到降低血脂和减少脂肪堆积的作用[16]。这些变化与本研究所示血脂指标、HbA1c和INS水平的变化一致。Pearson相关分析结果显示,ADPN水平升高越多,TG、TG/HDL-C及INS降低程度越大,因此推测ADPN相关途径可能参与了LGID改善胰岛素抵抗、降低血脂指标和BMI的过程。
综上所述,3个月的LGID可以提升老年女性血浆ADPN水平,并降低BMI、血脂指标、HbA1c及INS水平。ADPN相关途径可能参与了LGID降低血脂指标和改善胰岛素抵抗的过程,但这一假想是否成立仍有待于进一步的研究证实。
利益冲突所有作者均声明不存在利益冲突
