经皮微波消融联合125I 粒子植入治疗纵隔恶性肿瘤的疗效观察
2021-12-16蔡进中陈旭东张彦舫陈现现
蔡进中, 陈旭东, 张彦舫, 孔 健, 陈现现
原发性纵隔恶性肿瘤病理类型多样, 常见的有恶性胸腺瘤、神经源性肿瘤、畸胎瘤、恶性淋巴瘤等[1]。部分纵隔恶性肿瘤手术切除率低、术后复发率高、放化疗不敏感,治疗效果差[2-4]。各种微创介入治疗技术,如经皮微波消融(MWA)、射频消融(RFA)、125I 放射性粒子植入等用于治疗纵隔恶性肿瘤后,显著提高了疗效[5-6]。 本研究比较了 MWA 联合125I 放射性粒子植入与单纯MWA 治疗纵隔恶性肿瘤的疗效和安全性。
1 材料与方法
1.1 临床资料
纳入 2011 年 9 月至 2019 年 9 月收治的纵隔恶性肿瘤患者67 例,其中男41 例,女26 例,年龄36~74 岁,平均(39.7±13.4)岁。 病灶最大直径5.10~16.00 cm,平均直径(8.17±3.05) cm。 全部病例均经过病理确诊,其中神经内分泌癌10 例,胸骨后甲状腺腺癌8 例,软骨肉瘤、脂肪肉瘤各5 例,纵隔鳞癌6 例、腺癌7 例、小细胞低分化癌5 例,恶性淋巴瘤4 例,侵袭性胸腺瘤、恶性畸胎瘤、淋巴瘤术后复发各 3 例,其他肿瘤 8 例。 接受 MWA 联合125I 放射性粒子植入的有31 例, 单纯MWA 治疗的有36例,两组患者在年龄、性别、肿瘤大小及病理学类别上差异无统计学意义(表1)。
表1 两组患者基线资料 n(%)
1.2 方法
1.2.1 MWA 采用SurblateTM双源水冷微波消融系统(型号MTC-3C),包括双源微波发生器、冷循环泵、温度监测装置。 MWA 针采用南京维京九洲一次性水冷MWA 针(型号MTC-3CA-Ⅱ4/6,直径17 G、长度10 cm 或15 cm)。 术前行增强CT 检查明确肿瘤大小、范围及邻近器官组织,根据先深后浅、先边缘后中央的布针原则,设计进针路径、规划消融范围。 术中先在CT 扫描下定位体表穿刺点,然后根据设计路径插入MWA 针, 确认位置准确后开始消融治疗。 视消融针位置及患者耐受情况,消融功率为45~80 W,单次消融时间3~10 min。对于肿瘤较大者,采用单针多点或多针多点的消融方法;在确保周围脏器安全前提下,尽可能使肿瘤得到最大面积消融。
1.2.2 MWA 联合125I 放射性粒子植入方法 术前根据增强CT 设计消融及粒子范围、路径,对于肿瘤边缘、邻近危险脏器等消融危险区域,采用放射性粒子治疗计划系统(TPS)制订粒子植入计划。 术中MWA步骤如上所述,消融结束后扫描CT,确认肿瘤消融的实际情况,对肿瘤残留区域,采用TPS 进一步设计、补充植入粒子。 粒子植入步骤如下:按TPS 设计,CT 引导下确定体表穿刺部位、进针方向、角度及深度, 将18 G 粒子植入导针自选定穿刺点经皮肤插入肿瘤病灶内, 针头距靶肿瘤边缘1.0~1.5 cm处停止,连接粒子枪,用推送杆将首颗粒子推出,然后根据治疗计划坐标, 自远而近逐步退针植入125I放射性粒子。 同上述步骤按计划插入其他粒子针,植入粒子。 粒子植入后扫描CT 进行确认,并进行剂量验证,对于剂量欠缺区域再进行补充植入,确保照射范围覆盖靶区。
1.2.3 观察指标 治疗后3 个月行CT 动态增强扫描检查,根据改良实体瘤疗效评价标准(mRECIST)进行疗效评价。 观察两组患者治疗后1 个月内出血、气胸、胸水等相关并发症发生情况。
1.3 统计学分析
应用SPSS 13.0 统计学软件对数据进行处理,用χ2检验比较两种疗法的疗效及安全性, 以P<0.05为差异有统计学意义。
2 结果
2.1 治疗后3 个月评价
治疗后3 个月, MWA 联合125I 放射性粒子植入组及单纯 MWA 组的有效率(RR:CR+PR)分别为83.9%和 55.6%,差异有统计学意义(P<0.05)(表 2)。
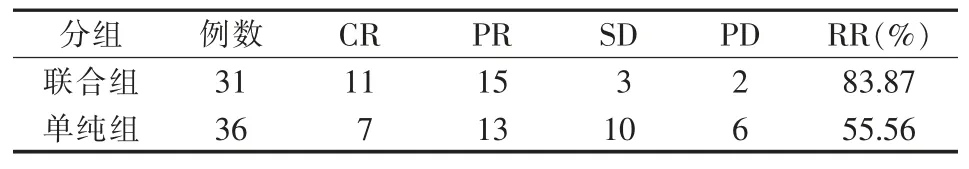
表2 联合组与单纯组的短期疗效比较
2.2 术后1 个月内并发症比较
治疗后1 个月内MWA 联合125I 组并发症发生率为25.81%,单纯MWA 组为19.44%,差异无统计学意义(P>0.05)(表 3)。
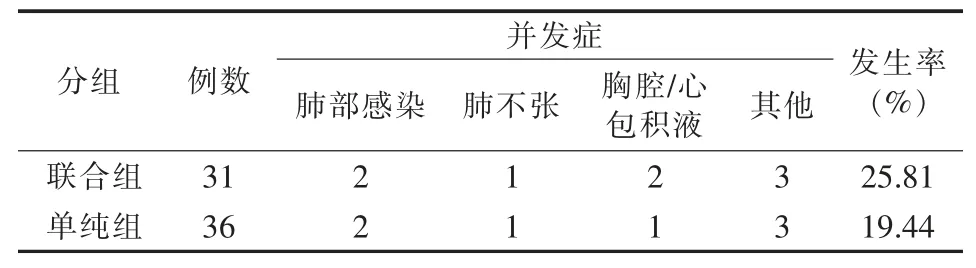
表3 两组患者1 个月内手术并发症情况
3 讨论
纵隔恶性肿瘤被发现时多已侵犯周围血管、神经、心包等,手术切除率低、难度大、风险高,且往往对放化疗等常规治疗手段不敏感[7-8]。 介入治疗技术,包括消融治疗(微波、射频、冷冻等)、125I 放射性粒子植入、纳米刀、经动脉化疗栓塞等,具有创伤小、疗效确切、并发症少、可重复性强等优点,已广泛应用于肝癌、肺癌及转移癌等多种实体肿瘤的治疗[9-11]。
MWA 是利用微波电场使肿瘤细胞分子内摩擦产热,造成局部高温,从而快速使肿瘤细胞发生凝固性坏死[12]。CT 导引下 MWA 治疗纵隔恶性肿瘤有以下优点:①热效率高、升温快、高温热场较均匀、凝固区坏死彻底,可有效杀灭癌细胞;②CT 引导定位精确,随时扫描监测,可有效保护危险组织器官;③因MWA 的肿瘤组织留在体内, 可诱发抗瘤细胞的免疫反应等,使机体细胞免疫功能得到恢复与增强[13-14]。 但单纯 MWA 存在以下缺点:①单针消融范围有限,往往需要单针多次或多针联合消融;②消融危险区域,难以精准把握消融边界,对肿瘤死角难以彻底清扫。
纵隔恶性肿瘤行125I 放射性粒子植入有诸多优点:①有效克服纵隔位置狭小、周围危险脏器众多等解剖因素对多针穿刺和多点消融的限制;②可有效填补危险区域消融的劣势, 对肿瘤死角彻底清扫。同时,125I 放射性粒子本身具有诸多优势:①靶区外放射剂量迅速降低,有效保护正常组织;②放射源置于肿瘤内部,靶区治疗剂量高;③持续照射,效应持久;④高度适形,便于操作[15]。 MWA 后,针对残留或危险区域植入125I 放射性粒子, 一方面可以减少穿刺出血;另一方面既控制了粒子数目,又可协同、有效杀灭肿瘤,从而达到更优的效果。
本研究观察结果显示,MWA 及125I 放射性粒子植入均为纵隔恶性肿瘤有效的治疗方法, 其中MWA 联合125I 粒子植入的疗效优于单纯MWA,且并未增加相关并发症发生率, 值得临床进一步推广、应用。 本研究不足之处在于仅观察治疗后的短期疗效,其远期疗效有待进一步随访和研究。
