乙醇和锌离子对爪蟾卵母细胞表达的5′-三磷酸腺苷门控P2X3受体的影响
2021-12-16张玉芹韩书清
徐 珍, 张玉芹, 韩书清
(1. 湖北省武汉市红十字会医院 重症医学科, 湖北 武汉, 430024;2. 武汉科技大学医学院 生理学教研室, 湖北 武汉, 430065)
P2X受体是一种快速作用的、具有阳离子渗透性的离子通道,被突触释放的细胞外5′-三磷酸腺苷(ATP)激活产生电流。在中枢神经系统中, ATP通过作用突触后膜上的P2X受体而直接介导快速的兴奋性的突触传递。此外, ATP在突触前对P2X受体起作用,以调节其他神经递质如γ-氨基丁酸(GABA)、甘氨酸和谷氨酸[1-2]。既往研究主要集中在检测两栖动物背根神经节(DRG)神经元中原生的P2X受体,只有少数研究分析了乙醇对P2X受体的影响,有研究[3]对刚分离的成年大鼠海马CA1神经元进行检测,根据在DRG和海马神经元中的这些发现提出了乙醇作用于中枢神经系统的重要效应因子是P2X受体。然而,这些乙醇敏感的天然P2X受体的亚基组成以及乙醇对这些天然嘌呤受体的作用位点尚未确定[4]。本研究旨在检测乙醇或锌离子(Zn2+)对爪蟾卵母细胞表达的重组P2X3受体的影响,分析Zn2+和乙醇共同作用于P2X3受体的影响,并预测乙醇/Zn2+联合研究可以为深入了解乙醇和Zn2+对P2X受体的作用机制提供依据,现报告如下。
1 材料与方法
1.1 实验动物、重组质粒、药品及试剂
成熟雌性非洲爪蟾(中国科学院生物遗传与发育研究所提供)。大鼠颈上神经节重组质粒pcDNA3-P2X3由Dr. BUELL G(Glaxo Institute for Molecular Biology)构建。OR2溶液: KCl 2 mmol/L, MgCl220 mmol/L, NaCl 82 mmol/L和HEPES(pH值7.5); 卵母细胞孵育液: KCl 2 mmol/L, NaCl 96 mmol/L, MgCl21 mmol/L, CaCl21 mmol/L, HEPES 5.0 mmol/L, 使用前高压灭菌[5], 并加茶碱0.6 mmol/L、丙酮酸2.5 mmol/L、1%马血清和0.05 mg/mL庆大霉素。
1.2 cRNA的体外转录及卵母细胞纤维注射
CaCl2法制备感受态细菌,将P2X3受体的重组质粒转移至大肠杆菌E.coliDH5α中扩增、质粒提取、纯化、线性化,以线性化的DNA为模板,体外转录成cRNA。取成熟雌性爪蟾,冰浴麻醉,手术取卵,在HEPES液中加入0.2%的胶原酶A进行消化,以去除卵母细胞的滤泡膜及血管膜。将卵母细胞置于孵育液中,在18 ℃培养箱中培养6~7 h, 将P2X3受体的cRNA注射到卵母细胞的胞浆中,每个细胞注射40~50 nL(浓度为1 ng/nL)。设空白对照组和注射等量三蒸水的对照组,在18 ℃培养箱中培养48 h后,用于电生理研究[6]。
1.3 双电极电压钳记录
在室温中使用双极电压钳放大器进行记录。将注射P2X3受体cRNA的卵母细胞置于细胞池中,电压电极和电流电极充灌3 mmol/L的KCl溶液。电极尖端电阻在0.5~1.5 MΩ, 膜电位钳制为-60 mV。电流电极所记录的信号经过放大、转换,输入计算机采样和存储,并通过计算机实时监测。ATP、ZnCl2等均用标准细胞外液配置,并将pH值调至7.4~7.6。实验用药均通过8通道加药系统给药,给药时间为30 s, 加药时间间隔为5 min。通道电流用pCLAMP软件记录和分析,使用Excel和SPSS11.5软件包对原始数据进行处理后,以均数±标准误表示,记录的电流振幅为峰值,n表示所研究的细胞数量。显著性差异通过非配对t检验和单向方差分析(ANOVA),P<0.05为差异有统计学意义。采用CytoBench软件对数据进行采样、存储和分析。实验数据的处理及图表的绘制采用Sigma plot软件。ATP/乙醇浓度-反应曲线使用逻辑方程式获得量-效曲线:I/Imax=100×(药物)n/[(药物)n+(EC50)n], 其中I/Imax表示当前效应和最大效应百分比, EC50为半效能作用浓度,n为Hill系数。
第1组实验是在-60 mV的钳制电位下,依次使用含6、12、25、50、100、200 mmol/L浓度的乙醇和0.3 μmol/L ATP的Ringer′s液灌流卵母细胞,记录到不同幅值的ATP-激活电流; 此后在有或无100 mmol/L乙醇的情况下记录ATP的量-效曲线。第2组实验在-60 mV的钳制电位下,依次使用含5、10、25、40、50、100、300 μmol/L浓度的Zn2+和0.3 μmol/L ATP的Ringer′s液灌流卵母细胞,记录下诱导产生的ATP-激活电流的幅值; 低浓度Zn2+(≤25 μmol/L)在2、5、10、25 μmol/L诱导的ATP激活电流的幅值; 此后在有或无100 μmol/L Zn2+的情况下记录了ATP的量-效曲线。第3组检测单独使用乙醇(100 mmol/L)和低浓度Zn2+(5 μmol/L)对EC10ATP门控电流的影响。在同一卵母细胞中,检测了乙醇和Zn2+共存对ATP门控电流的影响。
2 结 果
2.1 乙醇(5~200 mmol/L)可逆性地增强了爪蟾卵母细胞中表达的P2X3受体的ATP门控功能
乙醇对爪蟾卵母细胞表达的大鼠同型P2X3受体中ATP激活电流见图1。图1A显示: 5~200 mmol/L乙醇能显著地、可逆性地、浓度依赖性地增强EC10ATP门控电流[单向ANOVA:F(5, 26)=12.15,P<0.001]。图1B显示: 应用EC10ATP(0.3 μmol/L ATP)30 s(Vh=-60 mV)产生的ATP激活内向电流,乙醇和ATP共同应用30 s。0.3 μmol/L ATP +100 mmol/L乙醇产生的ATP激活电流,0.3 μmol/L ATP+200 mmol/L乙醇产生的ATP激活电流,当ATP和乙醇(上水平条,左100 mmol/L, 右200 mmol/L)应用于卵母细胞时的电流水平形态,垂直标尺表示0.2 mA, 水平标尺表示30 s。图1C显示: 连续性记录了EC10ATP(0.3 μmol/L ATP)作用60、30、45 s(从左到右)对ATP激活电流的影响,说明了P2X3受体快速脱敏, ATP激活瞬态电流短暂性的特性。
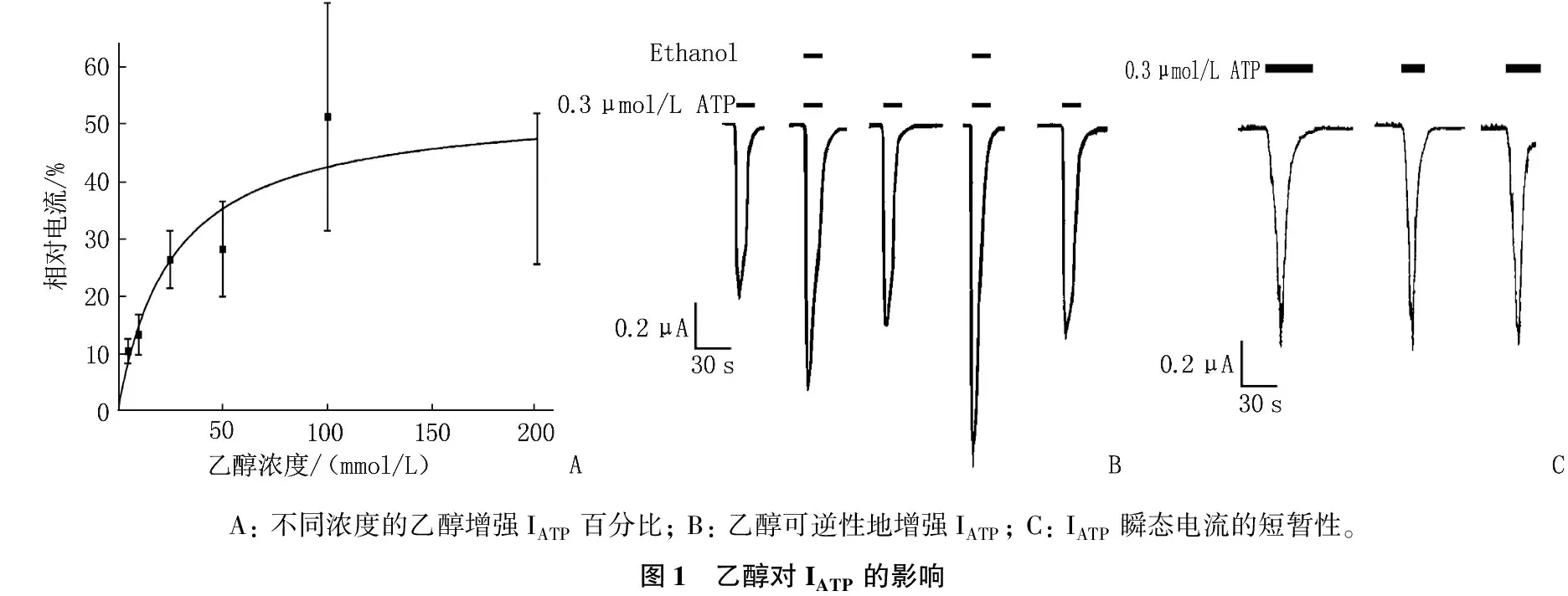
A: 不同浓度的乙醇增强IATP百分比; B: 乙醇可逆性地增强IATP; C: IATP瞬态电流的短暂性。图1 乙醇对IATP的影响

A: 乙醇引起IATP的量-效曲线左移; B: 100、300 μmol/L ATP对P2X3受体产生相似的最大效应, 100 mmol/L乙醇对300 μmol/L ATP缺乏作用。
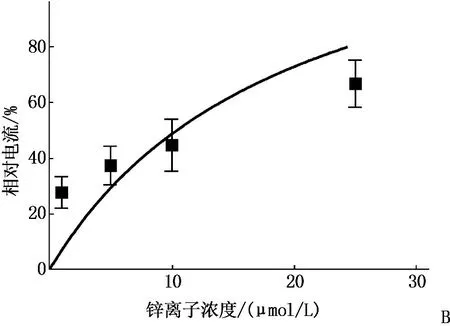
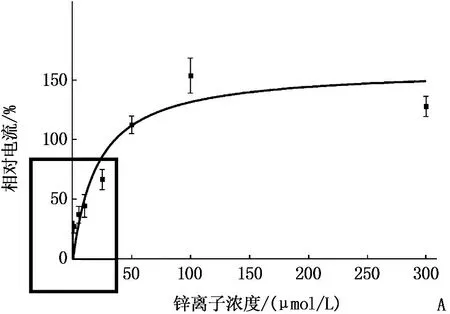
A: 锌离子对IATP的量-效曲线; B: 低浓度锌离子IATP的量-效曲线。
2.2 有或无100 μmol/L乙醇情况下P2X3受体的ATP浓度-反应关系
乙醇以变构的方式增强ATP效应,表现为ATP量-效曲线左移和ATP的EC50下降3倍,即从无乙醇时(2.35±0.10) μmol/L降至有乙醇时(0.97±0.12) μmol/L。乙醇不会改变Hill系数或ATP最大效应(Emax),说明乙醇在较高的ATP浓度(100、300 μmol/L)时缺乏作用,即乙醇对最大ATP浓度300 μmol/L产生的效应无显著影响。见图2。

2.3 Zn2+(1~300 μmol/L)可逆性地增强了爪蟾卵母细胞中表达的P2X3受体的ATP门控功能
应用EC10ATP(0.1~0.3 μmol/L ATP)30 s(Vh=-60 mV)激活产生ATP内向电流。Zn2+与ATP共同作用30 s, 用药之间的冲洗时间至少为5 min。作者发现了Zn2+(1~300 μmol/L)可逆性地、浓度依耐性地诱导了EC10ATP激活电流,浓度在100 μmol/L时电流数值趋于平稳, A图中左下大方框放大后为图B所示,低浓度Zn2+(≤25 μmol/L)诱导的ATP激活电流的浓度-反应关系。见图3。
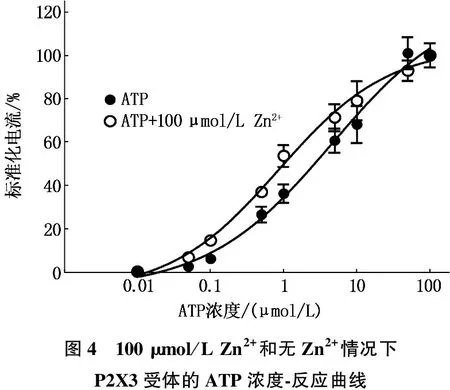
2.4 有或无Zn2+情况下P2X3受体的ATP量-效曲线
Zn2+(100 μmol/L)导致ATP量-效曲线发生左移,在没有Zn2+存在时, 100 μmol/L ATP激活电流的反应曲线(Vh=-60 mV)。作者发现Zn2+增加了ATP的效应,在没有Zn2+存在下, ATP EC50是(4.59±0.26),在Zn2+存在的情况下降至(0.87±0.01), Hill系数分别是(0.51±0.15)和(0.58±0.13); 在较高浓度ATP EC下(>70 μmol/L), Zn2+并未显著改变当前的反应, ATPEmax=(127.6±20.49) μmol/L, ATP+Zn2+Emax=(106.3±7.53) μmol/L,P=0.34。见图4(每个数据点代表5个不同卵母细胞的平均值±标准误)。
2.5 乙醇和Zn2+对增强P2X3受体有协同作用
首先,作者检测单独使用乙醇(100 mmol/L)和低浓度Zn2+对EC10ATP门控电流的影响。接下来(在同一卵母细胞中),作者检测了乙醇和Zn2+共存对ATP门控电流的影响。与作者最初的研究一致,单独应用乙醇或Zn2+在P2X3受体中显著增强了ATP门控电流。乙醇和Zn2+联合应用导致协同作用,大于单独应用时增强ATP的反应。作者还检测了乙醇对Zn2+最大增强效应的影响,发现共同应用100 mmol/L乙醇和100 μmol/L Zn2+增加ATP门控电流比单独应用100 μmol/L Zn2+时的最大电流增加了(31.3±8.8)%, 无论用药的顺序如何,乙醇都会增强Zn2+引起的最大效应。见图5。
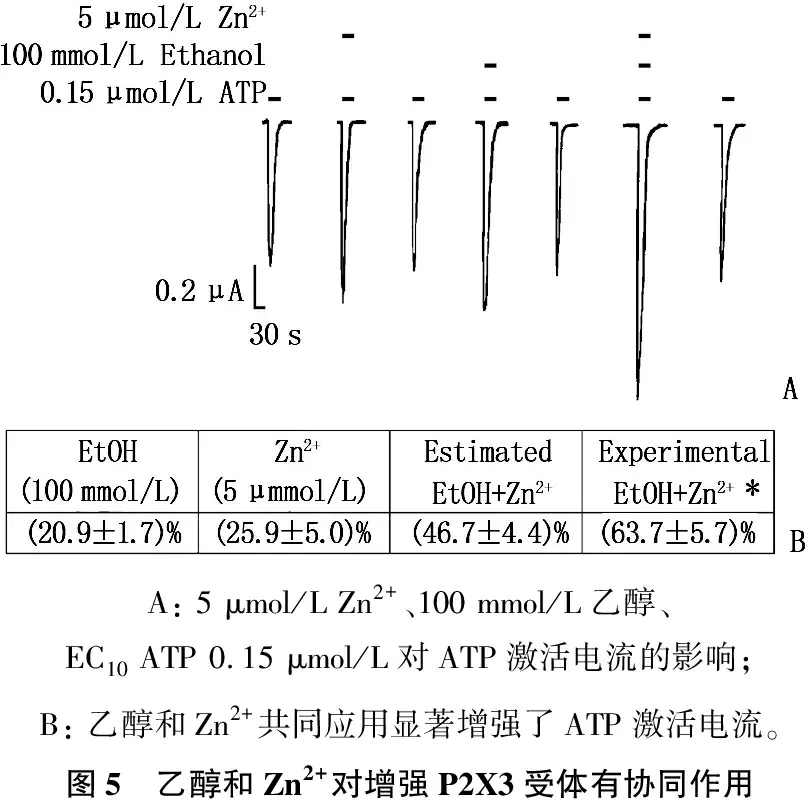
A: 5 μmol/L Zn2+、100 mmol/L乙醇、EC10 ATP 0.15 μmol/L对ATP激活电流的影响; B: 乙醇和Zn2+共同应用显著增强了ATP激活电流。图5 乙醇和Zn2+对增强P2X3受体有协同作用
3 讨 论
作者用双极电压钳技术检测了乙醇对爪蟾卵母细胞表达的P2X3受体门控电流的影响,乙醇增强了ATP对P2X3受体的影响。此外,乙醇增强了Zn2+对P2X3受体的最大增强效应,这表明乙醇和Zn2+可能在P2X3受体的不同位点或不同机制上起作用。在最大的ATP浓度下,乙醇对任何一种受体亚型都没有显著影响。有研究[7]表明, pH值和金属离子组成可影响P2X受体功能,但这些变量在本研究中得到了控制。有研究[8]报道, ATP浓度会影响P2X受体对乙醇的敏感性,本研究通过使用等效的EC10浓度检测乙醇抑制ATP激活电流来控制这一因素。因为在低浓度ATP的情况下,乙醇对P2X2和P2X4受体上的ATP功能的抑制更稳定可靠(通常为EC5~20)。但是,在较高ATP水平的情况下,很难测量到乙醇的作用(例如EC50), 因为乙醇的抑制程度低,而且受体更容易发生脱敏[9]。
先前对P2X3受体介导的ATP门控电流的浓度-反应关系研究表明,在30、100、300 μmol/L时,ATP激活电流的平均振幅差异无统计学意义, 100 μmol/L ATP很容易获得最大有效的IATP。本研究的ATP 浓度-反应关系与之前的EC50和Hill系数方面的研究非常一致。然而,当细胞外液含有Mg2+和Ca2+时,需要更高的ATP浓度作为最大有效ATP浓度,因为这些二价阳离子与ATP螯合,导致ATP浓度-反应曲线右移。本研究中,作者用Zn2+取代了细胞外的Mg2+和Ca2+,因此测定的ATP最大效应与之前一致[10-12]。
ATP是中枢神经系统中一个重要的信号分子,因为其激活嘌呤能受体,包括ATP门控阳离子通道家族(嘌呤能P2X受体)[13],虽然嘌呤能信号的发展背景很少受到关注,但是最近的研究[14]表明,细胞外ATP及其衍生物在祖细胞增殖、迁移、分化和突触发生中起到重要作用。目前人们认识到,嘌呤能信号在各种器官中起着重要的生理作用,但在疾病中也起着作用,将嘌呤能受体和外核酸酶作为治疗靶点[15]。特别是在神经系统中, ATP和腺苷参与神经调节、胶质-神经元的相互作用和感觉传递,但也参与神经性疼痛、神经退行性疾病和多发性硬化症。P2X3受体主要存在于背根和三叉神经节的痛觉感受器感觉神经元中,并在疼痛传导中起着关键作用[16]。疼痛是一种主观和复杂的心理过程,涉及到感觉、情感和认知障碍,并具有复杂的潜在机制。传统药物可以很好地缓解疼痛,但由于许多不可避免的副作用,其效果不能令人满意[17]。向啮齿动物皮肤注射ATP可诱导伤害感受行为,而使用P2X3受体拮抗剂可产生减低对疼痛刺激敏感性的作用[18]。ATP门控P2X3受体在伤害性传导中表达,在促进有害机械刺激传导到中枢神经系统方面发挥重要作用。糖尿病神经病变的疼痛是由大鼠通过蛋白激酶C激活背根神经元膜上调P2X3受体引起。研究[19]发现腰椎间盘突出引起神经损伤后机械痛是由DRG神经P2X3受体的表达和功能增强引起。此外,嘌呤能受体作为酒精和其他滥用药物的研究焦点,乙醇调节P2XRs可能会直接或间接地影响神经元的活动,从而导致行为功能的改变。这些发现为P2X受体内使用分子操作奠定了基础,可用来研究和确定乙醇的分子位点和作用机制。
