芦荟苷通过下调HMGB1的表达抑制乳酸诱导的胃癌细胞增殖和迁移
2021-12-16蔡田雨陈雪雷程振宇吴晓明齐世美戚之琳
蔡田雨,陈雪雷,程 锦,程振宇,吴晓明,齐世美,戚之琳
皖南医学院1生物化学与分子生物学教研室,2活性生物大分子研究安徽省重点实验室,3临床医学院,安徽 芜湖 241002
肿瘤细胞在常氧条件下亦可通过糖酵解途径产生大量乳酸,这种被称为瓦伯格效应的现象是肿瘤细胞代谢的重要特点[1]。肿瘤细胞产生的大量乳酸通过细胞膜上的单羧酸转运体(MCFs)释放至胞外。肿瘤微环境中的乳酸作为信号分子通过G蛋白偶联受体GPR81介导的信号途径,参与调控肿瘤血管形成、肿瘤细胞转移、免疫逃逸和化疗抵抗等过程[2,3]。虽然已有大量的研究证明乳酸与多种类型肿瘤的不良进展有关,但是乳酸调控肿瘤增殖和转移的分子机制尚不完全清楚[2,4]。
高迁移率族盒蛋白1(HMGB1)在肿瘤细胞中高表达,且与肿瘤细胞的增殖、迁移及化疗抵抗等多种生物学过程有关[5]。HMGB1可通过主动分泌和被动释放的方式释放至胞外,作为信号分子诱发二次生物学效应[6]。有研究发现,HMGB1通过RAGE介导的常氧糖酵解,增加乳酸生成,活化成纤维细胞,促进乳腺癌细胞转移[7]。我们前期研究发现,HMGB1可调控周期蛋白和增殖细胞核抗原的表达,促进胃癌细胞的增殖[8]。乳酸通过调控多个关键致癌基因和其它涉及代谢重组、细胞周期调控和增殖的驱动基因的转录活性,在肿瘤形成和增殖等过程中发挥重要作用[4]。鉴于上述研究,我们猜测HMGB1可能参与了乳酸对肿瘤细胞增殖和迁移的调控作用。然而,乳酸能否调控HMGB1的表达和释放、促进肿瘤细胞的增殖和迁移尚未见报道。探明乳酸对HMGB1 表达和释放的影响,将为靶向乳酸和HMGB1的抗肿瘤治疗提供实验依据。
芦荟苷具有抗炎[9-11],抗肿瘤[12-14]等作用。我们前期研究已证明,芦荟苷不仅能够下调HMGB1表达和释放,促进胃癌细胞凋亡[13],还能抑制胃癌细胞的增殖和迁移[15]。芦荟苷能否通过下调乳酸诱导的HMGB1表达和释放,抑制乳酸诱导的胃癌细胞增殖和迁移?这些尚未见报道。解决上述问题将为乳酸在肿瘤增殖和迁移中的分子机制提供新见解,亦为芦荟苷的抗肿瘤机制提供新视角。
1 材料和方法
1.1 试剂、抗体和药品
芦荟苷(Aloin,ALO,纯度:99.8%,selleck);乳酸(sigma);EdU细胞增殖检测试剂盒(锐博生物科技有限公司);β-actin,GAPDH,Cyclin D1,Cyclin E1和PCNA抗体购自CST(Beverly);鼠单克隆抗体E-cadherin,N-cadherin,MMP-2,MMP-9 and HMGB1(Santa Cruz).辣根过氧化物酶标记的第二抗体购于CST;高糖DMEM 培养基和0.25%的胰酶(Gibco),胎牛血清(Hyclone),青霉素-链霉素(碧云天生物技术公司)。
1.2 细胞培养
胃癌BGC-823细胞(广州吉妮欧生物科技有限公司)用含10%胎牛血清,1%青霉素-链霉素的高糖DMEM完全培养基,置于二氧化碳培养箱中常规培养,培养条件为37 ℃,5%CO2。细胞每2~3 d传代1次。
1.3 EdU实验
BGC-823细胞种植于24孔细胞培养板,至细胞贴壁后分组进行药物处理。实验分组如下:对照组、乳酸组、乳酸与不同浓度芦荟苷联合组。细胞增殖能力采用EdU试剂盒检测,具体操作按厂家提供的说明书进行。荧光倒置显微镜观察结果并拍照(100×,Olympus,Tokyo,Japan)。EdU阳性染色细胞(红色)占总细胞(蓝色)的百分比表示细胞增殖率。
1.4 克隆形成实验
BGC-823细胞按照1000个细胞/孔的密度种植在6孔细胞培养板中,细胞贴壁后进行药物处理,实验分组同1.3。药物作用24 h后更换新鲜培养基,继续培养1周。培养板中的细胞经PBS洗涤后,用4%多聚甲醛室温固定20 min,0.1%的结晶紫室温染色30 min。最后PBS洗涤细胞3次,于倒置显微镜下计数各组细胞克隆数,并拍照,细胞数>15计为1个克隆。
1.5 划痕实验
BGC-823细胞接种于12孔细胞培养板,待细胞达到单层融合,用200 μL的灭菌枪头进行划痕,PBS清洗去除漂浮细胞。之后按照实验分组(同1.3)对细胞进行药物处理。用倒置显微镜观察0 h和24 h的细胞划痕愈合情况,Image J软件分析实验结果。
1.6 Transwell实验
分组处理后的BGC-823细胞(分组同1.3),用无血清的高糖DMEM重悬,取200 μL细胞悬液放置在小室上层,含20%胎牛血清的高糖DMEM培养基600 μL放置在小室下层。置于二氧化碳培养箱继续培养24 h。滤膜上层的细胞用棉棒轻轻擦除,迁移至滤膜下层的细胞用4%多聚甲醛室温固定20 min,0.1%的结晶紫染色30 min之后,放置在倒置显微镜下观察并拍照。
1.7 Western blot
药物分组处理后的BGC-823细胞,弃去完全培养基,用预冷的PBS洗涤细胞1次,然后加入细胞裂解液(含PMSF)冰上裂解细胞40 min,收集细胞裂解液,12 000 r/min离心10 min。收集的上清中加入SDS上样缓冲液煮沸5 min,取等量蛋白进行SDS-PAGE。电泳分离的蛋白转印至NC膜上,然后用脱脂奶粉室温封闭1 h。TBST清洗后加入相应一抗(CST 公司抗体1∶500稀释,Santa Cruz公司抗体1∶200稀释)4 ℃孵育过夜,之后用辣根过氧化物酶标记的二抗(1∶10 000稀释,CST公司产品)室温孵育2 h,TBST洗涤3次后用化学发光成像系统检测实验结果,Image J软件对蛋白表达进行半定量分析。
1.8 ELISA
药物分组处理后的胃癌细胞,收集细胞培养上清,HMGB1的释放量采用ELISA(武汉博美)检测。具体实验操作按照试剂盒说明书进行,每组3个复孔。
1.9 细胞转染
HMGB1干扰质粒和阴性对照质粒购自吉凯基因公司(上海),脂质体转染试剂lipo3000为赛默飞公司产品。BGC-823细胞接种于12孔细胞培养板,待细胞达到50%~60%融合进行脂质体转染,具体转染步骤按公司提供的说明书进行。
1.10 统计分析
实验数据均以均数±标准差表示,SPSS 17.0分析实验结果,两组间比较采用studentt检验,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 芦荟苷减弱乳酸诱导的胃癌细胞增殖
克隆形式实验表明,乳酸处理组细胞克隆数明显高于对照组,而芦荟苷联合乳酸处理的胃癌细胞,克隆数目与乳酸单独处理组相比显著降低,且芦荟苷的抑制作用呈现出浓度依赖性(图1)。EdU实验检测细胞增殖率发现,乳酸单独刺激的胃癌细胞与对照组相比,增殖率明显升高;而芦荟苷联合乳酸组,细胞的增殖能力与乳酸单独处理组相比明显下降(图2)。
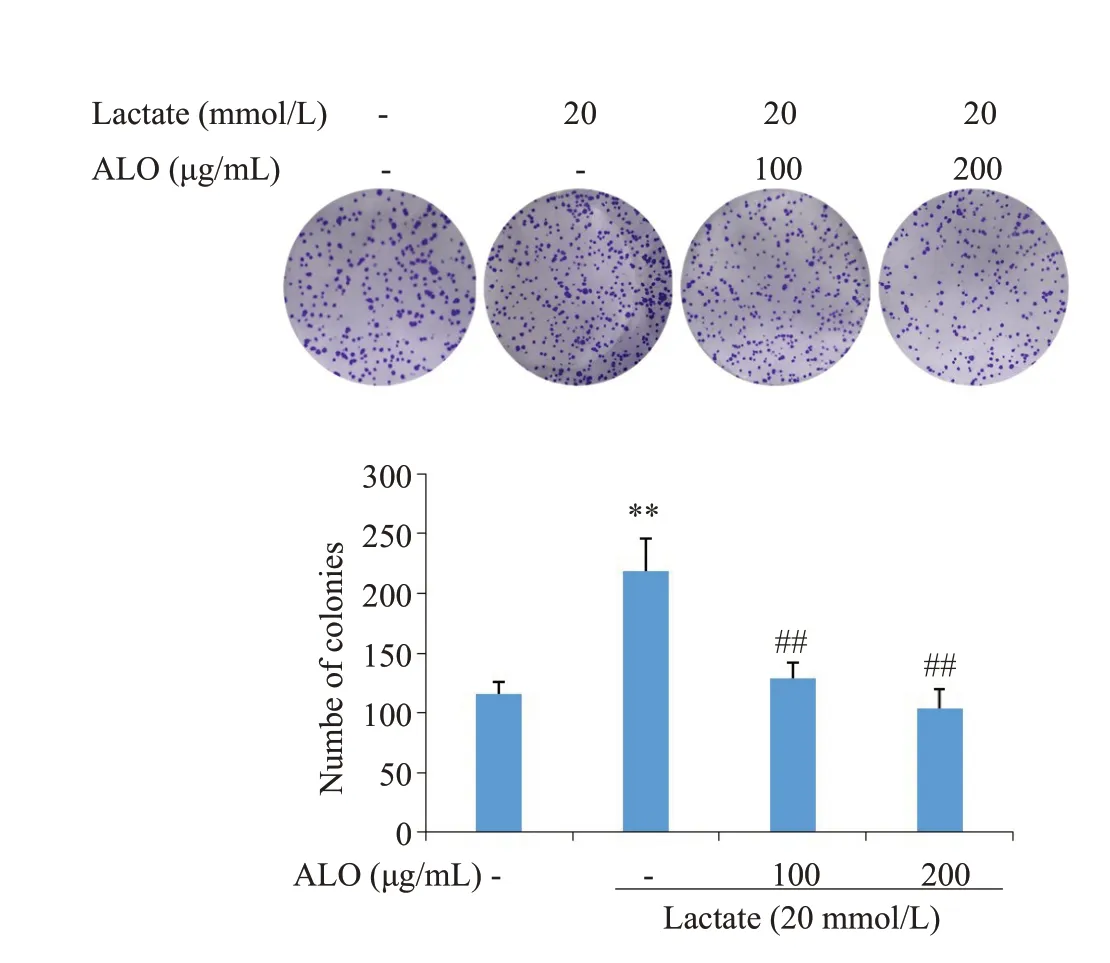
图1 芦荟苷对乳酸诱导胃癌细胞克隆形成的影响Fig.1 Effects of aloin on lactate-induced colony formation by gastric cancer cells (Crystal violet staining).**P<0.01 vs control;##P<0.01 vs lactate group(n=3).
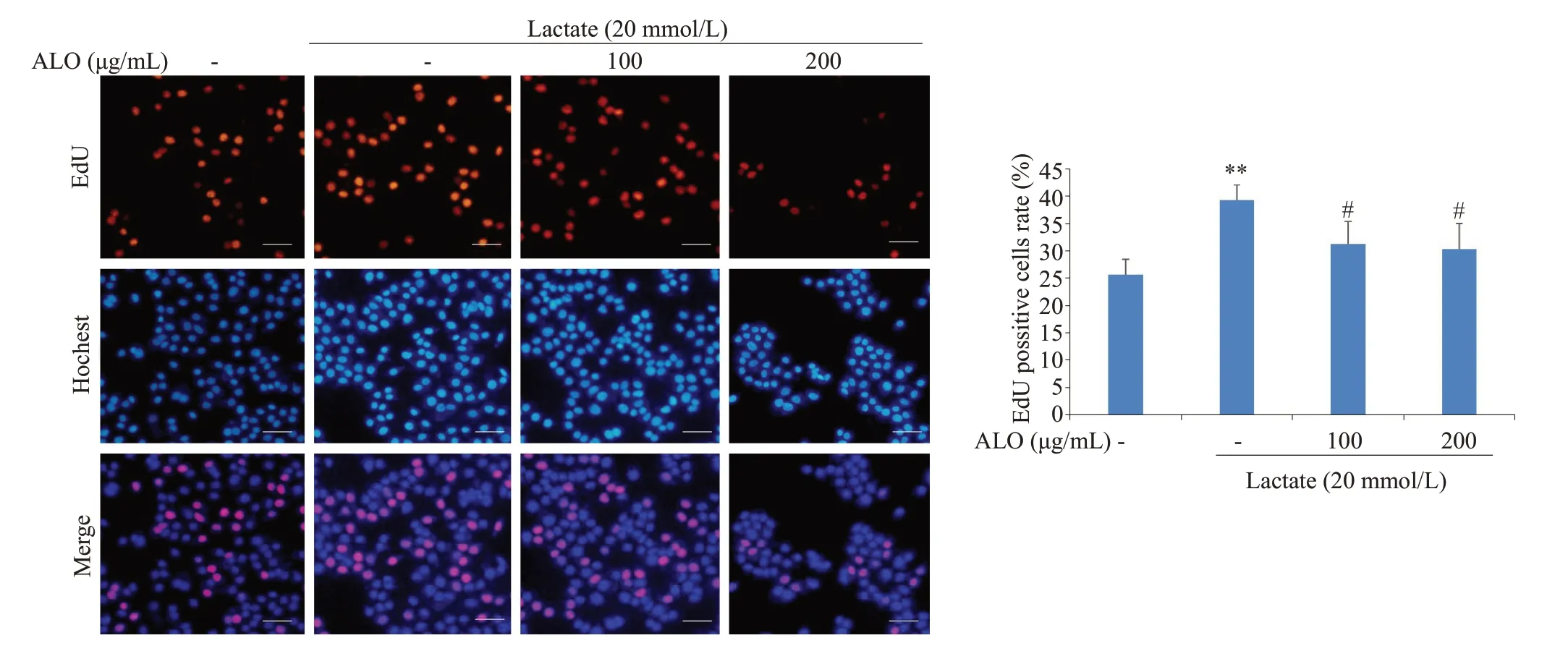
图2 芦荟苷对乳酸诱导胃癌细胞增殖的影响Fig.2 Effects of aloin on lactate-induced proliferation of gastric cancer cells(EdU staining,Scar bar:100 μm).**P<0.01 vs control;#P<0.05 vs lactate group(n=3).
2.2 芦荟苷抑制乳酸诱导的胃癌细胞迁移
划痕和transwell实验检测用于胃癌细胞的迁移能力,乳酸刺激的胃癌细胞与对照组相比,划痕愈合率明显增加,而芦荟苷联合乳酸处理组细胞的愈合率却显著低于乳酸组。乳酸明显诱导了胃癌细胞的迁移,而芦荟苷联合乳酸组,细胞的迁移数量明显被抑制(图3、4)。
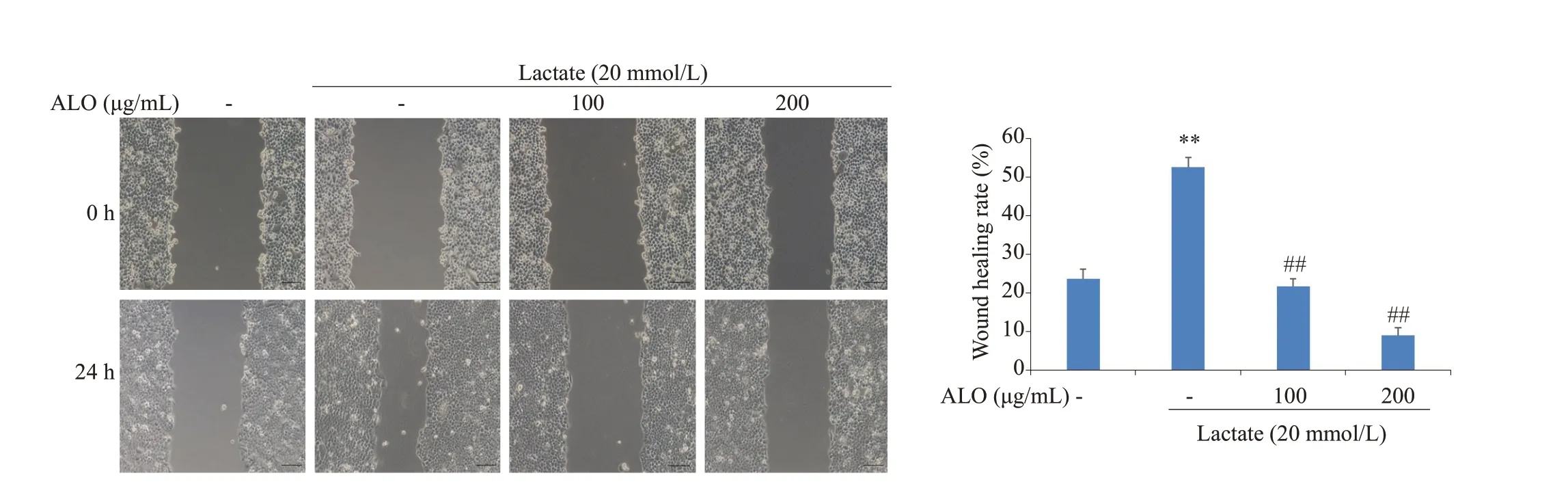
图3 芦荟苷对乳酸诱导胃癌细胞迁移的影响(划痕实验)Fig.3 Effects of aloin on lactate-induced migration of gastric cancer cells detected by wound healing assay(Scar bar:100 μm).**P<0.01 vs control;##P<0.01 vs lactate group(n=3).
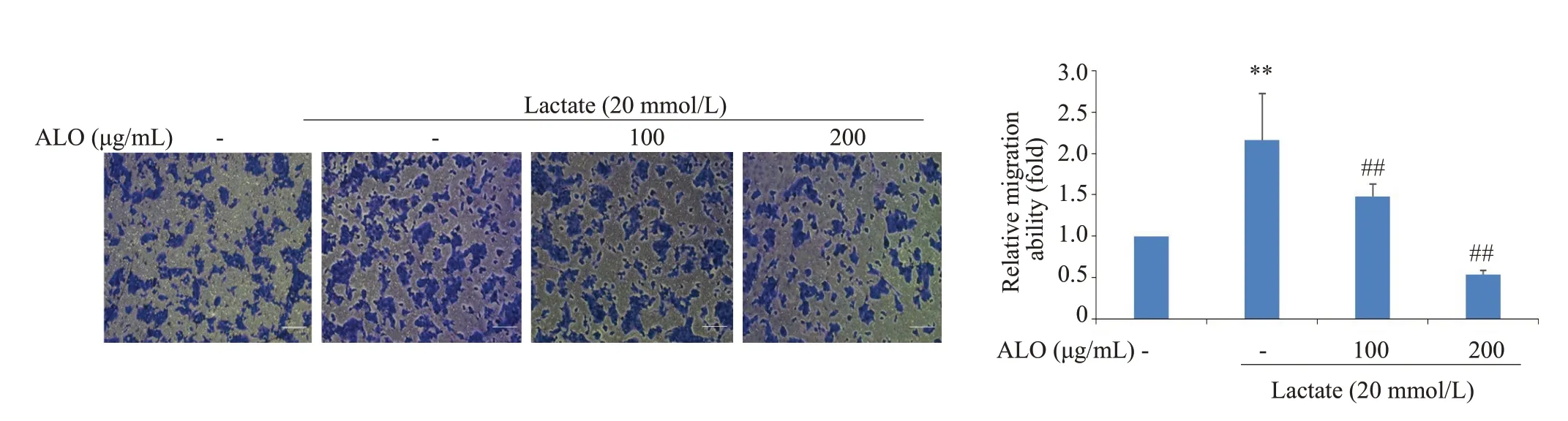
图4 芦荟苷对乳酸诱导胃癌细胞迁移的影响(Transwell实验)Fig.4 Effects of aloin on lactate-induced migration of gastric cancer cells(Crystal violet staining,Scar bar:100 μm).**P<0.01 vs control;#P<0.05 vs lactate group.
2.3 芦荟苷抑制乳酸诱导的增殖和迁移相关蛋白表达
WB检测周期蛋白CyclinD1,E1和增殖细胞核抗原(PCNA)的表达,乳酸能够增强Cyclin D1,E1 和PCNA的表达,而芦荟苷联合乳酸处理组能够浓度依赖性的降低上述蛋白的表达水平(图5A)。基质金属蛋白酶MMP-2,MMP-9及间质细胞标志蛋白N-cadherin的表达在乳酸的作用下明显增强,而上皮细胞标志蛋白Ecadherin的表达则显著抑制。在芦荟苷联合乳酸处理的细胞中,芦荟苷显著逆转了乳酸诱导的上述蛋白表达(图5B)。
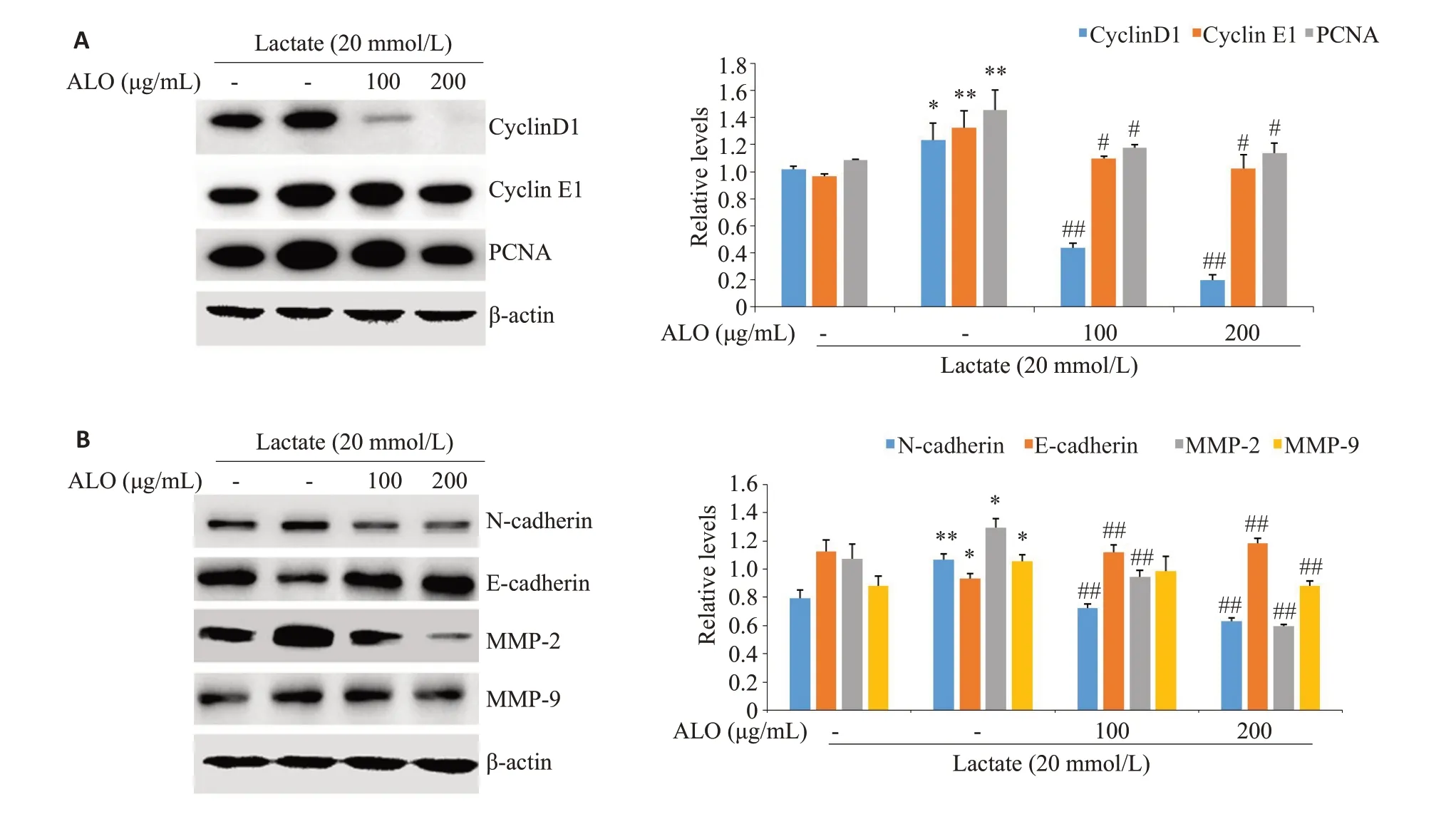
图5 芦荟苷对乳酸诱导增殖和迁移相关蛋白表达的影响Fig.5 Effect of aloin on lactate-induced expressions of proliferation-and migration-related proteins.A:Expressions of proliferation-related proteins.B:Expressions of migration-related protein.*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs lactate group(n=3).
2.4 芦荟苷抑制乳酸诱导的HMGB1表达及释放
乳酸处理胃癌细胞不同的时间(0、6、12和24 h),WB检测胞内HMGB1的表达。HMGB1的表达在乳酸作用6 h和12 h时明显增加,24 h基本降低至本底水平(图6A)。芦荟苷联合乳酸刺激细胞6 h,芦荟苷显著降低了乳酸诱导的HMGB1表达(图6B)。
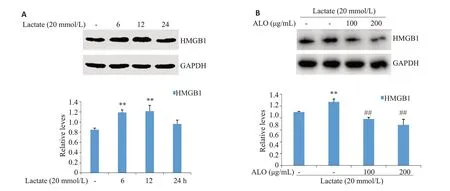
图6 芦荟苷对乳酸诱导HMGB1表达的影响Fig.6 Effects of aloin on lactate-induced HMGB1 expression.A:Lactate up-regulates the expression of HMGB1.B:Aloin suppresses lactate-induced HMGB1 expression.**P<0.01 vs control;##P<0.01 vs lactate group(n=3).
2.5 芦荟苷抑制乳酸诱导的HMGB1释放
ELISA检测HMGB1释放发现,乳酸单独刺激胃癌细胞6 h和12 h,HMGB1释放量明显增加,尤其以6 h最为显著(图7A)。芦荟苷联合乳酸作用细胞6 h,ELISA检测HMGB1的释放发现,与乳酸单独处理组相比,芦荟苷明显抑制了乳酸诱导的HMGB1释放(图7B)。

图7 芦荟苷对乳酸诱导HMGB1释放的影响Fig.7 Effects of aloin on lactate-induced HMGB1 release.A:Release of HMGB1 upon lactate stimulation.B:Aloin inhibits lactate-induced HMGB1 release.**P<0.01 vs control;#P<0.05 vs lactate group(n=3).
2.6 敲除HMGB1降低乳酸诱发的胃癌细胞增殖和迁移
EdU和划痕实验检测胃癌的增殖和迁移结果显示,HMGB1敲降的胃癌细胞与阴性对照质粒转染的细胞相比,细胞的增殖和迁移能力明显下降。此外,HMGB1干扰组与阴性对照组相比,乳酸诱发的增殖与迁移现象亦被有效抑制(图8A、B)。

图8 干扰HMGB1降低乳酸诱导的胃癌细胞增殖(A)和迁移(B)Fig.8 HMGB1 knockdown inhibits lactate-induced proliferation (A) and migration (B) of gastric cancer cells (Scar bar:100 μm).**P<0.01 vs negative group;##P<0.01 vs lactate and negative group(n=3).
3 讨论
肿瘤细胞有氧糖酵解产生的大量乳酸,能够促进肿瘤细胞增殖,激活致癌信号途径、促进肿瘤细胞转移和肿瘤药物抵抗等[2,16,17]。在癌症治疗中,采用药物抑制乳酸诱导的肿瘤增殖和转移将为临床肿瘤的治疗提供新思路。已有的研究表明,芦荟苷联合二甲双胍通过PI3k/Akt/mTOR途径抑制肝癌细胞的生长和侵袭,诱导细胞凋亡和自噬,从而增强抗肿瘤作用[18]。芦荟苷能否抑制乳酸诱导的肿瘤细胞增殖和迁移尚未见报道。在本研究中,我们采用芦荟苷联合乳酸共同处理胃癌BGC-823细胞。结果发现,不仅乳酸能够明显诱导胃癌细胞的增殖和迁移,而且该诱导作用均被芦荟苷显著抑制。
无论内源性还是外源性乳酸均能够显著诱导乳腺癌相关的细胞周期和增殖基因,如CDΚ4,CDΚ2B,Akt等的转录[19]。CDΚ4和CDΚ2参与调节周期蛋白cyclin D1和cyclin E1的表达;PCNA是检测细胞增殖的重要指标,参与了细胞周期的调控[20];乳酸还能激活肿瘤细胞蛋白酶,如基质金属蛋白酶-9(MMP-9)[1]。为了探讨芦荟苷抑制乳酸诱导胃癌细胞增殖和迁移的分子机理,我们检测了CyclinD1,E1,PCNA和MMPs的表达。我们的实验结果显示,芦荟苷与乳酸联合作用组,上述蛋白的表达水平明显低于乳酸单独刺激组。上皮细胞间质转化(EMT)是肿瘤细胞迁移的分子机制之一。通过检测上皮细胞和间质细胞标志蛋白E-cadherin 和Ncadherin发现,乳酸引发的EMT亦显著被芦荟苷明显逆转。上述结果意味着,芦荟苷可通过下调周期蛋白,基质金属酶的表达,抑制上皮细胞间质转化,抑制乳酸诱导的胃癌细胞增殖和迁移。
HMGB1在多种肿瘤中高表达,且与肿瘤的增殖、迁移、不良预后等有关。我们前期研究中也发现,芦荟苷能够有效抑制HMGB1的表达和释放;HMGB1亦能够调控周期蛋白和基质金属酶的表达及上皮细胞间质转化[8,13]。结合本研究,我们猜测HMGB1可能在芦荟苷抑制乳酸诱导的胃癌细胞增殖和迁移中发挥一定的作用。我们首先用乳酸刺激胃癌细胞,WB 检测HMGB1 的表达,结果发现,乳酸作用能够明显增强HMGB1的表达。而芦荟苷联合乳酸刺激的胃癌细胞,乳酸诱导的HMGB1表达被芦荟苷显著抑制。HMGB1不仅在胞内发挥作用,在许多疾病如创伤、炎症和癌症的发生、发展过程中亦能够释放至胞外,作为损伤相关模式分子诱发胞内二次生物学效应[21]。我们在本研究中同样发现,乳酸刺激胃癌细胞HMGB1的释放增加,而芦荟苷可有效抑制乳酸诱导的HMGB1释放。为进一步证明乳酸可通过调控HMGB1发挥增殖和迁移作用,我们在BGC-823细胞中转染HMGB1干扰质粒下调HMGB1的表达,通过EdU和划痕实验检测细胞的增殖和迁移能力。结果显示,HMGB1敲除的胃癌细胞与阴性对照质粒转染组相比,乳酸诱导的增殖和迁移均被有效抑制。该结果进一步证明,乳酸可通过HMGB1促进胃癌细胞的增殖和迁移。综合上述研究结果,我们认为,芦荟苷能够抑制乳酸诱导的HMGB1表达及释放,降低乳酸诱发的胃癌细胞增殖和迁移。
因此,芦荟苷可通过降低乳酸诱导的HMGB1表达和释放,减弱增殖和迁移相关蛋白的表达,阻止上皮细胞间质转化,抑制胃癌细胞的增殖和迁移。该研究为芦荟苷的抗肿瘤机制提供了新见解,同时也为乳酸可作为肿瘤治疗的靶点提供了实验依据。
