补肾活血方对椎间盘退行性变大鼠髓核细胞焦亡的影响
2021-12-15尹逊路金哲峰冯敏山朱立国于杰魏戌展嘉文高春雨梁龙韩涛孙凯谢瑞王宝剑
尹逊路,金哲峰,冯敏山,朱立国,于杰,魏戌,展嘉文,高春雨,梁龙,韩涛,孙凯,谢瑞,王宝剑
实验研究
补肾活血方对椎间盘退行性变大鼠髓核细胞焦亡的影响
尹逊路1,金哲峰1,2,3,冯敏山1,朱立国1,2,3,于杰1,魏戌1,展嘉文1,高春雨1,梁龙4,韩涛1,孙凯1,谢瑞1,王宝剑1
1.中国中医科学院望京医院,北京 100102;2.北京市中西医结合骨伤研究所,北京 100700;3.中医正骨技术北京市重点实验室,北京 100700;4.安徽中医药大学第一附属医院,安徽 合肥 230031
观察补肾活血方对椎间盘退行性变(IDD)大鼠髓核细胞焦亡的影响,探讨其延缓IDD的机制。采用脊柱动静力失衡法构建IDD大鼠模型。将30只SD大鼠随机分为对照组、模型组和中药组,造模3 d后开始给药,中药组每日予补肾活血方(5.94 g/kg)灌胃,对照组和模型组予等量生理盐水灌胃,连续14 d。甲苯胺蓝染色观察大鼠髓核细胞数量、形态变化,免疫组化染色观察髓核组织Ⅱ型胶原表达,Western blot检测大鼠髓核组织半胱氨酸蛋白酶-1(Caspase-1)、NOD样受体蛋白3(NLRP3)蛋白表达。甲苯胺蓝染色结果显示:与对照组比较,模型组大鼠髓核细胞显著减少,髓核组织可见明显炎症细胞浸润,有瘢痕组织形成;与模型组比较,中药组大鼠髓核细胞数量显著增加,髓核组织炎性浸润及瘢痕组织明显减少。免疫组化结果显示:与对照组比较,模型组大鼠髓核组织Ⅱ型胶原表达显著降低(<0.05);与模型组比较,中药组大鼠髓核组织Ⅱ型胶原表达显著升高(<0.05)。Western blot结果显示:与对照组比较,模型组大鼠髓核组织Caspase-1、NLRP3蛋白表达明显升高(<0.05);与模型组比较,中药组大鼠髓核组织Caspase-1、NLRP3蛋白表达明显降低(<0.05)。补肾活血方可通过下调NLRP3及Caspase-1表达、抑制髓核细胞焦亡、促进Ⅱ型胶原表达等途径发挥延缓IDD进程的作用。
腰椎间盘突出症;椎间盘退行性变;髓核细胞;细胞焦亡;大鼠
腰椎间盘突出症(lumar disc herniation,LDH)是临床常见病、多发病[1]。流行病学调查显示,全球70%~90%人一生中至少遭遇1次下腰痛[2],而其中20%~30%下腰痛患者由LDH所致[3-4]。研究表明,椎间盘退行性变(intervertebral disc degeneration,IDD)是导致LDH的主要病理基础,而炎症反应在IDD过程中扮演了重要角色[5-6]。细胞焦亡作为一种促炎症性、细胞程序性死亡的方式,在多种疾病发生、发展过程中起重要作用[7]。研究显示,髓核细胞焦亡与IDD密切相关[8]。课题组前期研究发现,补肾活血方可通过抑制炎症反应延缓IDD进程,从而防治LDH[9-10],但其具体作用机制仍不明确。本研究观察补肾活血方对IDD大鼠髓核细胞焦亡的影响,探讨其延缓IDD的效应机制。
1 材料与方法
1.1 动物
6周龄SPF级SD大鼠30只,体质量200~250 g,雌雄各半,北京维通利华实验动物技术有限公司提供,动物许可证号SYXK(京)2018-0022。饲养于温度(22±2)℃、相对湿度50%~60%环境,12 h明暗交替。
1.2 药物及制备
补肾活血方(杜仲15 g,补骨脂10 g,牛膝10 g,丹参12 g,威灵仙10 g,木瓜9 g),饮片由中国中医科学院望京医院中草药房提供。常规方法煎煮,制成含原药材0.33 g/mL药液,4 ℃冰箱保存备用。
1.3 主要试剂与仪器
NOD样受体蛋白3(NLRP3)一抗(英国Abcam,货号ab214185),半胱氨酸蛋白酶-1(Caspase-1)一抗(英国Abcam,货号ab1972),GAPDH抗体(英国Abcam,货号ab181602)。切片机(德国徕卡仪器有限公司,型号RM2016),显微镜(日本奥林巴斯,型号BX51T-PDH-J11),电泳仪(北京六一仪器厂,型号DYCZ-24KS),分光光度计(美国Thermo Scientific,型号NanoDrop 2000),凝胶成像系统(上海天能科技有限公司,型号Tanon 1600),荧光定量PCR仪(美国Applied Biosystems,型号ABI7500),脊柱运动节段离体加载和培养装置(课题组自主研发,专利号ZL 201420568511.9)。
1.4 分组、造模及给药
随机取20只大鼠,采用脊柱动静力失衡法建立IDD大鼠模型[11]。大鼠腹腔注射2%戊巴比妥钠(1.0 mL/400 g)麻醉,俯卧于手术台,固定四肢,常规碘伏消毒,铺无菌手术巾;以髂嵴平对椎间隙(L6/L7)为中心,取正中纵行切口(约4 cm),依次切开皮肤及皮下组织,锐性分离,暴露棘突、椎板及上下关节突,将附着于棘突、椎板及小关节的肌肉全部分离,依次切除L5~L7棘上及棘间韧带、咬除椎体两侧下关节突,造成椎间失稳;用无菌生理盐水冲洗刀口,依次缝合各层组织。20只大鼠造模成功3 d后,随机分为模型组和中药组,另10只未造模大鼠为对照组。中药组予补肾活血方(5.94 g/kg)灌胃,对照组和模型组予等量生理盐水灌胃,给药体积3 mL,每日1次,连续14 d。
1.5 观察指标
1.5.1 髓核细胞数量及组织形态观察
灌胃14 d后,颈椎脱臼处死大鼠,取L5/L6、L6/L7椎间盘;4%多聚甲醛固定椎间盘24 h;10% EDTA脱钙7 d;常规包埋,制作石蜡切片(轴位);甲苯胺蓝染色液染色3 min;PBS冲洗3次,每次3 min;显微镜下观察髓核细胞数量及髓核组织形态变化。
1.5.2 髓核组织Ⅱ型胶原表达检测
取大鼠髓核组织制作石蜡切片,经脱蜡、抗原修复、灭活内源性过氧化物酶、血清封闭后,滴加Ⅱ型胶原一抗(1∶100),4 ℃孵育过夜,滴加辣根过氧化物酶标记二抗,室温孵育1 h,DAB显色,中性树胶封片,显微镜下观察,Image Pro Plus软件计算阳性表达的平均光密度(MOD)。
1.5.3 髓核组织半胱氨酸蛋白酶-1、NOD样受体蛋白3蛋白表达检测
取大鼠髓核组织,加入适量RIPA裂解液,冰上裂解30 min,3 000 r/min离心20 min,收集上清液,BCA法测定蛋白浓度,100 ℃煮沸变性;等量蛋白上样,经电泳、转膜,5%BSA封闭1 h,加入Caspase-1一抗(1∶500)、NLRP3一抗(1∶400),4 ℃孵育过夜,TBST洗膜,二抗(1∶5 000)室温孵育1 h,TBST洗膜,滴加ECL试剂显影,采用Quantity One V4.6.2软件对条带进行定量分析。
1.6 统计学方法
采用SPSS21.0统计软件进行分析。实验数据以±表示,组间比较采用独立样本检验,多组间比较采用LSD法。<0.05表示差异有统计学意义。
2 结果
2.1 补肾活血方对模型大鼠髓核细胞数量及组织形态的影响
对照组大鼠髓核细胞呈近圆形,排列规则、整齐,且数量较多,髓核组织无炎症细胞浸润;模型组大鼠髓核组织可见明显炎症细胞浸润,有瘢痕组织形成,髓核细胞呈长梭形且数量显著减少;中药组大鼠髓核组织炎性细胞浸润及瘢痕组织明显减少,髓核细胞数量明显增加。见图1。
2.2 补肾活血方对模型大鼠髓核组织Ⅱ型胶原表达的影响
与对照组比较,模型组大鼠髓核组织Ⅱ型胶原表达降低,差异有统计学意义(<0.05);与模型组比较,中药组大鼠髓核组织Ⅱ型胶原表达升高,差异有统计学意义(<0.05)。见图2。

图1 各组大鼠髓核组织形态(甲苯胺蓝染色,×400)
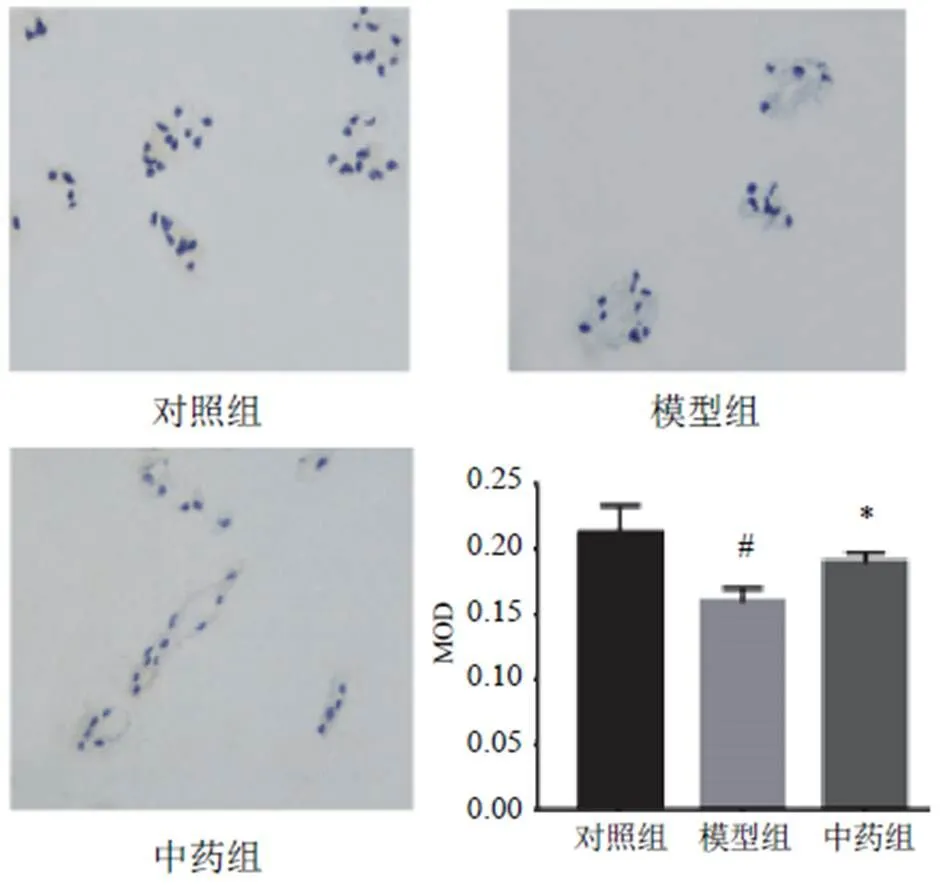
注:与对照组比较,#P<0.05;与模型组比较,*P<0.05
2.3 补肾活血方对模型大鼠髓核组织半胱氨酸蛋白酶-1、NOD样受体蛋白3蛋白表达的影响
与对照组比较,模型组大鼠髓核组织Caspase-1、NLRP3蛋白表达明显升高(<0.05);与模型组比较,中药组大鼠髓核组织Caspase-1、NLRP3蛋白表达明显降低(<0.05)。见图3、图4。

图3 各组大鼠髓核组织Caspase-1、NLRP3蛋白免疫印迹图

注:与对照组比较,#P<0.05;与模型组比较,*P<0.05
3 讨论
LDH属中医学“痹证”范畴,患者多为老年人。中医认为,人至老年,元气渐衰,肾气亏虚,脉络瘀阻,故常见肾虚血瘀之象。《医学心悟》曰:“大抵腰痛悉属肾虚。”《外科证治全书》曰:“诸痛皆由气血瘀滞不通所致。”因此,LDH中医病机为肾虚血瘀,补肾活血法是其基本治法。补肾活血方是在补肾活血理论指导下,结合朱立国教授多年临床经验,由《太平惠民和剂局方》青娥丸精简化裁而来。该方由杜仲、补骨脂、牛膝、丹参、威灵仙、木瓜组成,具有补肾强腰、活血化瘀功效,是针对LDH肾虚血瘀病机代表方之一。研究表明,IDD是由无菌性炎症所致慢性退行性变,免疫炎症反应在该过程发挥重要作用[12-13]。经典免疫学说认为,异常刺激信号使髓核细胞表面受体活化,在白细胞介素前体、肿瘤坏死因子前体等蛋白作用下,启动细胞内信号传导,迁移至细胞核内作为转录调节因子,调控相应基因转录,促进相关炎症因子表达,触发炎症反应;炎症因子诱导髓核细胞损伤的同时,也可通过提高基质金属蛋白酶活性促进细胞外基质(Ⅱ型胶原、蛋白多糖等)降解;此外,上述因子诱发的炎症级联反应也可抑制Ⅱ型胶原等蛋白表达。随着炎症反应不断加剧,椎间盘内环境严重失衡,最终加剧IDD,引发LDH[14-15]。
细胞焦亡作为新发现的细胞程序性死亡的方式,为当前多种免疫代谢性疾病的研究提供了新的思路和视角。细胞焦亡不同于细胞坏死、细胞凋亡,主要表现为坏死样细胞膜孔形成、细胞肿胀和破裂、细胞核凝结、细胞内容物及白细胞介素(IL)-1β等炎症因子大量释放等[7]。经典的细胞焦亡途径是在Caspase-1诱导下完成[16]。病理状态下,细胞内模式识别受体(PRRs)被激活后,其PYD结构域与凋亡相关斑点样蛋白(ASC)同源结构域结合,募集Caspase-1前体,形成炎症小体[17]。目前已知在炎症小体装配中有确定作用的PRRs主要包括黑色素瘤缺乏因子2(AIM2)、NLRP(如NLRP1、NLRP3、NLRP4)及Pyrin等。其中,NLRP3炎症小体在多种疾病过程中扮演重要角色。NLRP3炎症小体的激活包括2个过程:在NF-κB通路作用下促进IL-1β前体及NLRP3炎症相关基因表达、成熟(预处理过程)[18];在细胞外ATP、活性氧、病原微生物介导下完成炎症小体组装和Caspase-1活化(活化过程)[19]。因此,NLRP3/ Caspase-1轴被认为是细胞焦亡发生的关键。
研究表明,髓核细胞数量减少及Ⅱ型胶原蛋白表达降低是导致IDD发生的重要病理基础,IDD过程中伴有不同程度髓核细胞焦亡,主要表现为NLRP3及Caspase-1表达水平上调[20-21]。因此,抑制NLRP3及Caspase-1活化、促进Ⅱ型胶原表达对延缓IDD进程具有重要意义。
本研究发现,模型组大鼠髓核组织Ⅱ型胶原表达显著降低,Caspase-1、NLRP3蛋白表达升高。补肾活血方干预后,Caspase-1、NLRP3等炎性蛋白表达显著降低,Ⅱ型胶原表达明显升高。因此,我们认为,补肾活血方延缓IDD可能与下调髓核细胞焦亡水平、抑制炎症反应、促进Ⅱ型胶原表达等有关。此外,模型组由于发生髓核细胞焦亡,影响髓核细胞正常生理功能的发挥(包括Ⅱ型胶原表达),补肾活血方干预后,髓核细胞数量增加,形态正常,进一步验证了补肾活血方可通过抑制髓核细胞焦亡,发挥延缓IDD进程的作用。
综上,本研究从髓核细胞焦亡角度探讨了补肾活血方延缓IDD的效应机制,证实补肾活血方可通过抑制髓核细胞焦亡关键蛋白NLRP3和Caspase-1表达、促进Ⅱ型胶原表达发挥延缓IDD的作用,可为防治IDD中药的研发提供实验依据。
[1] KREINER D S, HWANG S W, EASA J E, et al. An evidence-based clinical guideline for the diagnosis and treatment of lumbar disc herniation with radiculopathy[J]. Spine Journal,2014,14(1):180-191.
[2] ANDERSSON G B. Epidemiological features of chronic low-back pain[J]. Lancet,1999,354(9178):581-585.
[3] BODEN S D, DAVIS D O, DINA T S, et al. Abnormal magnetic-resonance scans of the lumbar spine in asymptomatic subjects. A prospective investigation[J]. J Bone Joint Surg Am,1990,72(3):403-408.
[4] ORIEF T, ORZ Y, ATTIA W, et al. Spontaneous resorption of sequestrated intervertebral disc herniation[J]. World Neurosurg, 2012,77(1):146-152.
[5] SAMPARA P, BANALA R R, VEMURI S K, et al. Understanding the molecular biology of intervertebral disc degeneration and potential gene therapy strategies for regeneration:a review[J]. Gene Ther,2018,25(2):67-82.
[6] PENG B, HAO J, HOU S, et al. Possible pathogenesis of painful intervertebral disc degeneration[J]. Spine (Phila Pa 1976),2006, 31(5):560-566.
[7] 伊宏煜,王涛,谷孙泽栋,等.细胞焦亡与临床疾病及其相关信号通路[J].中国免疫学杂志,2019,35(16):2038-2042.
[8] CHEN Z H, JIN S H, WANG M Y, et al. Enhanced NLRP3, Caspase-1, and IL-1β levels in degenerate human intervertebral disc and their association with the grades of disc degeneration[J]. Anat Rec (Hoboken),2015,298(4):720-726.
[9] 朱立国,展嘉文,冯敏山,等.补肾活血方治疗椎间盘源性腰痛的临床观察[J].世界中医药,2017,12(3):554-557.
[10] YANG S, LI L, ZHU L, et al. Bu-Shen-Huo-Xue-Fang modulates nucleus pulposus cell proliferation and extracellular matrix remodeling in intervertebral disk degeneration through miR-483 regulation of Wnt pathway[J]. J Cell Biochem,2019,120(12):19318- 19329.
[11] WANG Y J, SHI Q, LU W W, et al. Cervical intervertebral disc degeneration induced by unbalanced dynamic and static forces:a novel in vivo rat model[J]. Spine (Phila Pa 1976),2006,31(14):1532-1538.
[12] 王宗亮,刘维钢,史建刚,等.细胞因子在椎间盘退变中作用的研究进展[J].组织工程与重建外科杂志,2007,3(1):59-60.
[13]张广智,武作龙,贺学岗,等.细胞衰老与椎间盘退变的相关性研究进展[J].生命科学研究,2021,25(1):58-63,94.
[14] YAMAMOTO J, MAENO K, TAKADA T, et al. Fas ligand plays an important role for the production of pro-inflammatory cytokines in intervertebral disc nucleus pulposus cells[J]. J Orthop Res, 2013,31(4):608-615.
[15] 赵赫,俞兴,唐向盛,等.炎性因子IL-1β、TNF-α与椎间盘退变关系的研究进展[J].中国骨伤,2017,30(9):866-871.
[16] WANG K, SUN Q, ZHONG X, et al. Structural mechanism for GSDMD targeting by autoprocessed Caspases in pyroptosis[J]. Cell,2020, 180(5):941-955.
[17] VAND W L, LAMKANFI M. Pyroptosis[J]. Curr Biol,2016,26(13):R568-R572.
[18] CORDERO M D, WILLOAMS M R, RYFFEL B. AMP-activated protein kinase regulation of the NLRP3 inflammasome during aging[J]. Trends Endocrinol Metab,2018,29(1):8-17.
[19] TAKANORI K, DANIEL A M. The role of inflammasomes in kidney disease[J]. Nat Rev Nephrol,2019,15(8):501-520.
[20] HONG J, LI S, MARKOVA D Z, et al. Bromodomain-containing protein 4 inhibition alleviates matrix degradation by enhancing autophagy and suppressing NLRP3 inflammasome activity in NP cells[J]. J Cell Physiol,2020,235(7/8):5736-5749.
[21] TANG P, ZHU R, JI W P, et al. The NLRP3/Caspase-1/ interleukin-1β axis is active in human lumbar cartilaginous endplate degeneration[J]. Clin Orthop Relat Res,2016,478(8):1818-1826.
Effects ofPrescription on Pyroptosis of Nucleus Pulposus Cell in Rats with Intervertebral Disc Degeneration
YIN Xunlu1, JIN Zhefeng1,2,3, FENG Minshan1, ZHU Liguo1,2,3, YU Jie1, WEI Xu1, ZHAN Jiawen1, GAO Chunyu1, LIANG Long4, HAN Tao1, SUN Kai1, XIE Rui1, WANG Baojian1
To observe the effects of ofPrescription on pyrolysis of nucleus pulposus cells in rats with intervertebral disc degeneration (IDD); To explore the mechanism of delaying IDD.IDD rats model was established by spine dynamic and static imbalance method. 30 SD rats were randomly divided into control group, model group and TCM group. The intragastric administration was started 3 d after modeling. The TCM group received 5.94 g/kgPrescription for gavage, the control group and model group received the same volume of normal saline for gavage for 14 d. Toluidine blue staining was used to observe number and shape of nucleus pulposus cells, immunohistochemistry was used to observe the expression of type Ⅱ collagen, and Western blot was used to detect the protein expression of Caspase-1 and NLRP3.Toluidine blue staining resultsshowed that, compared with the control group, the number of nucleus pulposus cells in the model group significantly decreased, the inflammatory infiltration and scar tissue in the nucleus pulposus tissue significantly increased. Compared with the model group, the number of nucleus pulposus cells in TCM group significantly increased, the inflammatory infiltration and scar tissue in the nucleus pulposus tissue significantly reduced. The results of immunohistochemistry showed that, compared with the control group, the expression of type Ⅱ collagen in the nucleus pulposus tissue of the model group significantly reduced (<0.05). Compared with the model group, the expression of type Ⅱ collagen in the nucleus pulposus tissueofTCM group significantly increased (<0.05). Western blot results showed that, compared with the control group, the expression of Caspase-1 and NLRP3 proteins in the nucleus pulposus tissue of the model group significantly increased (<0.05). Compared with the model group, the expression of Caspase-1 and NLRP3 proteins in the nucleus pulposus tissue of TCM group significantly reduced (<0.05).Prescription can delay the progress of IDD by down-regulating the expression of Caspase-1 and NLRP3, inhibiting pyrolysis of nucleus pulposus cells, and promoting the expression of type Ⅱ collagen.
lumbar disc herniation; intervertebral disc degeneration; nucleus pulposus cells; pyroptosis; rats
R285.5
A
1005-5304(2021)12-0036-05
10.19879/j.cnki.1005-5304.202106019

国家自然科学基金面上项目(81774330);北京市自然科学基金青年基金(7214297)
金哲峰,E-mail:zhlg95@aliyun.com
(2021-06-01)
(修回日期:2021-06-22;编辑:郑宏)
