补肾益髓方对脂多糖诱导的BV2细胞神经炎症模型miRNA-155信号通路相关因子的影响
2021-12-15高延芳查政薛冰李君玲齐放金良韵张楠樊永平王蕾
高延芳,查政,薛冰,李君玲,齐放,金良韵,张楠,樊永平,王蕾
补肾益髓方对脂多糖诱导的BV2细胞神经炎症模型miRNA-155信号通路相关因子的影响
高延芳1,查政1,薛冰2,李君玲1,齐放1,金良韵2,张楠1,樊永平3,王蕾1
1.首都医科大学中医药学院,中医络病研究北京市重点实验室,北京 100069;2.首都医科大学中心实验室,北京 100069;3.首都医科大学附属北京天坛医院,北京 100070
观察补肾益髓方药物血清对小鼠小胶质细胞BV2神经炎症的影响,探讨其可能的作用机制。1 μg/mL脂多糖(LPS)诱导建立BV2细胞炎症模型,将BV2细胞随机分为正常组、LPS组、补肾益髓方药物血清(5%、10%、20%)组和空白血清(5%、10%、20%)组,CCK-8法检测细胞活力;在此基础上,将细胞分为正常组、LPS组和20%补肾益髓方药物血清组,免疫荧光法和Western blot检测细胞内诱导型一氧化氮合酶(iNOS)、精氨酸酶-1(Arginase-1)蛋白表达,RT-qPCR检测细胞内miRNA-155-5p表达;采用慢病毒转染制备miRNA-155-5p过表达模型,另设20%补肾益髓方药物血清组、阴性对照组和miRNA-155-5p过表达组,免疫荧光法和Western blot检测细胞内iNOS、Arginase-1及CCAAT/增强子结合蛋白β(C/EBPβ)蛋白表达。与正常组比较,LPS组细胞活力显著降低(<0.01),iNOS和miRNA-155-5p水平显著升高(<0.01),Arginase-1表达显著降低(<0.05);与LPS组比较,20%补肾益髓方药物血清组细胞活力显著升高(<0.01),iNOS和miRNA-155-5p水平显著降低(<0.01),Arginase-1表达显著升高(<0.01)。与20%补肾益髓方药物血清组比较,miRNA-155-5p过表达组iNOS表达显著升高(<0.01),Arginase-1和C/EBPβ表达显著降低(<0.01)。补肾益髓方可抑制LPS诱导的BV2细胞炎症反应,其作用机制与提高细胞活力、上调Arginase-1表达、下调iNOS表达、抑制miRNA-155信号通路有关。
补肾益髓方;神经炎症;BV2细胞;脂多糖;miRNA-155信号通路
多发性硬化(multiple sclerosis,MS)是一种自身免疫介导的中枢神经系统(CNS)慢性炎症退行性疾病,以炎症、脱髓鞘和轴突损伤为主要病理特征,临床表现为肢体无力、麻木疼痛,视力下降等。研究发现,小胶质细胞是CNS的固有免疫细胞,参与MS病变形成的各个阶段,是炎症的驱动因素。在炎症病理情况下,病灶周围区域的小胶质细胞被不断激活,极化为促炎型M1和抑炎型M2。M1型小胶质细胞分泌促炎因子和趋化因子,损伤髓鞘;M2型小胶质细胞分泌抗炎因子和营养因子,吞噬消除病原体,并修复髓鞘[1-4]。在MS发生发展过程中,M1型小胶质细胞标志物诱导型一氧化氮合酶(iNOS)表达上调,M2型小胶质细胞标志物精氨酸酶-1(Arginase-1)表达下调,同时分泌大量促炎因子,导致神经退行性病变[5-6],后期出现严重的运动障碍和认知功能障碍等[7]。另有研究表明,miRNA-155及其下游靶基因CCAAT/增强子结合蛋白β(CCAAT/enhancer-binding protein β,C/EBPβ)可调控小胶质细胞极化,参与炎症反应[8]。
补肾益髓方是首都医科大学附属北京天坛医院樊永平教授研发的治疗MS方剂,以补肾填精、化痰活血为主,疗效显著[9]。课题组前期实验显示,补肾益髓方可促进实验性自身免疫性脑脊髓炎(EAE)小鼠小胶质细胞向M2型极化,促进髓鞘再生[10-11],但其作用机制尚不明确。因此,本实验采用脂多糖(LPS)诱导小鼠小胶质细胞BV2建立神经炎症模型,观察补肾益髓方是否通过miRNA-155信号通路介导BV2细胞向M2型极化,为明确补肾益髓方治疗MS的作用机制提供实验依据。
1 实验材料
1.1 动物与细胞
SPF级雄性SD大鼠30只,体质量(280±20)g,北京维通利华实验动物有限公司提供,动物生产许可证号SCXK(京)2016-0006,动物使用许可证号SYXK(京)2018-0003。饲养于首都医科大学实验动物中心,温度18~22 ℃,相对湿度40%~60%,自由摄食饮水。动物实验经首都医科大学动物伦理委员会审批(AEEI-2018-137)。小鼠小胶质细胞BV2,北京协和细胞库。
1.2 药物及制备
补肾益髓方(生地黄12 g,熟地黄12 g,制何首乌9 g,水蛭6 g,连翘9 g,全蝎6 g,浙贝母12 g,天麻9 g,益母草12 g,酒大黄6 g),饮片粉末购自北京亚东生物制药有限公司,使用前用蒸馏水溶解,配制成原药材浓度为1.46 g/mL药液。LPS,货号PB10443,美国Sigma公司,配制成浓度为1 mg/mL贮备液,0.22 μm滤膜过滤,分装后于-20 ℃冰箱保存,临用前用培养基稀释,终浓度为1 μg/mL。
1.3 主要试剂与仪器
DMEM高糖培养基(货号10-013-CV)、青链霉素(货号15140-122)、胎牛血清(货号35-076-CV),美国Corning公司;小鼠抗iNOS一抗(货号ab210823)、兔抗Arginase-1一抗(货号ab91279)、兔抗C/EBPβ一抗(货号ab32358),英国Abcam公司;小鼠抗β-tubulin一抗(货号YM3030),美国Immunoway公司;慢病毒,上海汉恒生物科技有限公司。ESCD AC2-4S1超净生物安全柜(美国Thermo公司),371型二氧化碳恒温培养箱(美国Thermo公司),Primo Vert倒置荧光显微镜(德国Carl Zeiss公司),Mini-PROTEAN®Tetra电泳槽(美国Bio-Rad公司),小型Trans-Blot®转印槽(美国Bio-Rad公司),PowerPacTM基础电泳仪电源(美国Bio-Rad公司),Fusion FX6-XT化学发光成像系统(法国Vilber公司),SpectraMax Plus384酶标仪(美国MD公司),CFX Connect荧光定量PCR仪(美国Bio-Rad公司)。
2 实验方法
2.1 补肾益髓方药物血清制备
SD大鼠适应性喂养3 d后,随机分为空白血清组和补肾益髓方药物血清组,每组15只。补肾益髓方药物血清组大鼠参照文献[12]予补肾益髓方药液(11.7 g/kg)灌胃,空白血清组大鼠给予等体积蒸馏水灌胃,连续7 d,每日2次,间隔12 h。末次给药前禁食12 h,末次给药后2 h麻醉大鼠,腹主动脉取血,4 ℃静置4 h,3 000 r/min离心15 min,吸取上清液,合并同组血清,0.22 μm滤膜过滤除菌,置于-80 ℃冰箱保存备用。
2.2 体外炎症模型建立
取生长良好的BV2细胞,加入1 μg/mL LPS诱导24 h,建立体外炎症模型。
2.3 CCK-8法检测细胞活力
取对数生长期BV2细胞,以5×104个/mL接种于96孔板,每孔100 μL,放入37 ℃、5%CO2培养箱中培养24 h。将细胞分为正常组,LPS组,5%、10%、20%补肾益髓方药物血清组,5%、10%、20%空白血清组,每组5个复孔。24 h后各组弃去培养液,正常组加入新鲜培养液,其余各组加入LPS干预24 h。24 h后弃去培养液,正常组和LPS组加入新鲜培养液,各浓度血清组加入相应浓度血清继续培养48 h。每孔加入CCK-8溶液10 μL,继续培养2 h,酶标仪波长450 nm处检测各孔OD值,计算细胞存活率。细胞存活率(%)=实验组OD值÷正常组OD值×100%。
2.4 免疫荧光检测BV2细胞诱导型一氧化氮合酶和精氨酸酶-1表达
取对数生长期BV2细胞,以5×104个/mL接种于24孔板,每孔500 μL,放入37 ℃、5%CO2培养箱中培养24 h。将细胞分为正常组、LPS组和20%补肾益髓方药物血清组,每组3个复孔,按“2.2”项下方法造模,24 h后弃去培养液,正常组和LPS组加入新鲜培养液,20%补肾益髓方药物血清组加入相应浓度血清培养48 h。弃去培养液,PBS清洗3次,4%多聚甲醛固定20 min,0.5%Triton X-100通透20 min,5%BSA封闭30 min。加入小鼠抗iNOS一抗(1∶200)和兔抗Arginase-1一抗(1∶200),4 ℃湿盒内孵育过夜。次日滴加相应二抗(1∶200),室温孵育2 h,滴加荧光染料DAPI,避光孵育5 min,倒置荧光显微镜下观察,每孔选取3个视野拍照。应用Image J 18.0软件对图片进行半定量分析,测量平均荧光强度,并进行统计分析。
2.5 Western blot检测BV2细胞诱导型一氧化氮合酶和精氨酸酶-1表达
取对数生长期BV2细胞,以5×104个/mL接种于6孔板,每孔2 mL,放入37 ℃、5%CO2培养箱中培养24 h。将细胞分为正常组、LPS组和20%补肾益髓方药物血清组,每组3个复孔,按“2.2”项下方法造模,按“2.4”项下方法给药。将6孔板置于冰上,吸弃培养液,PBS清洗3次,加入60 μL蛋白酶抑制剂和RIPA裂解液(1∶100)混合溶液,置于摇床上裂解30 min,将各组液体分别收集至EP管内,4 ℃、12 000 r/min离心20 min,吸取上清液至新EP管内,BCA检测试剂盒对蛋白进行定量。取各组蛋白样品(20 μg)进行凝胶电泳,转膜后加入5%脱脂奶粉,常温摇床封闭1 h。分别加入iNOS一抗(1∶500)、Arginase-1一抗(1∶500),4 ℃冰箱内孵育过夜。次日TBST清洗3次,每次5 min,滴加相应二抗(1∶20 000),常温摇床孵育30 min,TBST清洗3次,每次5 min。将ECL发光试剂A液与B液等体积混匀后滴在PVDF膜上,并于化学发光成像系统曝光成像。采用Image J 18.0软件计算蛋白条带灰度值,以目的蛋白与内参蛋白(β-tubulin)条带灰度值的比值表示各蛋白的相对表达量。
2.6 RT-qPCR检测BV2细胞miRNA-155-5p表达
取对数生长期BV2细胞,以5×104个/mL接种于6孔板,每孔2 mL,放入37 ℃、5%CO2培养箱中培养24 h。将细胞分为正常组、LPS组和20%补肾益髓方药物血清组,每组3个复孔,按“2.2”项下方法造模,并按“2.4”项下方法给药。培养48 h后,PBS清洗3次,每次5 min,按细胞总RNA提取试剂盒说明书提取总RNA,超微量分光光度计检测RNA浓度及纯度。Bestar®one step RT qPCR kit(SyBR Green)试剂盒进行PCR扩增。测定各组BV2细胞miRNA-155-5p表达情况。采用2-ΔΔCt法计算目的基因表达量。miRNA-155-5p和U6 snRNA(U6)引物由北京赛维尔生物公司合成,miRNA-155-5p引物设计采用茎环法,需要3种引物:反转录引物用于延长miRNA-155-5p、RT-qPCR上游引物、RT-qPCR下游引物。U6作为miRNA-155-5p的内源性对照。引物序列见表1。
表1 各基因PCR引物序列
基因名称引物序列(5’~3’)产物长 度/bp miRNA-155-5p 反转录:CTCAACTGGTGTCGTGGAGTCGGCAAT TCAGTTGAGACCCCTAT F:ACACTCCAGCTGGGTTAATGCTAATTGTGAT67 R:TGGTGTCGTGGAGTCG U6F:CTCGCTTCGGCAGCACA94 R:AACGCTTCACGAATTTGCGT
2.7 阴性对照组和miRNA-155-5p过表达组制备
取对数生长期BV2细胞,以5×104个/mL接种于24孔板,每孔500 μL,放入37 ℃、5%CO2培养箱中培养24 h。慢病毒转染按汉恒生物操作手册执行。在冰上慢慢融化,吸去旧培养液,加入1/2体积新鲜培养液,根据摸索的感染复数(MOI)值,加入适量体积慢病毒进行转染,每孔加入体积(μL)=MOI×细胞数/病毒滴度(TU/mL)×1 000。根据汉恒生物测定的病毒滴度(108TU/mL)及前期摸索的MOI值(60)计算得出24孔板每孔加入病毒15 μL,慢病毒转染4 h后补足至培养体积。转染24 h后弃去含有慢病毒的培养液,加入新鲜培养液继续培养。转染48 h后可通过荧光显微镜初步观察带有绿色荧光蛋白的BV2细胞,转染72 h后观察到带有绿色荧光蛋白的细胞占总细胞数的80%~90%,表明阴性对照组和miRNA-155-5p过表达组制备成功。
2.8 免疫荧光检测miRNA-155-5p过表达BV2细胞诱导型一氧化氮合酶、精氨酸酶-1和CCAAT/增强子结合蛋白β表达
取正常BV2细胞及慢病毒转染后的BV2细胞,以5×104个/mL接种于24孔板,每孔500 μL,置于培养箱中培养。将细胞分为20%补肾益髓方药物血清组、阴性对照组和miRNA-155-5p过表达组,每组3个复孔。24 h后弃去培养液,各组加入LPS干预24 h,弃去含LPS的培养液,各组加入含20%补肾益髓方药物血清的培养液培养48 h。按“2.4”项下免疫荧光操作步骤,并在操作中补充兔抗C/EBPβ抗体(1∶200),检测iNOS、Arginase-1、C/EBPβ蛋白表达。
2.9 Western blot检测BV2细胞诱导型一氧化氮合酶、精氨酸酶-1和CCAAT/增强子结合蛋白β表达
取对数生长期的正常BV2细胞及慢病毒转染后的BV2细胞,以5×104个/mL接种于6孔板,每孔2 mL,培养24 h。将细胞分为20%补肾益髓方药物血清组、阴性对照组和miRNA-155-5p过表达组,每组3个复孔。按“2.8”项下方法造模并给药,按“2.5”项下方法进行Western blot实验,并在操作中补充兔抗C/EBPβ抗体(1∶500),检测iNOS、Arginase-1、C/EBPβ蛋白表达。
3 统计学方法

4 结果
4.1 补肾益髓方药物血清对脂多糖诱导的BV2细胞活力的影响
与正常组比较,LPS组BV2细胞活力明显降低,差异有统计学意义(<0.01);5%、10%、20%补肾益髓方药物血清治疗48 h后,细胞活力显著升高,与对应空白血清组比较,差异均有统计学意义(<0.05,<0.01),其中20%补肾益髓方药物血清组效果最明显,与5%、10%补肾益髓方药物血清组比较,差异有统计学意义(<0.01)。见图1。故选择20%补肾益髓方药物血清进行后续实验。
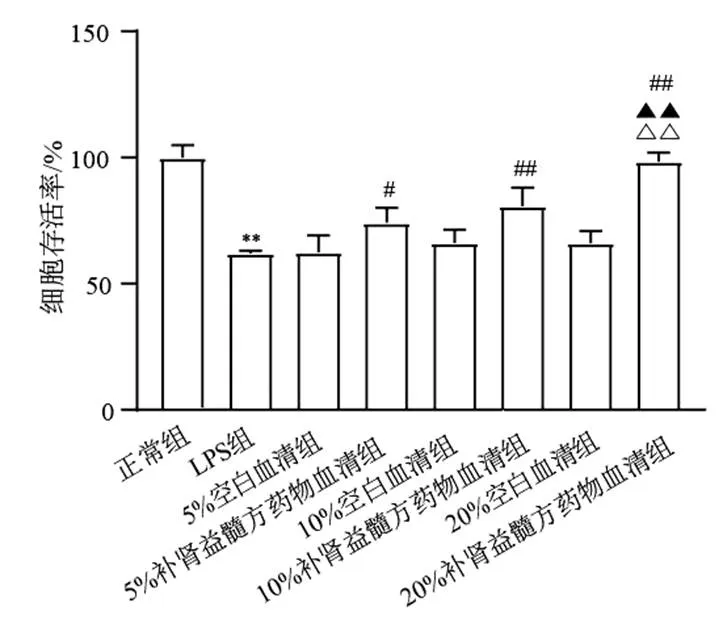
注:与正常组比较,**P<0.01;与同浓度空白血清组比较,#P<0.05,##P<0.01;与5%补肾益髓方药物血清组比较,▲▲P<0.01;与10%补肾益髓方药物血清组比较,△△P<0.01
4.2 补肾益髓方药物血清对脂多糖诱导的BV2细胞诱导型一氧化氮合酶和精氨酸酶-1表达的影响
免疫荧光和Western blot实验结果显示,与正常组比较,LPS组BV2细胞iNOS表达显著上调(<0.01),Arginase-1表达显著下调(<0.05);与LPS组比较,20%补肾益髓方药物血清组BV2细胞iNOS表达显著下调(<0.01),Arginase-1表达显著上调(<0.01)。见图2、表2、图3、表3。
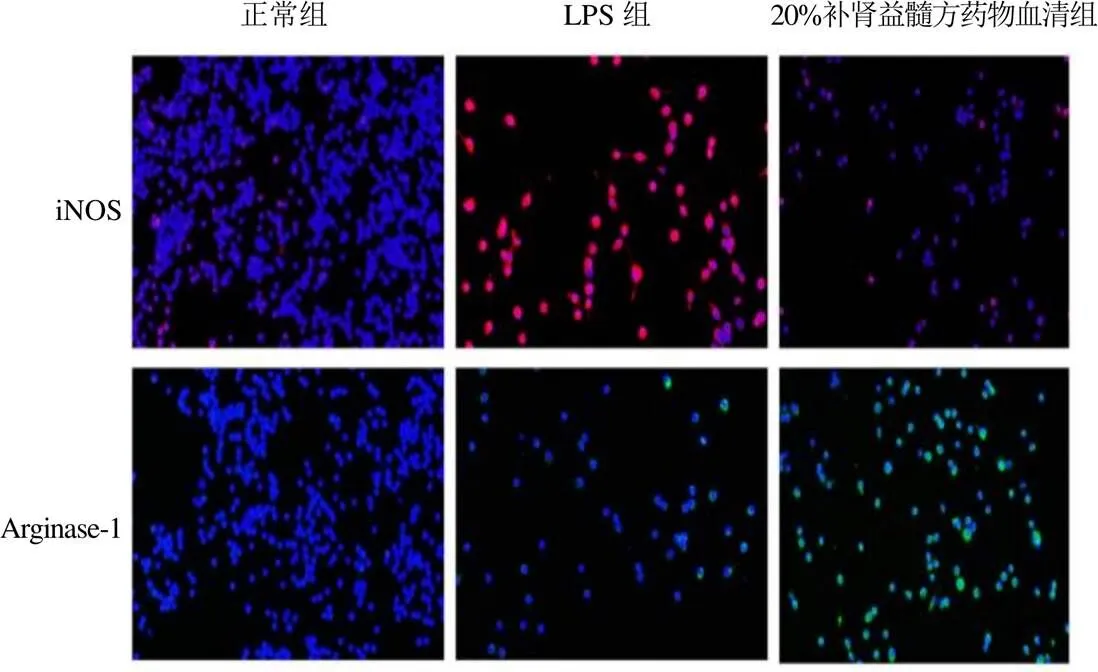
图2 各组BV2细胞iNOS、Arginase-1阳性表达(免疫荧光染色,×200)

表2 各组BV2细胞iNOS、Arginase-1表达比较(±s,平均荧光强度)
注:与正常组比较,*<0.05,**<0.01;与LPS组比较,★★<0.01
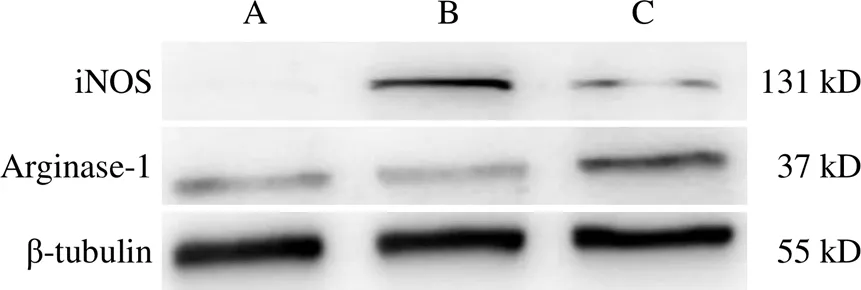
注:A.正常组;B. LPS组;C. 20%补肾益髓方药物血清组

表3 各组BV2细胞iNOS、Arginase-1蛋白表达比较(±s,相对表达量)
注:与正常组比较,*<0.05,**<0.01;与LPS组比较,★★<0.01
4.3 补肾益髓方药物血清对脂多糖诱导的BV2细胞miRNA-155-5p水平的影响
与正常组比较,LPS组BV2细胞miRNA-155-5p水平显著升高(<0.01);与LPS组比较,20%补肾益髓方药物血清组BV2细胞miRNA-155-5p水平显著降低(<0.01)。见表4。

表4 各组BV2细胞miRNA-155-5p水平比较(±s)
注:与正常组比较,**<0.01;与LPS组比较,★★<0.01
4.4 补肾益髓方药物血清对脂多糖诱导的miRNA-155-5p过表达BV2细胞诱导型一氧化氮合酶、精氨酸酶-1和CCAAT/增强子结合蛋白β表达的影响
免疫荧光和Western blot实验结果显示,与20%补肾益髓方药物血清组比较,miRNA-155-5p过表达组BV2细胞iNOS表达显著升高(<0.01),C/EBPβ、Arginase-1表达显著降低(<0.05,<0.01)。见图4、表5、图5、表6。

图4 各组BV2细胞iNOS、Arginase-1、C/EBPβ阳性表达(免疫荧光染色,×200)

表5 各组BV2细胞iNOS、Arginase-1、C/EBPβ表达比较(±s,平均荧光强度)
注:与20%补肾益髓方药物血清组比较,☆☆<0.01
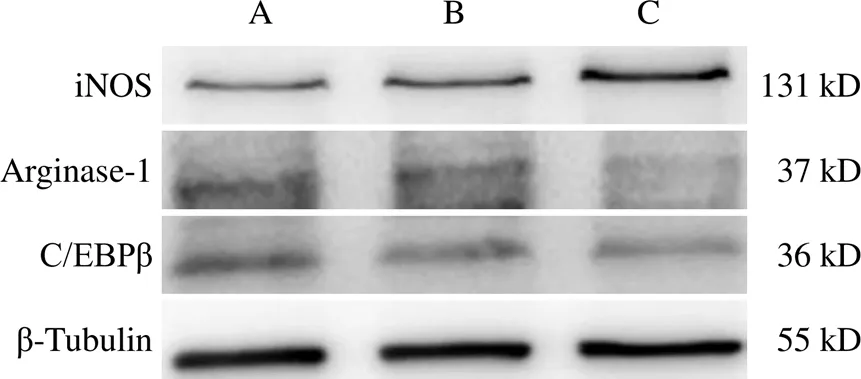
注:A. 20%补肾益髓方药物血清组;B.阴性对照组;C. miRNA-155-5p过表达组

表6 各组BV2细胞iNOS、Arginase-1、C/EBPβ蛋白表达比较(±s,相对表达量)
注:与20%补肾益髓方药物血清组比较,☆<0.05,☆☆<0.01
5 讨论
大多数MS患者出现肢体筋脉弛缓、软弱无力,不能随意运动,或伴有肌肉萎缩,甚至瘫痪。根据临床表现,MS可归属中医学“痿证”范畴。目前临床对MS急性期常采用糖皮质激素治疗,缓解期则使用疾病修正治疗,但西医治疗方案对神经再生治疗效果欠理想[13-14]。近年来,中医治疗MS取得一定疗效。MS病位在脑髓,肾主骨生髓,肾气不足,髓海失养,筋骨失约,致机体不能随意运动,最终导致痿证[15-16]。补肾益髓方由生地黄、熟地黄、酒大黄、益母草、浙贝母、水蛭、全蝎、天麻、连翘组成,其中生地黄和熟地黄补肾填精,充养脑髓,配伍浙贝母、益母草、水蛭、全蝎等化痰活血通络,以利于脑髓的充养[9,17]。
动物实验研究发现,补肾益髓方能抑制EAE小鼠小胶质细胞M1型标志物iNOS表达,提高M2型标志物Arginase-1表达[18]。还有学者发现,LPS刺激后,BV2细胞M1型细胞因子如肿瘤坏死因子-α、白细胞介素(IL)-1β分泌增加,M2型细胞因子如IL-10分泌减少[19]。本实验选用1 μg/mL LPS诱导BV2细胞24 h建立体外神经炎症模型,实验结果表明,LPS刺激后,BV2细胞活力明显下降,且iNOS表达显著上调,Arginase-1表达显著下调,提示炎症模型建立成功。根据课题组前期实验及预实验结果[20],本实验设立了5%、10%、20%浓度的补肾益髓方药物血清,利用CCK-8法筛选最佳血清浓度。结果表明,20%补肾益髓方药物血清治疗48 h后,BV2细胞活力明显升高,Arginase-1蛋白表达上调,iNOS蛋白表达下调,提示补肾益髓方含药血清可促进BV2细胞向M2型转化,与前期动物实验结果一致[18]。
miRNAs作为非编码小分子RNA,在调控炎症反应中起着重要作用。一些miRNAs已成为炎症反应过程中重要的基因表达调控因子。miRNA-155是一种特异性miRNA,参与神经退行性疾病炎症反应[21-22]。有研究发现,LPS可诱导BV2细胞向M1型极化,同时检测到miRNA-155水平上调[23],miRNA-155过表达可使BV2细胞吞噬活性降低,无法吞噬残存的髓鞘碎片[24],而miRNA-155敲减可促进M2型细胞因子分泌,抑制M1型细胞因子分泌[25]。深入研究发现,miRNA-155通过诱导T细胞分化调节EAE小鼠病程[26-27]。C/EBPβ是miRNA-155的下游靶基因,miRNA-155通过靶向C/EBPβ参与调节巨噬细胞极化,miRNA-155过表达可抑制C/EBPβ活性及巨噬细胞向M2型极化[28],而miRNA-155敲减可促进巨噬细胞向M2型极化及C/EBPβ表达[29]。本研究结果显示,LPS诱导后,BV2细胞miRNA-155-5p水平显著上调,提示炎症与miRNA-155-5p过表达有关,而经过补肾益髓方药物血清治疗后,miRNA-155-5p水平明显降低,说明补肾益髓方减轻炎症反应与抑制miRNA-155-5p表达密切相关。进一步采用慢病毒转染制备miRNA-155-5p过表达模型,再经补肾益髓方药物血清治疗48 h后抗炎作用不明显,说明补肾益髓方是通过miRNA-155介导的信号通路发挥抗炎作用。
综上所述,补肾益髓方对神经炎症有明显抑制作用,其作用机制可能为抑制miRNA-155和调控其下游基因C/EBPβ表达,促进小胶质细胞向M2型极化。本研究可为明确补肾益髓方治疗MS的作用机制提供实验依据。
[1] GUERRERO B L, SICOTTE N L. Microglia in multiple sclerosis:friend or foe?[J]. Front Immunol,2020,11:374.
[2] ORIHUELA R, MCPHERSON C A, HARRY G J. Microglial M1/M2 polarization and metabolic states[J]. Br J Pharmacol,2016, 173(4):649-665.
[3] HICKMAN S, IZZY S, SEN P, et al. Microglia in neurodegeneration[J]. Nat Neurosci,2018,21(10):1359-1369.
[4] TANG Y, LE W. Differential roles of M1 and M2 microglia in neurodegenerative diseases[J]. Mol Neurobiol,2016,53(2):1181- 1194.
[5] SUCKSDORFF M, TUISKU J, MATILAINEN M, et al. Natalizumab treatment reduces microglial activation in the white matter of the MS brain[J]. Neurol Neuroimmunol Neuroinflamm,2019,6(4):e574.
[6] 甘德强,高纯一,姜正林,等.小胶质细胞极化在中枢神经系统损伤中的作用及机制[J].南通大学学报(医学版),2017,37(1):46-52.
[7] PINTO M V, FERNANDES A. Microglial phagocytosis-rational but challenging therapeutic target in multiple sclerosis[J]. Int J Mol Sci,2020,21(17):5960.
[8] ZHENG X, HUANG H, LIU J, et al. Propofol attenuates inflammatory response in LPS-activated microglia by regulating the miR-155/ SOCS1 pathway[J]. Inflammation,2018,41(1):11-19.
[9] 赵雪松,樊永平,杨涛,等.补肾益髓法对复发缓解型多发性硬化患者认知功能的影响[J].中华中医药杂志,2018,33(11):4903-4905.
[10] 孙豪,郑宏,计婧,等.补肾益髓方促进实验性自身免疫性脑脊髓炎小鼠小胶质细胞向M2极化的作用[J].首都医科大学学报,2018,39(6):798-804.
[11] 王永强,师一民,安辰,等.补肾益髓方促进实验性自身免疫性脑脊髓炎小鼠髓鞘再生的作用[J].环球中医药,2016,9(12):1443-1449.
[12] ZHENG Q, LIU L, LIU H L, et al. The Bu Shen Yi Sui Formula promotes axonal regeneration via regulating the neurotrophic factor BDNF/TrkB and the downstream PI3K/Akt signaling pathway[J]. Frontiers in Pharmacology,2019,10:796.
[13] SALEEM S, ANWAR A, FAYYAZ M, et al. An overview of therapeutic options in relapsing-remitting multiple sclerosis[J]. Cureus, 2019,11(7):e5246.
[14] 钟晓南,胡学强.《多发性硬化诊断和治疗中国专家共识(2018版)》解读[J].中国神经免疫学和神经病学杂志,2019,26(2):80-83.
[15] 黄春英,周哲屹,刘国成.补肾填精方治疗多发性硬化21例[J].河南中医,2018,38(9):1409-1412.
[16] 朱文浩,高颖.论多发性硬化与肝肾的关系[J].中国中医急症,2012, 21(12):1918-1919.
[17] 赵雪松,樊永平,杨涛,等.补肾益髓方对复发缓解型多发性硬化患者睡眠及生命质量的影响[J].世界中医药,2020,15(12):1762-1765, 1770.
[18] ZHA Z, GAO Y F, JI J, et al. Bu Shen Yi Sui Capsule alleviates neuroinflammation and demyelination by promoting microglia toward M2 polarization, which correlates with changes in miR-124 and miR-155 in experimental autoimmune encephalomyelitis[J]. Oxid Med Cell Longev,2021,2021:5521503.
[19] WEN X, XIAO L, ZHONG Z, et al. Astaxanthin acts via LRP-1 to inhibit inflammation and reverse lipopolysaccharide-induced M1/M2 polarization of microglial cells[J]. Oncotarget,2017, 8(41):69370-69385.
[20] 刘蕾,郑琦,安辰,等.补肾配伍化痰活血药对低血清培养SH-SY5Y神经细胞轴突生长的影响[J].中医药信息,2014,31(5):5-9.
[21] WEN Y, ZHANG X, DONG L, et al. Acetylbritannilactone modulates microRNA-155-mediated inflammatory response in ischemic cerebral tissues[J]. Mol Med,2015,21(1):197-209.
[22] YANG J, ZHU X, HU H, et al. The inhibitory effect of Gualou Guizhi Decoction on post-ischemic neuroinflammation via miR-155 in MCAO rats[J]. Ann Palliat Med,2021,10(2):1370-1379.
[23] JUKNAT A, GAO F, COPPOLA G, et al. miRNA expression profiles and molecular networks in resting and LPS-activated BV-2 microglia-effect of cannabinoids[J]. PLoS One,2019,14(2):e212039.
[24] RODRIGUEZ-GOMEZ J A, KAVANAGH E, ENGSKOG-VLACHOS P, et al. Microglia:agents of the CNS pro-inflammatory response[J]. Cells, 2020,9(7):1717.
[25] LI J, ZHANG J, GUO H, et al. Critical role of alternative M2 skewing in miR-155 deletion-mediated protection of colitis[J]. Front Immunol,2018,9:904.
[26] 耿洁,刁勇,王文欣,等.微小RNA-155在炎症中的调控作用与机制[J].江苏医药,2020,46(4):425-430.
[27] 樊赟,卞华.miRNA-155在系统性硬化病中作用的研究进展[J].风湿病与关节炎,2020,9(5):77-80.
[28] ZHANG P, WANG H, LUO X, et al. MicroRNA-155 inhibits polarization of macrophages to M2-type and suppresses choroidal neovascularization[J]. Inflammation,2018,41(1):143-153.
[29] BALA S, CSAK T, SAHA B, et al. The pro-inflammatory effects of miR-155 promote liver fibrosis and alcohol-induced steatohepatitis[J]. J Hepatol,2016,64(6):1378-1387.
Effects ofPrescription for miRNA-155 Signaling Pathway Related Factors on Lipopolysaccharide-Induced Neuroinflammation in BV2 Cells
GAO Yanfang1, ZHA Zheng1, XUE Bing2, LI Junling1, QI Fang1, JIN Liangyun2,ZHANG Nan1, FAN Yongping3, WANG Lei1
To observe the effects ofPrescription-containing drug serum on the inflammation of BV2 microglial cells; To explore its possible mechanism against neuroinflammation.1 μg/mL LPS was used to induced BV2 cell inflammation model. The BV2 microglial cells were randomly divided into normal group, LPS group,Prescription-containing drug serum (5%, 10%, 20%) group and blank serum (5%, 10%, 20%) group, the cell viability was detected by CCK-8 assay. On the basis of experiments, the cells were divided into normal group, LPS group and 20%Prescription-containing drug serum group. The expressions of iNOS and Arginase-1 in cells were detected by immunofluorescence and Western blot, and the expression level of miRNA-155-5p in cells was measured by RT-qPCR. The miRNA-155-5p overexpression model were prepared by lentiviral transfection, the cells were divided into 20%Prescription-containing serum group, negative control group and miRNA-155-5p overexpression group, the expressions of iNOS, Arginase-1 and C/EBPβ in cells were detected by immunofluorescence and Western blot.Compared with the normal group, the cell viability of the LPS group was significantly reduced (<0.01), the levels of iNOS and miRNA-155-5p significantly increased, and the expression of Arginase-1 was significantly reduced (<0.05). Compared with the LPS group, the cell viability of the 20%Prescription-containing drug serum group significantly increased (<0.01), the levels of iNOS and miRNA-155-5p were significantly reduced (<0.01), and the expression of Arginase-1 significantly increased (<0.01). Compared with the 20%Prescription-containing drug serum group, the expression of iNOS in the miRNA-155-5p overexpression group was significantly increased (<0.01), and the expression of Arginase-1 and C/EBPβ was significantly decreased (<0.01).Prescription can inhibit LPS-induced inflammatory reaction in BV2 cells, and its mechanism of action is related to improving cell viability, up-regulating the expression of Arginase-1, down-regulating the expression of iNOS, and inhibiting the miRNA-155 signaling pathway.
Prescription; neuroinflammatory; BV2 microglial cells; lipopolysaccharide; miRNA-155 signaling pathway
R285.5
A
1005-5304(2021)12-0061-07
10.19879/j.cnki.1005-5304.202105378

国家自然科学基金(81873252)
王蕾,E-mail:tmwangl@ccmu.edu.cn
(2021-05-23)
(修回日期:2021-06-16;编辑:郑宏)
