孟加拉玫瑰红-绿光角膜胶原交联术的研究进展
2021-12-13陈雪阳高蓉蓉王勤美黄锦海
陈雪阳 高蓉蓉 王勤美 黄锦海
作者单位:温州医科大学附属眼视光医院 325027
角膜胶原交联术(Corneal collagen cross-linking,CXL)是一种增加角膜硬度并维持角膜生物力学稳定性的光化学方法。20世纪90年代,美国理工大学的研究人员首次提出将核黄素-紫外光诱导的角膜胶原交联术(Collagen crosslinking by riboflavin-ultraviolet-A,UVX)作为治疗进展性圆锥角膜的方法[1]。经过多年的基础实验探索和临床研究,该技术的适应症范围不断扩大,目前可用于多种角膜疾病的治疗,包括LASIK术后导致的角膜扩张性疾病、感染性角膜炎、角膜移植术后复发的圆锥角膜等,均取得较好效果。传统UVX的局限性和不良反应不容忽视,包括要求治疗的角膜厚度最少达400 μm、治疗过程耗时较长以及对角膜基质细胞和内皮细胞有潜在毒性作用等[2]。玫瑰红-绿光角膜胶原交联术(Collagen cross-linking by rose bengal-green light,RGX)是Cherfan等[2]在2013年提出的一种新型CXL技术,很好地解决了UVX的不足。本文将对RGX的原理和过程、安全性与有效性、与UVX的比较及其在眼部的应用等进行综述。
1 RGX的原理和过程
孟加拉玫瑰红(Rose bengal,RB)是一种卤化的黄嘌呤染料,常用作生物和非生物系统中氧化的光敏剂,是食品药品监督管理局(Food and drug administration,FDA)批准的角膜表面损伤诊断剂[3],其分子式为C20H2CL4I4Na2O5,分子量为1 017.64,具有亲水性(见图1)。RGX的原理是RB强烈吸收532 nm处的绿光,被激活后通过电子转移机制和单线态氧(1O2*)机制使角膜中蛋白质分子之间形成共价键发生光化学交联反应[4],从而有效增强角膜硬度和抗形变能力[2]。角膜中的RB分子吸收绿光后被激发为单重态(1RB*),然后激发为三重态(3RB*)。后续的反应包括2种机制(见图2):I型机制,能量转移途径:当缺乏O2时,3RB*通过从供体分子(如胺)接收电子,形成RB的阴离子自由基(RB·-)和供体分子的阳离子自由基(Donor·+),Donor·+去质子化和重排产生的自由基中间体以及RB·-质子化形成的额外自由基都可以导致蛋白质共价交联;II型机制,能量转移途径:当存在足够的O2时,3RB*将能量转移到O2生成与某些氨基酸(主要是组氨酸)发生反应,在蛋白质分子之间产生共价键[3-4]。Wertheimer等[4]研究表明当缺乏O2时,加入的生物分子(精氨酸)将电子转移到3RB*上产生引发交联的反应性中间体,通过电子转移途径来增强交联效果;当存在O2时,加入叠氮化钠(1O2*淬灭剂)和重水(延长1O2*的存在时间),分别通过抑制和增强能量转移途径明显抑制和增强交联效果。本研究证实2种途径均能有效地增强角膜硬度,但以II型机制为主。
RGX的过程与传统的UVX过程类似,术中先去除角膜中央上皮,用0.1%RB(溶于PBS中)浸润角膜一定时间后,再用532 nm的绿光照射角膜。目前对于RGX的实施参数并没有统一的标准,不同动物实验采用的RGX方案(包括RB浸润时间、绿光的辐照度以及照射时间)有所差异:Bekesi等[5]和Gallego等[6]采用浸润2 min——照射200 s——浸润30 s——照射200 s(辐照度0.25 W/cm2,总能量100 J/cm2);Cherfan等[2]和Zhu等[7]采用浸润2 min——照射10 min,在3.3min和6.7 min时额外滴加RB浸润30 s(辐照度0.25 W/cm2,总能量150 J/cm2);Wang等[8]采用浸润20 min(5 min/次×4次)——黑暗中静置10 min——照射120 s——浸润30 s——照射130 s(辐照度0.4 W/cm2,总能量100 J/cm2)。
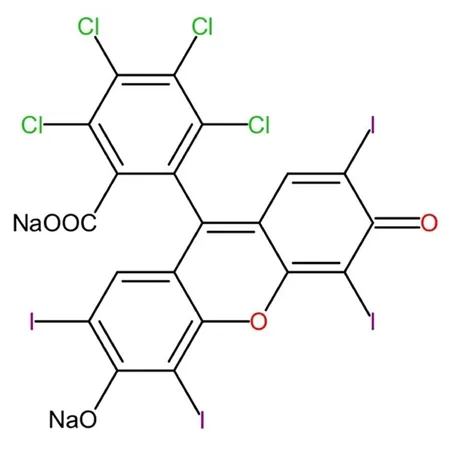
图1.Rose bengal的分子式Figure 1.The formula of Rose bengal.

图2.RGX的光化学途径I型机制是三重态的RB(3RB*)从供体分子(Donor)接收电子,形成RB阴离子自由基(RB·-);II型机制是3RB*将能量转移到O2产生单线态氧(1O2*)。在进一步的反应之后,这2 种途径都可以使蛋白质分子进行交联Figure 2.Photochemical Pathway of RGX.The mechanism of type I is that the triplet RB (3RB*) receives electrons from donor molecules (Donor) to form the anion free radical RB (RB·-),and Type II is that the 3RB* transfers energy to O2 to produce singlet oxygen(1O2*).After further reactions,both pathways allow the protein molecules to be cross-linked.
2 RGX的有效性与安全性
大量动物实验已证实RGX的有效性。基于兔和猪的角膜条带拉伸实验证实RGX术后角膜的机械硬度大约增加2~4倍[2,7-9]。与未处理组相比,离体猪角膜的硬度在RGX(100 J/cm2)术后即刻增加了约2倍[9]。兔的角膜硬度在RGX(100 J/cm2)术后4周增加了2.5倍[8],在RGX(150 J/cm2)术后第1天与第28天分别增加了1.9倍和2.8倍[7],表明术后时间越长,交联效果越显著。研究发现仅用RB浸润角膜而不进行光照也有一定的交联效果,与未处理的对照组相比,RB浸润后兔眼角膜硬度增高1.9倍[2],原因可能是RB与胶原的结合在胶原分子或微纤维之间架起桥梁,改变周围的离子环境和基质的分子组织以增加角膜硬度[10];在RB浸润后,照射能量越高交联效果越好,100 J/cm2和150 J/cm2的RGX方案让角膜平均硬度分别增加了2.3倍和3.8倍[2]。胶原酶和蛋白水解酶活性的增加会破坏角膜基质中一些胶原的交联,最终导致生物力学的薄弱和不稳定,RGX可增强角膜的抗胶原酶溶解能力。离体角膜溶解实验表明,RGX(100 J/cm2)术后的兔角膜[8,10]和猪角膜[9]的胶原酶溶解时间较未处理组分别长约5 d[8,10]和9 d[9]。Bekesi等[5,11]将可视化角膜生物力学分析仪(Corneal visualization biomechanical analyzer,Corvis ST)用于在体评估兔眼角膜的力学特性,根据测量参数结合逆向建模技术得到了角膜材料的超弹性,表明RGX(100 J/cm2)术后的角膜弹性下降了11倍。上述研究所用的实验方法、照射能量和评估方式不同导致结果不完全相同,但均验证了RGX的有效性。
3 RGX与传统交联术的比较
传统的UVX过程即“Dresden”去上皮方案[1]:去除角膜中央直径6~9 mm的上皮,然后使用0.1%的核黄素(溶于20%的右旋糖酐中)溶液逐步滴加到角膜上,每3~5 min滴1 次,共浸润30 min,再使用波长370 nm的紫外线A(Ultraviolet A,UVA)照射,辐照度为3 mW/cm2(总能量为5.4 J/cm2)。虽然该方案已在临床运用十多年,但有以下局限性:①不适用于角膜中央厚度在400 μm以下的患者;②长时间的UVA照射会引起患者不适;③核黄素可通过基质自由扩散,进入细胞内吸收UVA,产生细胞毒性物质[7]。与UVX相比,RGX具有诸多优势:RB较浅的穿透力使其适用于薄角膜,整个过程不超过15 min,RB抑制微生物生长的作用可能使术后患者角膜感染发生率降低[15]。Bekesi等[5,11]用Corvis ST结合逆向建模技术测量RGX与UVX术后的兔角膜生物力学特性,结果显示RGX组和UVX组术后即刻的角膜弹性分别比未处理组下降11倍和6.25倍,术后1个月、术后2个月RGX组和UVX组的等效杨氏模量分别比未处理组增加3.4倍和1.7倍、10.7倍和7.3倍。Fadlallah等[10]研究表明RGX组的角膜溶解时间与UVX组相同,表明二者的交联效果相当。Lorenzo等[14]发现UVX组术后的兔眼角膜Haze比RGX组更严重,造成的基质细胞损伤更深、更持久。
4 RGX在眼部的应用研究
4.1 圆锥角膜
圆锥角膜以角膜表面因角膜基质变薄或变弱而突出为特征,角膜在视轴处或周围逐渐呈锥形,导致视力变差和严重的散光,其治疗以视觉康复和减缓疾病进展为主。CXL让胶原纤维中胶原分子间形成共价交联,使角膜更能抵抗眼内压的作用力[16-17]。UVX延缓圆锥角膜进展的作用已见大量临床报道[18-19],而RGX的有效性目前停留于动物实验(见上述第2部分),尚未见临床报道。
4.2 促进角膜伤口愈合
对于角膜伤口的闭合方法,传统的缝线缝合法可能会导致一些潜在的并发症,例如暴露的缝线引起刺激和炎症,可能导致细菌、病毒和真菌的感染,且缝线过早松动可能导致伤口渗漏;若缝线太松或太紧则会导致散光,从而影响视力。因此,有学者提出通过在组织之间产生共价键交联的方法使角膜伤口闭合。Proaño等[20]将1.5 mM RB溶液注射到兔角膜切口后,用514 nm的绿光(0.64 W/cm2)照射180 s、240 s和300 s,随着照射时间延长,角膜的密封性逐渐增加,可承受的眼内压也逐渐增高,分别是230 mmHg(1 mmHg=0.133 kPa)、370 mmHg和500 mmHg。Wang等[21]用类似的RGX方案闭合猪角膜穿透性切口,得到了类似的效果。在用羊膜封闭较大的伤口方面,Verter等[22]用0.1%RB浸润羊膜表面5 min后置于兔角膜伤口,用532 nm的绿光(0.25 W/cm2)照射3.3 min、6.7 min、10 min,发现RGX可促进羊膜与伤口表面的粘合。Soeken等[23]将RGX(0.27 mW/cm2,68 J/cm2)用于复杂的兔眼角巩膜裂伤,可使羊膜粘合到伤口上促进伤口愈合,且炎症和继发性影响很小。Seiler等[24]用飞秒激光制作兔眼角膜瓣后用RGX(参数设置:0.1%RB浸润角膜2 min,532 nm的绿光照射14 min,辐照度0.18 mW/cm2,总能量150 J/cm2)闭合创口,RGX组的剪切力比未处理的对照组增加2.1倍,表明RGX可增加角膜瓣与基质床之间的粘连,但还需要进行体内试验来评估远期效果。以上动物研究均证实RGX在促进角膜伤口愈合方面有广阔的应用前景。
4.3 感染性角膜炎
感染性角膜炎是由多种致病因素导致角膜感染的潜在的致盲性疾病,常见病原体包括细菌、真菌、病毒和寄生虫等。目前药物治疗作为其主要治疗方式,存在耐药菌增多、抗菌药的成本增加、角膜融解和角膜瘢痕形成风险升高等诸多问题。光动力疗法(Photodynamic therapy,PDT)是治疗感染性角膜炎的新方法,通过从紫外光到近红外波长范围的光将光敏剂激活到激发态,与周围环境的O2发生反应生成ROS,ROS与细胞内成分发生反应,使细胞失活和死亡[25]。已有体外研究发现孟加拉玫瑰红介导的光动力疗法(Rose bengal-photodynamic therapy,RB-PDT)对角膜炎患者角膜中分离得到的铜绿假单胞菌菌株(照射15 min,总能量5.4 J/cm2)[26]、3株真菌菌体(镰刀菌、烟曲霉和白色念珠菌,照射34 min,总能量5.4 J/cm2)[27]以及耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus,MRSA)(照射34 min,总能量5.4 J/cm2)[15]均有抑制作用,且可完全抑制2株多重耐药的MRSA菌株的生长[15]。Halili等[15]研究还发现仅用0.1%浓度RB的无光照组也可以完全抑制MRSA菌株的生长,但该组有可能暴露在可能的光激活下,并非RB本身有毒性。RB-PDT(照射10 min,总能量5.4 J/cm2)可杀死63%的棘阿米巴细胞[28],但需要进一步研究来证实。Andrea等[29]从细胞和分子角度评估RB-PDT(照射15 min,总能量5.4 J/cm2)对兔眼的安全性,细胞凋亡实验显示细胞凋亡仅限于角膜表面和治疗区附近,高倍镜下观察角膜内皮细胞无形态改变和凋亡。在临床方面,仅Amescua等[30]报道了用RB-PDT成功治疗了一例多重耐药的镰刀菌性角膜炎患者,术中清除溃疡区角膜上皮,滴入0.1%RB浸润30 min,518 nm的绿光进行照射,总能量0.9 J/cm2,间隔12 d后再以1.8 J/cm2的总能量进行二次手术,二次术后6个月的随访中,没有感染复发和不良反应。由此可见,对于感染性角膜疾病,尤其是难治性角膜炎,RB-PDT具有治疗的潜在价值,但其有效性和安全性仍需大量的临床研究来证实。
5 总结与展望
综上所述,RB作为光敏剂,其毒性小、组织相容性好,RGX作为一种新型交联技术,在治疗圆锥角膜和感染性角膜炎以及促进角膜伤口愈合方面应用前景广阔。目前对于RGX局限于动物实验和体外研究,RB的浸润时间、绿光照射时间和能量尚缺乏规范的标准,今后研究可关注RGX实施具体参数的探索,并且需要更多的动物实验和临床研究来评估其远期效果,为圆锥角膜和其他相关角膜疾病提供安全有效的治疗方案。
利益冲突申明本研究无任何利益冲突
作者贡献声明陈雪阳:收集文献资料,归纳分析并撰写论文,根据编辑部的修改意见对文章进行修改。高蓉蓉:参与选题设计,指导资料的分析和解释,参与论文的修改。王勤美、黄锦海:参与选题设计,对论文的知识性内容作批评性审阅
