基于网络药理学的猫爪草治疗结核病作用机制研究
2021-12-13刘媛陈洁孙辉许苑南马志强刘向芳刘梦醒刘幸
刘媛,陈洁,孙辉,许苑南,马志强,刘向芳,刘梦醒,刘幸*
(1.昆明市第三人民医院,云南 昆明 650041;2普洱学院,云南 普洱 665000)
猫爪草系毛茛科植物小毛茛(RanunculusternatusThunb.)的干燥块根,其性温、味甘、辛,归肝、脾经,具有清热解毒、消肿散结、止咳去痰之功效[1]。临床应用猫爪草治疗肺结核和淋巴结核有较好的疗效,具有广阔的应用前景[2-3]。世界卫生组织发布的《2019年全球结核病报告》显示全球新增结核病(tuberculosis,TB)患者为1000万人,死亡率达到25%,处于所有传染性疾病首位[4-5]。随着近年来耐药TB的感染率逐步上升及一线新的抗TB药物的匮乏,导致TB的防治任务变得越来越艰巨。因此,发掘和充分利用中草药治疗TB,是当前医学发展的迫切需求。Feng等[6]从猫爪草根中提取了5种新的杂环化合物,这些化合物的结构与一些抗结核药物的结构相似。周勇等[7]研究发现,猫爪草可能通过提高颗粒裂解肽的表达,进而提高患者抗结核杆菌的能力,达到治疗效果。杨牧之等[8]通过体外实验表明,猫爪草多糖可通过激活小鼠腹腔巨噬细胞活力和吞噬功能,从而增强机体免疫功能。以上研究表明,猫爪草及其有效成分具有抑菌、调节免疫力等作用,治疗TB疗效确切。
中药具有多成分、多靶点的特征,通过调控多通路发挥其疗效,但目前对猫爪草治疗TB的机制多从单一成分或单一靶点进行研究。因此,本研究基于网络药理学方法,通过建立成分-靶点-信号通路多层次网络模型,分析猫爪草治疗TB的成分、作用靶点及调控通路的信息,从整体角度研究猫爪草治疗TB的物质基础和作用机制,为临床用药提供合理依据。
1 材料与方法
1.1 猫爪草的活性化合物及相关靶点筛选
通过中药系统药理学数据库与分析平台(Traditional Chinese medicine systems pharmacology database and analysis platform, TCMSP)(http://tcmspw.com/tcmsp.php)[9],以“猫爪草”为关键词检索猫爪草的化学成分。根据口服生物利用度(oral bioavailability, OB)≥30%和类药性(drug-likeness, DL)≥0.18 的2个ADME属性值作为筛选猫爪草潜在活性化合物及其作用靶点的标准[10-11]。由于检索到的药物靶点存在命名不规范等问题,本研究利用Uniprot(https://www.uniprot.org/)数据库输入蛋白名称并限定“Specie”为“Homo Sapiens”,校正靶点蛋白为规范的基因名称。
1.2 TB相关靶点筛选
以“tuberculosis”为关键词,挖掘GeneCards数据库(https://www.genecards.org/)中治疗TB的潜在靶点。在GeneCards数据库中,评分(Score值)越高则代表该靶点与疾病联系密切。
1.3 蛋白质-蛋白质相互作用网络构建
为明晰猫爪草相关靶点与TB靶点间的相互作用,利用VENNY2.1软件将二者靶点取交集并绘制维恩图[12]。进而将交集靶点传至STRING 11.0数据库(https://string-db.org/)构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络模型[13],选择“multiple proteins”,将生物种类设定为“Homo sapiens”进行检索,设置为评分≥0.9,以提高生物信息的可信度,通过以上信息的处理导出PPI网络图。下载tsv文件,保留节点(node1,node2)和结合率评分信息,并导入到Cytoscape 3.7.0软件,分析靶点相关的拓扑参数。
1.4 GO和KEGG通路富集分析
运用DAVID(the database for annotation,visualization and integrated discovery)6.8数据库(https://david.ncifcrf.gov)对猫爪草和TB共同作用得到的交集基因进行基因本体(gene ontology, GO)分析。将所涉及潜在靶点基因参与的生物过程(biological process, BP)、分子功能(molecular function, MF)、细胞成分(cellular component, CC)三方面进行GO(gene ontology)分析[14]。以P<0.05 为阈值,将其按P值升序进行排序,并将结果以气泡图形式输出。交集基因进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,根据P值筛选显著性高的通路,设置P<0.05,选取最显著的10个通路。
1.5 成分-靶点-信号通路构建
基于药物-成分-靶点-信号通路,运用Cytoscape构建药理学网络。根据KEGG通路富集分析结果所选取的主要信号通路,同时与参与相关通路的靶点建立联系,并与成分-靶点间相互作用关系整合并导入Cytoscape 3.7.0软件中,从而得到成分-靶点-信号通路网络图。
1.6 分子对接验证
通过PubChem Compound数据库(https://pubchem.ncbi.nlm.nih.gov/)下载猫爪草的活性成分分子结构SDF格式文件,并利用Open Babel 2.3.2软件将SDF文件转化为PDB文件。通过从Protein Data Bank数据库(http://www.rcsb.org/pdb)中检索获得靶蛋白BAX(PDBID: 4BD6)、BCL2(PDBID: 5JSN)、CASP3(PDBID: 2J32)、CASP8(PDBID: 4PS1)、CASP9(PDBID: 3V3K)。运用AutoDock 软件研究活性成分与靶点之间的分子对接可能,结果以亲和能的形式输出,通过计算受体(靶点)-配体复合物(活性成分)的空间效果、排斥作用、氢键、疏水相互作用以及分子的灵活性等值综合打分,评估其亲和力,最终得出亲和能打分。亲和能是衡量配体是否能与受体分子有效结合的重要指标,能值越低,表明二者的结合效果越好。
2 结果
2.1 猫爪草的活性化合物及相关靶点筛选
通过TCMSP共检索到猫爪草中有效化合物79种。经ADME筛选出活性化合物12种,相关信息见表1。通过UniProt数据库找出化学成分对应的靶基因名称,物种限定为“Homo sapiens”,去除重复的基因,共获得40个靶点基因,相关信息见表2。

表1 猫爪草化合物信息特征表
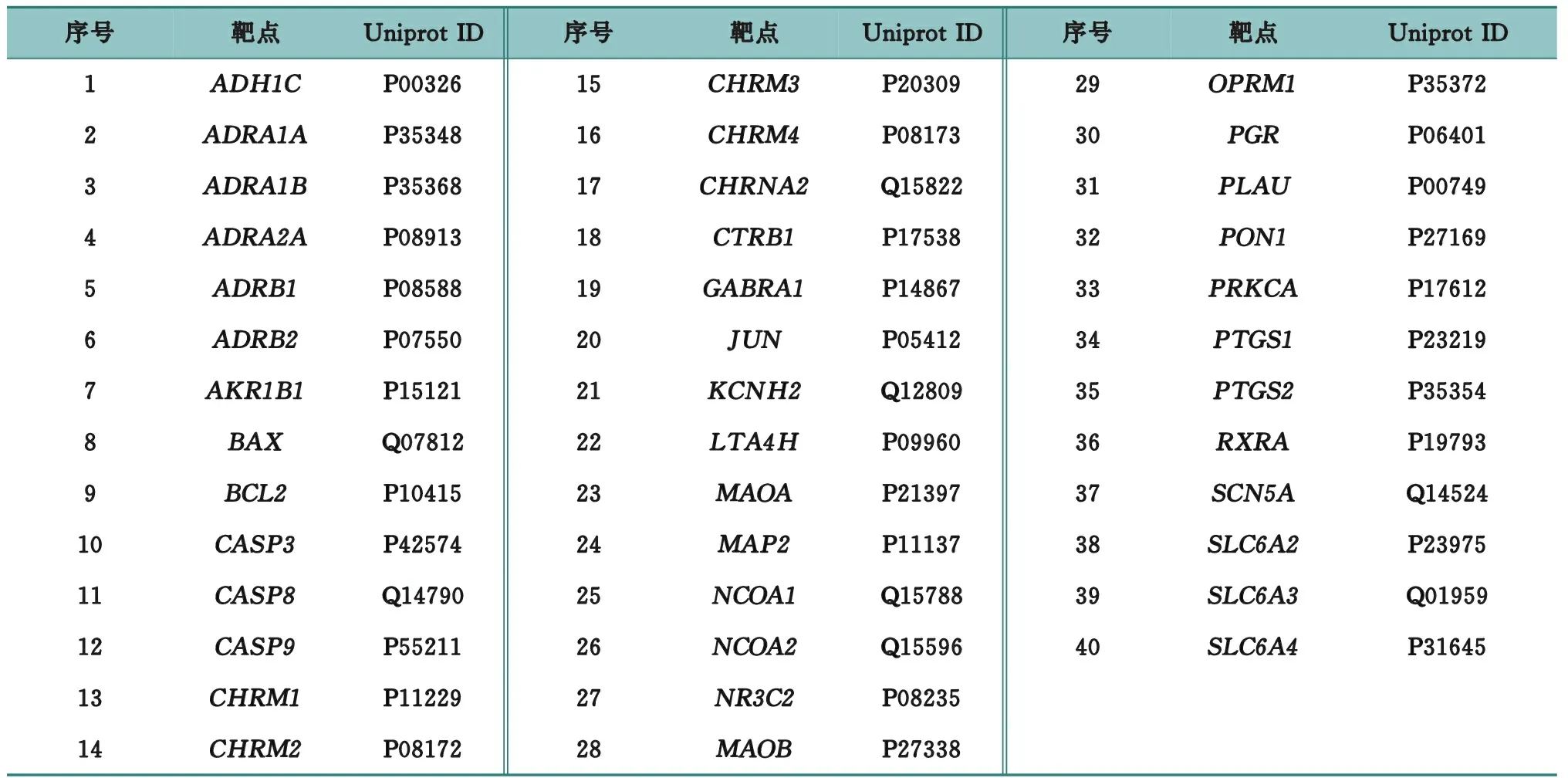
表2 猫爪草潜在靶点
2.2 TB相关靶点的获取
在GeneCards数据库中检索“tuberculosis”,获得TB靶点2378个。根据经验设定评分大于中位数的目标靶点为TB的潜在靶点,评分最大值为48.97,最小值为0.14,中位数为1.15,故设定评分大于1.15的靶点为TB的潜在靶点,最终得到1187个相关靶点。
2.3 PPI网络构建
将筛选的猫爪草活性成分靶点与TB靶点取交集,并通过VENNY 2.1软件绘制维恩图,得到猫爪草成分-TB共同靶点10个,分别为:ADRB2、OPRM1、BCL2、BAX、CASP9、JUN、CASP3、CASP8、LTA4H、NR3C2,见图1。进而将靶点提交至STRING数据库进行分析,构建猫爪草-TB靶点PPI网络图,见图2。有4个靶点因为没有与网络相联系,故剔除,分别为ADRB2、OPRM1、LTA4H、NR3C2。该网络包括6个节点,14条边。图中节点表示靶点,节点内部的螺旋结构表示该基因的三围结构,边表示靶点间的互作关系。度值越大则节点越大,平均度值为4.67。图表显示猫爪草治疗TB的靶点中度值排名前6的为CASP3、CASP8、CASP9、BAX、BCL2、JUN,说明这些基因在网络中发挥了相对重要的作用,成为网络中联通其他节点的关键节点,见表3。
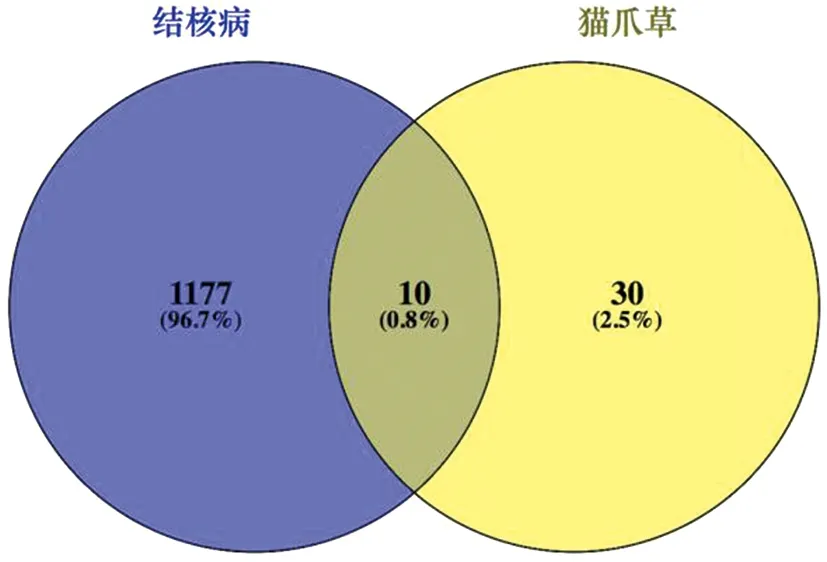
注:紫色代表TB靶点;黄色代表猫爪草靶点;深黄色部分为共同靶点。图1 猫爪草-TB共同基因靶点数Fig.1 Number of overlapping target genes between Ranunculi Ternati Radix and TB
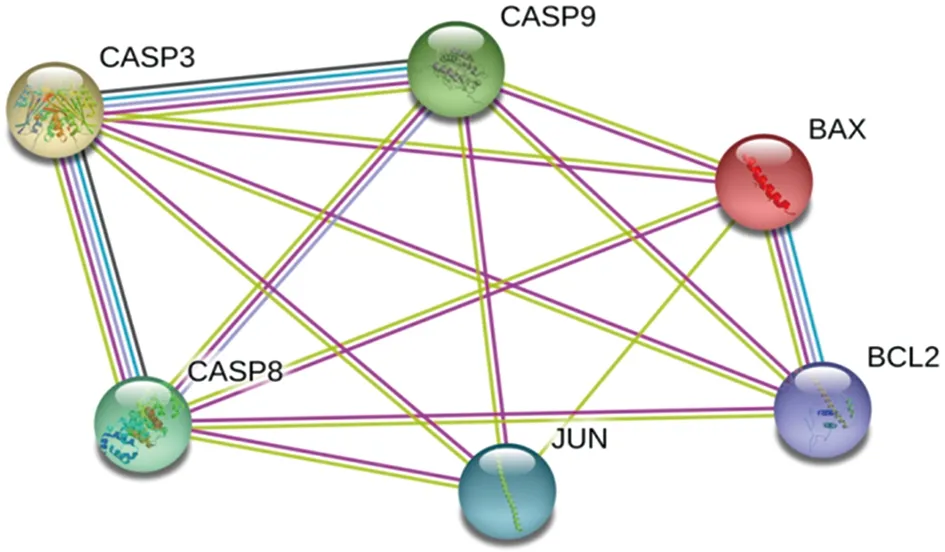
图2 猫爪草-TB靶点PPI网络图Fig.2 PPI network of Ranunculi Ternati Radix-TB targets

表3 猫爪草与TB共有靶点的分析
2.4 GO和KEGG通路富集结果与分析
运用DAVID数据库对猫爪草治疗TB的靶点进行GO富集分析(P<0.5),分别从BP、MF、CC这三个方面进行。猫爪草治疗TB的GO基因富集分析根据校正后P值进行排序,共得到GO条目8个。以BP结果较多,BP主要与凋亡过程的调控、细胞周期调节、细胞对紫外线的应答等有关,将结果进行气泡图展示,见图3。
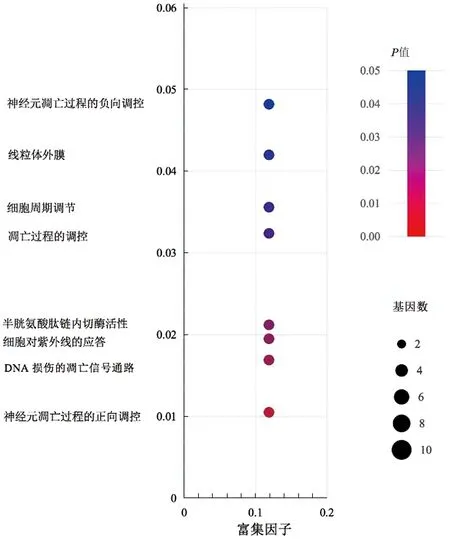
图3 猫爪草潜在靶点GO富集分析Fig.3 Analysis of GO enrichment of potential targets of Ranunculi Ternati Radix
为进一步探究猫爪草的作用靶点在生物信号通路层面的机制,将交集靶点基因与KEGG 通路进行映射,根据校正后P值筛选前10条通路,见表4。结果表明猫爪草的信号通路包括癌症通路、凋亡、HIV-1病毒感染、EB病毒感染、乙肝、麻疹、结核病、p53信号通路、单纯疱疹病毒感染、沙门氏菌感染。由上述KEGG富集结果分析可知,猫爪草与TB、凋亡等相关信号通路有较密切联系,其中主要的活性靶点为CASP8、BAX、BCL2、CASP9、CASP3,这表明猫爪草可能通过影响细胞凋亡从而发挥治疗TB的作用[15],见图4。
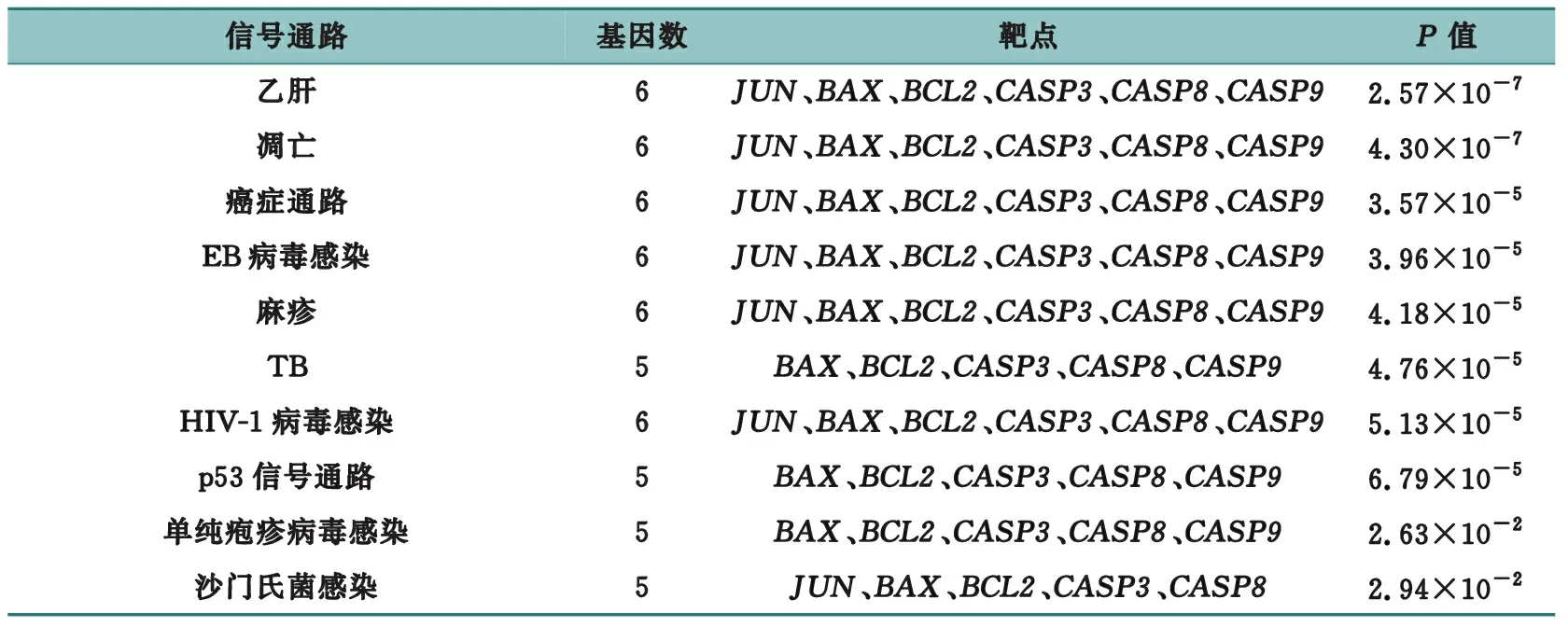
表4 KEGG富集分析结果
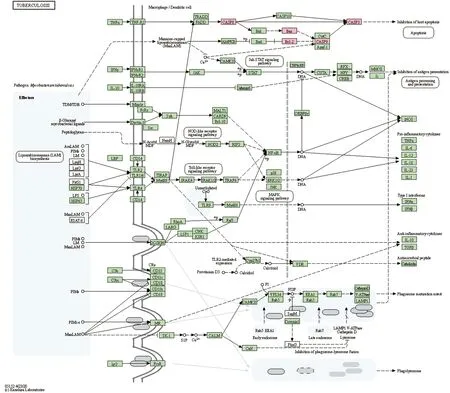
注:粉红色代表猫爪草活性靶点图4 TB信号通路Fig.4 Signaling pathway involving TB development

注:蓝色代表猫爪草活性成分;粉红色代表潜在靶点;绿色代表信号通路图5 猫爪草治疗TB成分-靶点-信号通路Fig.5 Ranunculi Ternati Radix in the treatment of TB: components-target-signaling pathway
2.5 成分-靶点-信号通路构建
运用Cytoscape 3.7.0 软件构建猫爪草活性成分-作用靶点-代谢通路网络。图中包括猫爪草活性成分12种,TB与猫爪草交集靶点10 个,信号通路10条。筛选出的猫爪草候选活性成分的作用靶点分布在不同的信号通路,相互协调,通过调控不同的信号通路发挥治疗TB的作用,结果见图5。成分-靶点-信号通路网络显示,预测出猫爪草治疗TB的12种潜在活性成分与BCL2、BAX、CASP9、JUN、CASP3及CASP8等靶点存在较强的相互作用,通过KEGG富集分析显示这些靶点主要集中在TB、凋亡、癌症、p53 等相关信号通路。该成分-靶点-信号通路图体现了猫爪草多成分-多靶点-多途径调节TB的特点,这一特点与中药治疗疾病的系统性与整体性相统一。
2.6 分子对接验证
12种活性化合物与5个靶点对接结果见表5,亲和能能值越低表示配体与受体结合更好。从各成分的亲和能来看,Stigmasta-4,6,8、vittadinoside_qt、Stigmasterol、poriferasterol monoglucoside_qt、Sitosteryl acetate、 bate-sitosterol的分值较低,可能是影响细胞凋亡的重要成分,从而发挥抗结核作用。从各靶点的亲和能来看,BAX、CASP3和CASP9是这些成分共同发挥作用的重要靶点。另外,Truflex OBP和 Mandenol在对接中分值较高,表明其与TB相关靶点结合较低,可能影响细胞凋亡的作用较弱。
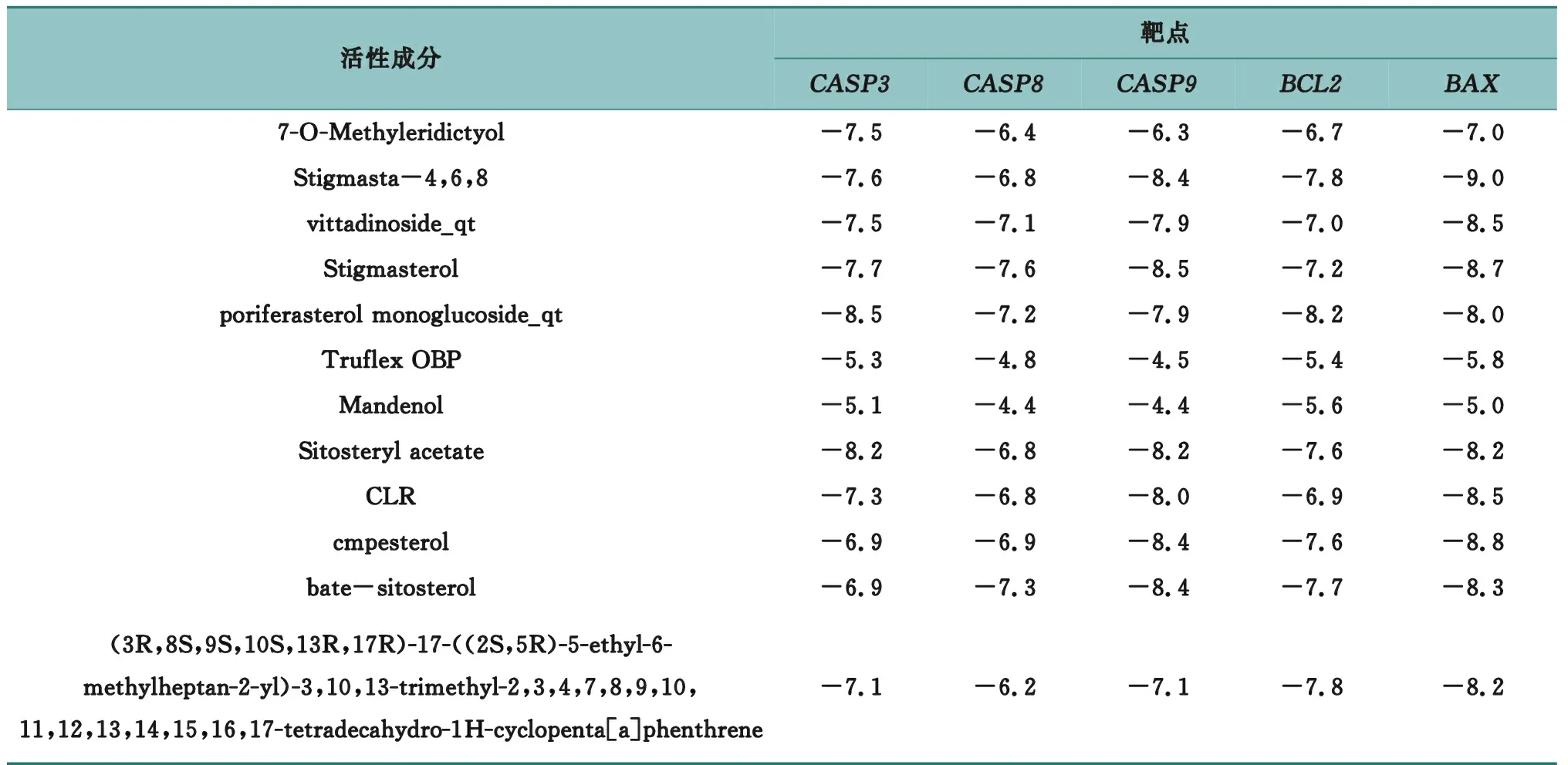
表5 猫爪草活性成分与5个靶点作用情况(亲和能)
选取与每个靶点蛋白亲和力最强的化合物,做出化合物与蛋白结合图,可直观观察活性化合物与靶点的结合模式以及与周围氨基酸残基的相互作用,结果见图6。
受体蛋白BAX与Stigmasta-4,6,8配体小分子之间的结合模式见图6(a),氨基酸残基Leu70、Leu76、Met79、Ile80、Val83、Val91、Arg94、Val95、Asp98、Met99、Phe116、Ala112、Tyr115与Stigmasta-4,6,8配体小分子形成疏水相互作用。
受体蛋白BCL2与poriferasterol monoglucoside_qt配体小分子之间的结合模式见图6(b),氨基酸残基Leu137、Glu136、Arg146与poriferasterol monoglucoside_qt配体小分子形成氢键相互作用,氨基酸残基Arg139、Asp140、Asn143、Ala149、Gly145、Val148、Phe198、Leu201、Tyr202、Ala100、Arg107、Tyr108、Phe104与poriferasterol monoglucoside_qt配体小分子形成疏水相互作用。
受体蛋白CASP3与poriferasterol monoglucoside_qt配体小分子之间的结合模式见图6(c),氨基酸残基Asp211、Asn208、Trp214、Phe250、Glu248与poriferasterol monoglucoside_qt配体小分子形成氢键相互作用,氨基酸残基Ser209、Arg207、Thr62、Cys163、Phe256、Trp206、Ser249与poriferasterol monoglucoside_qt配体小分子形成疏水相互作用。
受体蛋白CASP8与Stigmasterol配体小分子之间的结合模式见图6(d),氨基酸残基Gln358与Stigmasterol配体小分子形成氢键相互作用,氨基酸残基Asp266、Leu270、Thr273、Leu277、Phe274、Ile311、Cys309、Val354、Phe356与Stigmasterol配体小分子形成疏水相互作用。
受体蛋白CASP9与Stigmasterol配体小分子之间的结合模式见图6(e),氨基酸残基Val379、Ser378、Met386、Phe334、Phe337、Asp291、Gly293、Phe294、Lys384、Val296、Ser298与Stigmasterol配体小分子形成疏水相互作用。

注:粉红色分子为配体化合物(活性化合物)图6 猫爪草成分-靶点分子对接Fig.6 Molecular docking between components of Ranunculi Ternati Radix and the targets
3 讨论
本研究运用网络药理学的方法初步探讨了猫爪草治疗TB的作用机制,筛选其活性成分、作用靶点及相关生物学通路。猫爪草活性成分Stigmasta-4,6,8、vittadinoside_qt、Stigmasterol、poriferasterol monoglucoside_qt、Sitosteryl acetate、bate-sitosterol等可能通过TB、凋亡、p53信号通路等相关信号通路作用于CASP3、CASP8、CASP9、BAX、BCL2等靶点而起到抗结核作用。TB是一种严重的慢性传染病,主要由结核分枝杆菌(mycobacterium tuberculosis,MTB)感染引起[16]。当结核分枝杆菌感染机体时就是巨噬细胞杀菌和MTB逃逸的斗争过程[17-18]。巨噬细胞发生凋亡后可杀死MTB,阻止MTB在体内增殖,但MTB也可通过一系列机制有效阻断巨噬细胞的凋亡,以逃逸巨噬细胞的杀伤而在体内长期存活。因此,巨噬细胞的凋亡在抗MTB的过程中发挥着关键作用,抑制巨噬细胞的凋亡是MTB逃逸的重要途径[19]。目前研究表明,MTB影响巨噬细胞凋亡的途径有Caspase酶系列途径、BCL2途径、NF-κB途径等,主要与CASP3、CASP8、CASP9、BAX、BCL2等相关。王健宏等[20]研究结果表明,MTB的重要毒力因子ESAT6可激活Caspase通路中的CASP1、CASP3、CASP5、CASP7、CASP8,从而诱导巨噬细胞的凋亡,这个过程往往与MTB的毒力密切相关。BCL2是一种具有延长细胞生存时间和抗细胞凋亡的蛋白,当MTB感染巨噬细胞后,可促进RIPK3和BCL2转运至线粒体,抑制CASP8的活化和细胞凋亡,并诱导细胞坏死而让自身存活[21]。Zhang等[22]认为MTB毒力因子Rv3033能通过抑制线粒体凋亡相关蛋白BAX进入线粒体,从而阻止巨噬细胞内线粒体介导的内在凋亡。因此,MTB可通过多条途径对巨噬细胞的凋亡进行调控,以逃逸免疫系统的清除作用。
同时,Fang等[23]的研究表明,猫爪草的提取物可以激活在细胞凋亡执行过程中起至关重要作用的CASP7、CASP8和CASP9。周玲玉[24]的研究结果显示猫爪草活性成分β-谷甾醇可以上调BAX表达和下调BCL2表达而引起细胞的凋亡。结合本研究通过PPI、GO及KEGG分析得到的结果,可初步认为猫爪草活性化合物可能通过调控CASP3、CASP8、CASP9、BAX和BCL2等,从而促进巨噬细胞的凋亡,起到抗结核的作用。在分子对接中,本研究发现Stigmasta-4,6,8、vittadinoside_qt、Stigmasterol、poriferasterol monoglucoside_qt、Sitosteryl acetate、 bate-sitosterol具有较好的亲和力,这些主要成分对应的重要靶点CASP3、CASP9、BAX是细胞凋亡过程的重要环节。由此,推测猫爪草可能作用于细胞凋亡通路发挥抗结核作用。
综上所述,本研究从网络药理学的角度出发,初步阐述了中药猫爪草治疗TB的潜在活性成分、可能作用的靶点及发挥药效的关键信号通路。目前猫爪草治疗TB的作用机制鲜少报道,本研究通过网络药理学和分子对接方法对猫爪草治疗TB的药效机制进行预测,可为深入研究其作用机制和临床应用提供方向与思路。
