肺硬化性肺细胞瘤7 例病理学特征
2021-12-13王志敢周华山
张 娜,王志敢,周华山,王 妍
肺硬化性肺细胞瘤(pulmonary sclerosing pneumocytoma,PSP)是一种少见肺部缓慢生长的良性肿瘤,1%的病例可发生淋巴结转移[1]。由Liebow 和Hubell 于1956 年首先报道[2]。该病好发于亚洲中年女性,无特异性临床表现,术前诊断困难。影像学上与肺腺癌、类癌、错构瘤、炎性假瘤等极为相似,小组织活检易误诊。笔者总结分析7 例PSP 临床病理学特征,以提高对该肿瘤的诊治水平。
1 资料与方法
1.1 一般资料收集2013 年4 月—2019 年4 月长沙市中心医院存档的7 例PSP 的临床病理资料,包括患者年龄、性别、临床表现、组织病理学特征,临床处理及随访。其中男1 例,女6 例;发病年龄27~67 岁,平均51.2 岁;病程2 周至20 年不等。5 例表现为咳嗽、咳痰、胸痛等,2 例CT 检查时偶然发现肺部肿块。位于左上肺3 例,左下肺2 例,右下肺1例,右主支气管1 例。2 例为小组织活检,5 例术后标本送冰冻切片检查,考虑硬化性肺细胞瘤4 例(其中3 例不除外乳头状腺癌),炎性假瘤伴骨化1例。
1.2 方法所有标本均经10%福尔马林固定,常规石蜡包埋、切片,HE 染色及免疫组化SP 法染色。一抗及SP 试剂盒均购自丹麦DAKO 公司。抗体包括TTF1、AE1/AE3、EMA、CEA、NapsinA、Vim、PR、CD56、Syn、CgA、CD34、Ki67 等。肿瘤诊断参照2015 年WHO 肺及胸膜肿瘤分类标准。所有切片均经两位高级职称病理医师分别阅片诊断。
2 结果
2.1 肉眼观察结果分析纤支镜活检及经皮肺穿刺活检各1 例,组织最大径分别0.3 cm、0.9 cm,单纯肿块切除2 例,余3 例分别行肿瘤及肺叶切除、楔形肺切除+淋巴结清扫,肿瘤最大径1.5~6.0 cm,其表面光滑,切面呈灰白、红褐色,多彩状。
2.2 镜检结果分析低倍镜下肿瘤与肺分界清楚(图1),但无包膜。有乳头状区、实性区、血管瘤样及硬化区四种组织结构、两型细胞及多种间质改变(图2-4)。7 例PSP 中2 例有乳头状及实性区两种结构,1 例有实性区及血管瘤样区,4 例有上述四种结构。两型细胞:表面立方状细胞和圆形、多角形间质细胞。前者衬覆于裂隙或乳头表面,胞质嗜酸性,胞核小而深染,核仁不明显,3 例表面上皮细胞具有非典型性,胞核深染退变样,见核内假包涵体及多核瘤细胞(图5)。间质细胞圆形、多角形、短梭形(图6),胞质嗜伊红颗粒状,呈实性片状或在裂隙及乳头间质中随意分布,偶呈条索状。可见透明间质细胞单个散在或小簇分布。瘤细胞核分裂象难觅。间质改变包括出血或含铁血黄素沉积6 例,肥大细胞浸润7 例,淋巴细胞浆细胞浸润5 例,泡沫状细胞积聚4 例,广泛及局灶钙化各1 例,血管壁玻璃样变、胆固醇裂隙形成各2 例。

图1 肿瘤与肺分界清楚(HE 染色,×200 倍)

图2 左侧为肿瘤硬化区,右侧为乳头状区(HE 染色,×100 倍)

图3 血管瘤样区(HE 染色,×100 倍)
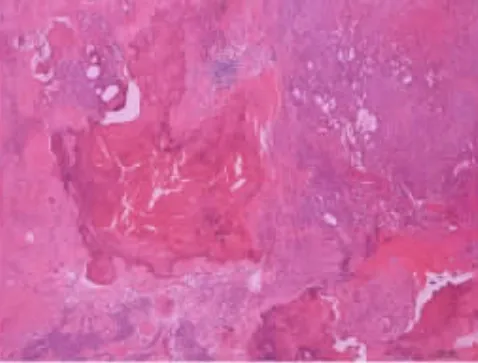
图4 肿瘤间质广泛钙化(HE 染色,×100 倍)
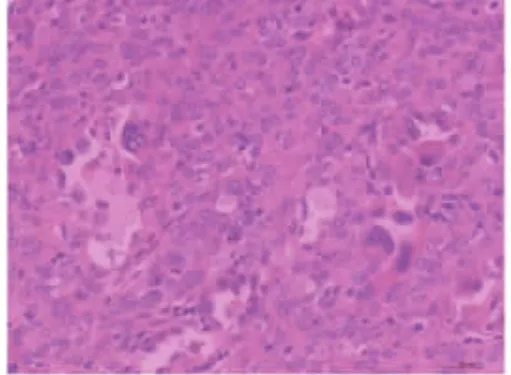
图5 裂隙表面上皮细胞有非典型性,可见核内假包涵体(HE 染色,×400 倍)
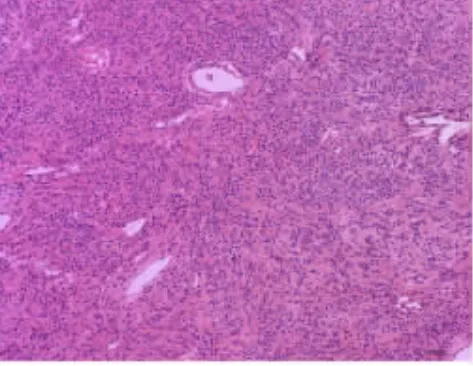
图6 实性区肿瘤细胞圆形或短梭形(HE 染色,×200 倍)
2.3 免疫组化分析肿瘤性表面立方状上皮细胞TTF1、AE1/AE3、EMA 弥漫阳性,CK7,SP-A 多为阳性,且vim、CEA 阴性;间质细胞TTF1、Vim 阳性(图7),EMA、AE1/AE3 阴性或局灶阳性,1 例Syn 阳性,PR 阳性(4/4 例,图8)。两型细胞CD34、SMA、DES、S100、CgA 均阴性,Ki-67 增殖指数均<5%。肿瘤内散布CD117 阳性肥大细胞(7/7)。
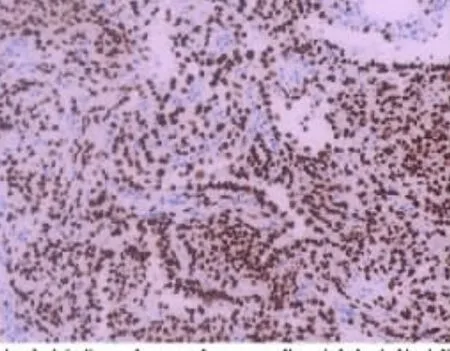
图7 免疫组化SP 法DAB 显色(×200 倍)
2.4 病理诊断7 例均为肺硬化性肺细胞瘤(PSP)。3 例行局部淋巴结清扫,均未发现肿瘤转移。
2.5 随访电话联系获得随访,随访时间2 周至20 年,肿瘤无复发或转移。
3 讨论
3.1 临床特征PSP 是一种少见的肺实质良性肿瘤。以往被认为是炎性假瘤的一种亚型,称为“硬化性血管瘤”。2015 年WHO 肺和胸膜肿瘤分类更名为硬化性肺细胞瘤[2]。患者无特异性症状,部分肿瘤是在胸部照片时偶然被发现的。朱军报道的187 例PSP:肿瘤多发于40~70 岁(80.8%)女性非吸烟者,男女之比约1∶7.5[3]。年龄最小15 岁,70 岁以上仅有7 例(3.7%)。单发多见,偶可多发,左下叶者占32.6%。PSP 女性高发可能与ER、PR 阳性率高及细胞核中黄体脂酮受体表达增高有关[4]。胸部CT 检查多表现古钱币样类圆形肿块,界清、内部密度均一。其周围无卫星病灶,少见分叶征及毛刺。增强后有明显强化,偶见钙化及囊性变。入组病例发病年龄27~67 岁,平均51.2 岁,男女之比为1∶6,与上述文献类同。
3.2 组织病理学特征肉眼观察肿瘤与肺分界清楚,但无包膜,易剥离。切面灰白色、红褐色,质地软韧不一,实性或海绵状。组织学上具有特征性的“两型细胞、四种结构”[5,6]。两型细胞中表面立方细胞类细支气管上皮和Ⅱ型肺泡上皮细胞,出现非典型性时,易误诊为腺癌细胞。多角形间质细胞体积小,边界清,核居中,圆形或卵圆形,染色质细腻,核仁不明显,胞质嗜酸性或透明。两型细胞核分裂象均不易见。四种结构为海绵状血管瘤样区、乳头区、实性区及玻变硬化区。该组7 例均见两型细胞及四种结构中的2~4 种,低核分裂率。其中3 例术中快速切片因出现细胞非典型性疑为乳头状腺癌,后经常规石蜡切片及免疫标记证实为PSP。PSP 间质改变常见出血或含铁血黄素沉积,肥大细胞、淋巴浆细胞、泡沫细胞浸润,可伴间质钙化及胆固醇裂隙形成。
3.3 免疫组化分析 两型细胞均弥漫阳性表达TTF1、EMA[5,6]。表面立方状细胞AE1/AE3 阳性,vim阴性,而间质细胞表达正好相反,AE1/AE3 阴性,vim 阳性。少数病例间质细胞表达CK7 和CAM5.2。间质细胞ER、PR 常为阳性,可表达神经内分泌标记syn、CgA、NSE。7 例两型瘤细胞表达模式与上述文献类似,肿瘤性间质细胞PR 中等至强阳性(4/4例),且散在CD117 阳性肥大细胞浸润(7/7 例)。提示肿瘤间质细胞表达PR 及肥大细胞浸润是该肿瘤的特征。
3.4 细胞起源及分子病理学变化PSP 细胞起源尚存争议。最初有内皮、间皮、肺泡上皮及神经内分泌细胞起源等假说。随着电镜、免疫组化和分子生物学的深入研究,认为肿瘤起源于多潜能原始呼吸上皮细胞[7]。两型细胞是否均为肿瘤成分有两派意见:部分学者认为,多角形间质细胞为肿瘤实质细胞,而表面立方状细胞是包裹陷入的上皮或反应性成分[7,8]。克隆性分析[8,9]及全外显子测序[10,11]发现两型细胞均为肿瘤成分,它们仅有组织学形态不同,基因水平上无异,并发现AKT1 及β-Catenin 基因突变促进PSP 的发生,笔者更支持后一种观点。
3.5 鉴别诊断PSP 与肺部多种肿瘤及瘤样病变在临床表现,影像学改变上有交叉。鉴别诊断如下:(1)肺腺癌。CT 显示肺癌有分叶、毛刺或卫星结节,常有纵隔肺门淋巴结肿大。光镜下癌组织呈浸润性生长,肿瘤性乳头或腺腔衬覆显著异型腺上皮,有胞质黏液空泡,核仁大,核分裂象多,有癌性纤维间质。癌细胞表达NapsinA、CEA 等上皮标记,而缺乏vim、PR 阳性间质细胞。PSP 影像学为肺部类圆形阴影,边缘光滑无毛刺,多无肺门纵隔淋巴结肿大。肿瘤表面光滑,呈膨胀式生长,有两型肿瘤细胞,间质细胞表达TTF1、vim、PR 等可以鉴别。(2)高分化NET/类癌。瘤细胞排列呈梁状、缎带样,器官样或菊形团样,核染色质椒盐样,富于薄壁毛细血管。瘤细胞共表达上皮和神经内分泌标记。PSP 具有四种结构,独特的Vim、PR 阳性间质细胞,缺乏窦样血管。(3)海绵状血管瘤。血管腔隙内衬CD34 阳性内皮细胞,间质为纤维结缔组织。PSP 中血管瘤样区为假血管腔,内壁被覆立方状上皮。(4)孤立性纤维性肿瘤。包膜完整,肿瘤多位于胸膜或肺叶间裂,有血管外皮瘤样结构及粗大杂乱胶原纤维,卵圆形、短梭形瘤细胞表达CD34,且TTF1 阴性。(5)软骨样错构瘤。中央型多见,主要成分为软骨岛,有脂肪及纤维组织分隔,可伴有纤毛上皮衬覆的不规则间隙,软骨成分可钙化或骨化。PSP 伴有软骨及骨化生时易误诊为错构瘤,但其多为肺外周型肿块,裂隙表面为立方状上皮细胞而非纤毛上皮,并富于多角形间质细胞可区分。(6)炎性假瘤。本质是炎性肉芽肿和慢性纤维化,多为局限性瘤样肿块。镜检有多种炎性细胞浸润和成纤维细胞、血管增生。与PSP 的肿瘤性本质不同。
3.6 治疗及预后PSP 是一种良性/惰性肿瘤,偶可发生胸膜侵犯[12]及淋巴结转移,具有恶性潜能。Xu 等总结了18 例发生淋巴结转移的PSP[5]:肿瘤最大径多>5 cm,年轻男性左下叶多见,常伴有肺门、纵隔或锁骨上淋巴结肿大。多发性PSP 是多中心发生还是原发瘤转移尚不清楚。有学者指出多结节性PSP,若肿瘤细胞存在两种不同AKT1 突变,提示其多结节性可能非转移所致[10]。复习文献,PSP 支气管内发生或呈多灶性,最大径>10 cm 或出现密集梭形间质细胞者更易出现肿瘤大范围坏死、血管侵犯及淋巴结转移[5,13-15]。预示其更具有侵袭性。该组7 例肿瘤细胞ki-67 增殖指数均在5%以下,随访均无肿瘤复发或转移。术后发现例1 肿瘤最大径6 cm,间质广泛钙化、骨化,例4 最大径4 cm,病程长达20 年。其中3 例行淋巴结清扫(共11 枚),均未发现肿瘤转移,也支持PSP 惰性的生物学行为。
治疗上,推荐包括肿瘤在内的楔形肺/肺叶切除。即便有淋巴结转移,将肿瘤切净即可,不必大范围手术及淋巴结清扫,未能手术者可选择放疗[6]。AKT1 抑制剂有望成为PSP 潜在治疗靶向药物。
PSP 是一种少见的原发于肺的良性肿瘤,少数具有局部侵袭性或发生淋巴结转移。在临床表现及影像学上易误诊。当影像学发现肺外周带不明原因类圆形肿块时,建议及时手术,行快速冰冻切片及常规病理检查确诊,使患者最大程度受益,避免过度治疗。确诊为PSP 者,要长期随访,特别是具有转移高危因素者。
