血清淀粉样蛋白A 与淀粉酶及脂肪酶对急性胰腺炎的诊断和预后价值
2021-12-13朱成斌蔡春莲
朱成斌,蔡春莲
急性胰腺炎(acute pancreatitis,AP)是指由于多种病因引起胰酶激活,以胰腺局部炎性反应为主要特征,伴或不伴其他器官功能改变的疾病[1]。AP患者血淀粉酶(AMY)、脂肪酶(LPS)均有不同程度的升高,是诊断AP 重要生化指标,研究两者对AP诊断价值的报道较多[2]。Sebastian M Staubli 等[3]研究证实炎性因子在机体中的过量产生与急性胰腺炎的病理演变过程密切相关,是急性胰腺炎的重要发病原因。以往研究主要集中于不同疾病程度AP患者炎症因子水平差异[4],该研究分析了血清淀粉样蛋白A(SAA)、AMY、LPS 对AP 诊断和预后的预测价值,研究结果如下。
1 资料与方法
1.1 一般资料选取2016 年10 月—2020 年8 月来笔者医院就诊的AP 患者64 例作为研究对象。其中男38 例,女26 例;年龄(36.75±6.27)岁;BMI 19.34±1.12。64 例AP 患者中MAP 23 例,SAP 41例。AP 诊断标准:根据中华医学会消化病学分会胰腺疾病学组颁布的 《中国急性胰腺炎诊治指南》(2019 年,沈阳)[5]须符合下列3 项指标中的2 项:(1)上腹部持续疼痛(疼痛发病急、较重,并常常向后背部放射);(2)血清淀粉酶或脂肪酶至少高于3倍正常值上限;(3)CT 显示有特征性急性胰腺炎表现。患者在入院后进行APACHEⅡ评分,APACHEⅡ评分<8 分为轻症急性胰腺炎(MAP),≥8 分为重症急性胰腺炎(SAP)。排除标准:临床资料不全,生化指标检测前经过相关治疗的患者,诊断为慢性胰腺炎、慢性胰腺炎急性发作、胰腺肿瘤患者。伴其他感染性、免疫系统疾病、恶性肿瘤和慢性器官功能不全者。另选取在该院治疗的非AP 急腹症患者25例作为非AP 组,健康体检人群37 例作为对照组,各组间年龄、性别、BMI 差异均无统计学意义。
1.2 仪器与试剂仪器:SAA、AMY、LPS 的检测由贝克曼AU5800 全自动生化分析仪完成。试剂:SAA的检测由浙江夸克生物科技有限公司试剂盒完成检测,AMY、LPS 的检测由中山标佳生物科技有限公司试剂完成。
1.3 方法AP、非AP 患者入院后24 h 内抽取血液3~5 ml,3000 r/min 离心5 min,检测SAA、AMY、LPS。SAA 的检测采用胶乳增强免疫比浊法,AMY、LPS 的检测采用速率,比较不同组别间SAA、AMY、LPS 差异,根据患者临床资料将所有AP 分为MAP、SAP,比较2 组间检测指标差异,分析SAA、AMY、LPS 与APACHE Ⅱ评分相关性,并判断AMY、LPS对AP 的诊断价值,根据AP 患者预后情况分为预后良好组和预后不良组,分析SAA、AMY、LPS 对AP 预后的预测价值。
1.4 统计学分析采用SPSS 20.0 软件建立数据库进行统计分析,正态分布计数资料用()表示,多组样本间的比较采用方差分析,率的比较采用四格表卡方检验,相关性分析采用Pearson 相关性分析,通过受试者工作曲线(ROC)评价检测指标对AP 的诊断价值和预后价值,根据约登指数(约登指数=敏感度+特异性-1)最大时各检测指标数值作为最佳截断值,P<0.05 为差异具有统计学意义。
2 结果
2.1 不同组别临床资料比较AP 组、健康对照组、非AP 组之间性别构成、年龄、BMI 差异均无统计学意义(F=0.223~1.365,均P>0.05),MAP 组、SAP 组、健康对照组、非AP 组之间性别构成、年龄、BMI 差异均无统计学意义(F=0.482~2.351,均P>0.05),说明各组间基线齐,具有可比性。见表1。
表1 不同组别间临床资料比较()
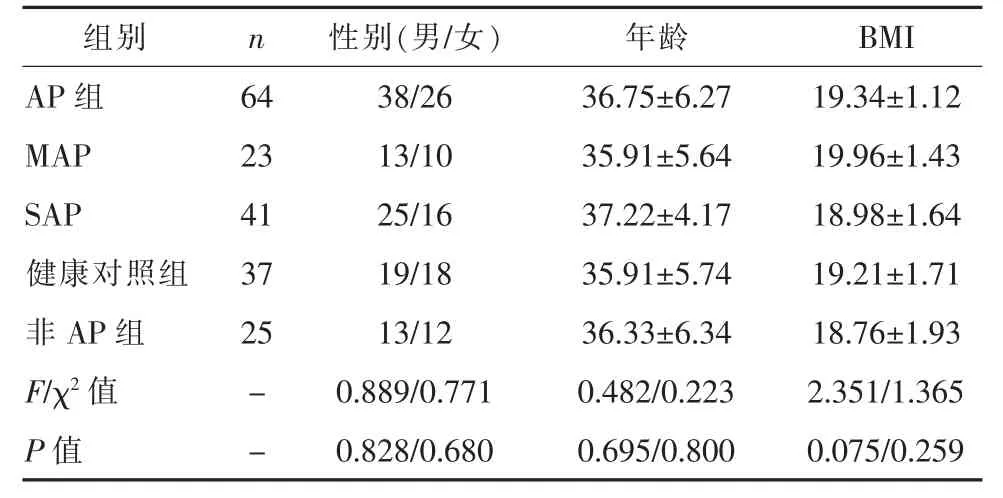
表1 不同组别间临床资料比较()
2.2 不同组别检测指标差异比较其中MAP 组、SAP 组间AMY、LPS 差异均无统计 学意义,AP 组AMY、LPS 均高于健康对照组和非AP 组,差异均有统计学意义,健康对照组、非AP 组间AMY、LPS 差异均无统计学意义,AP 组、非AP 组SAA 均高于健康对照组,差异均有统计学意义,但AP 组和非AP组间SAA 差异无统计学意义。见表2。
表2 不同组别检测指标差异比较()

表2 不同组别检测指标差异比较()
2.3 不同检测指标与APACHEⅡ评分相关性分析SAA 与APACHE Ⅱ评分呈正相关(r=0.411,P=0.000),随着SAA 浓度的升高,AP 患者为SAP 的概率增大,AMY、LPS 与APACHEⅡ评分无明显相关性(r=0.101~0.115,均P>0.05)。见表3。
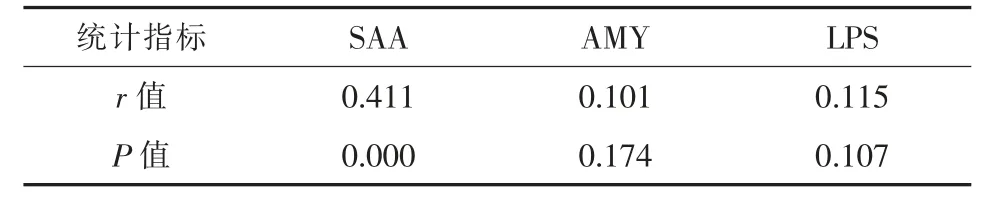
表3 不同检测指标与APACHEⅡ评分相关性分析
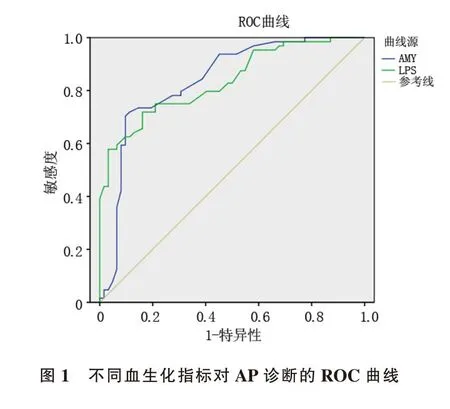
2.4 不同检测指标对AP 诊断ROC 曲线分析因SAA 特异性差,对AP 的诊断评估无临床意义,故未纳入ROC 曲线分析中。AMY 预测AP 的AUC 为0.838(0.765~0.910),最佳临界值为479.00(U/L),敏感度为71.88%,特异性为88.71%;LPS 预测AP 的AUC 为0.836(0.767~0.904),最佳临界值为627.00(U/L),敏感度为71.88%,特异性为83.87%。见图1、表4。

表4 不同检测指标对AP 预测的价值
图1 见封三。
2.5 不同检测指标对AP 预后ROC 曲线分析AMY预测AP 预后不良的AUC 为0.624(0.494~0.792),最佳临界值为821.00(U/L),敏感度为72.72%,特异性为59.52%;SAA 预测AP 预后不良的AUC 为0.739(0.588~0.891),最佳临界值为492.00(mg/L),敏感度为72.72%,特异性为85.71%;LPS 预测AP预后不良的AUC 为0.672(0.526~0.818),最佳临界值为1698.00(U/L),敏感度为81.80%,特异性为61.91%,AUCSAA>AUCAMY、AUCLPS,差异均有统计学意义(P<0.05),见图2、表5。

表5 不同检测指标对AP 预后的预测价值
图2 见封三。

3 讨论
AP 具有起病急、进展快等临床特点,是一种典型的以急性腹痛和胰腺酶学紊乱为主要特征的炎症性疾病,该病发病机制尚未明确,主要包含胰酶自身消化学说、炎症因子学说、钙超载、细胞凋亡学说和肠道细菌易位学说[6]。AP 临床症状及并发症较重,可出现全身炎症反应和多器官功能障碍综合征,临床治疗效果较差。Dambrauskas 等[7]研究报道,AP 病死率为10%~15%,SAP 中病死率高达30%~40%,因此研究AP 诊断和预后结局预测敏感指标对降低病死率有重要临床意义。
该研究表明,AP 组AMY、LPS 均高于健康对照组和非AP 组,差异均有统计学意义,健康对照组、非AP 组间AMY、LPS 差异均无统计学意义,与以往研究相符[8],说明AMY、LPS 均为AP 患者特异性指标。SAA 主要是由肝细胞合成后分泌到血液中的一种急性时相反应蛋白,当遇感染、创伤、肿瘤浸润等因素时可明显增高,并随着炎症的控制而持续下降,慢性炎症时,这些指标可持续升高[9]。AP 组、非AP 组SAA 均高于健康对照组,差异均有统计学意义,但AP 组和非AP 组间SAA 差异无统计学意义。目前临床上对AP 严重程度的早期评估方法主要有评分系统、血清标志物和临床表现等,血清标志物包括C 反应蛋白(CRP)、降钙素原(PCT)、血钙、血肌酐、尿素氮、白蛋白等[10]。叶林等[11]研究表明,中性粒-淋巴细胞比率(NLR)、PCT、SAA 均与APACHEⅡ评分呈正相关。该研究表明SAA 与APACHEⅡ评分r 值为0.411,感染指标越高,为SAP 可能性越大。AMY、LPS 与APACHEⅡ评分无明显相关,说明其不能反映AP 严重程度。AMY、LPS 均由胰腺分泌,AMY 异常增高发生于AP 后6~12 h,3 d 后浓度迅速降低,因此适合于AP 早期诊断。正常情况下LPS 进入肠道分解甘油三酯,因而在血液中含量很低,AP 时由于胰腺细胞坏死,通透性增高,AP 发生后1~3 d LPS 浓度增高,增高持续时间较长[12]。如何实现AP 患者预后不良事件早期预警,有效提高AP 患者整体生存率,一直受到高度关注。SAA 预测AP 预后不良的AUC 为0.739(0.588~0.891),AMY预测AP 预后不良的AUC 为0.624(0.494~0.792),LPS 预测AP 预后不良的AUC 为0.672(0.526~0.818),AUCSAA>AUCAMY、AUCLPS,差异有统计学意义,说明SAA 预测AP 预后不良优于AMY、LPS,与王珍珍等[13]研究结果有部分相符。该研究因纳入的AP 患者例数较少,可能影响统计结果,且未讨论其他炎症指标对AP 疾病严重程度的预测价值,以上不足之处有待后续扩大研究对象后予以分析。
综上所述,AMY、LPS 对AP 的诊断有较高预测价值,AMY 与APACHE Ⅱ评分呈明显正相关,AMY、LPS 与APACHEⅡ评分无明显相关,SAA 对AP 预后预测价值优于AMY、LPS,对于AP 确诊患者,检测SAA 可以预测疾病严重程度和不良预后,对SAA>492.00 mg/L 的AP 患者,可提示临床及时采取对症措施,降低不良预后发生率。
