苦瓜枯萎病病原的鉴定与防治药剂筛选
2021-12-13张景云万新建黄长林
关 峰,张景云,石 博,万新建,黄长林
(江西省农业科学院 蔬菜花卉研究所,江西 南昌 330200)
苦瓜(MomordicacharantiaL.)为葫芦科苦瓜属(Momordica)蔓性植物,起源于热带亚热带地区,广泛分布于南美亚马逊地区、非洲、亚洲等地[1]。苦瓜因碧玉剔透、口感爽脆且营养丰富而深受大众的喜爱。但苦瓜连作导致种植土壤环境恶化,连作障碍日益严重,土传病害发生随之加重。苦瓜枯萎病是由尖孢镰刀菌苦瓜专化型(FusariumoxysporumSchl.f.sp.momordicae)引起的一种典型的真菌土传病害[2],在中国各苦瓜种植区均有发生,可造成苦瓜干枯萎蔫,最后导致全株死亡[3]。江西乐平作为苦瓜生产的重要基地,近几年来苦瓜种植面积逐年扩大,但该市位于长江以南,其雨水较多、高温高湿的气候条件适于苦瓜枯萎病的发生和流行,导致部分种植大户年损失在10万元以上。在苦瓜生产上,枯萎病一般发病率为15%~25%,在连作障碍严重的地块发病率可达60%,当此病流行时田间出现大量的枯黄死株,最终导致苦瓜的产量降低,从而造成严重的经济损失[4]。
迄今为止,尚未发现对苦瓜枯萎病免疫的苦瓜品种。采用化学药剂仍然是防治苦瓜枯萎病最有效的手段[5]。目前,在苦瓜生产上主要使用的化学药剂有异菌脲、甲基硫菌灵、噁霉灵、五氯硝基苯、多菌灵、百菌清、戊唑醇等。由于苦瓜枯萎病菌生长快、适宜度高,连续使用同一种化学药剂极易使该病菌对农药产生抗药性[6、7]。苦瓜枯萎病的病原菌鉴定对抗性品种筛选与创制、药剂防治及生物防治策略的制定等多方面均有重要价值。为了进一步探明乐平市苦瓜枯萎病的病原菌以及化学药剂对其的抑制作用,本研究从江西省乐平市苦瓜主产区采集苦瓜枯萎病病株样本,对其致病菌进行了分离、纯化、鉴定、致病力检测及ITS序列分析,并针对生产上常用的7种化学药剂开展了筛选试验,以期为制定苦瓜枯萎病防控新策略,以及指导苦瓜生产提供理论依据。
1 材料与方法
1.1 试验材料
分别于2017、2018、2019年从江西省乐平市袁绿种养专业合作社苦瓜种植大棚内共采集发病植株72株,用报纸包裹后及时带回实验室。
1.2 供试杀菌剂及来源
供试杀菌剂的名称及来源详见表1。
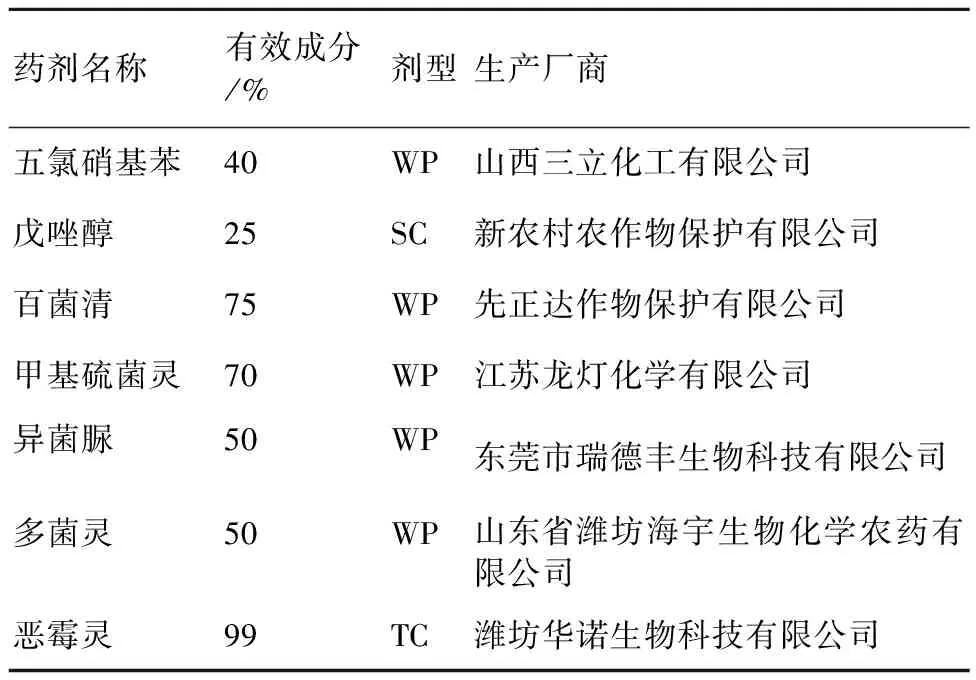
表1 供试杀菌剂的名称及来源
1.3 病原菌的分离、鉴定
取苦瓜发病植株的茎基部,清洗去泥,切去两端,先用0.1%升汞消毒30 s,再用75%酒精消毒30 s,共进行3次;随后用无菌水洗涤3~4次,再用灭菌滤纸吸干植株茎基部组织表面的水分,最后将其置于马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基上在28 ℃条件下培养;待长出菌丝后,挑取部分菌饼接种在PDA平板上;经3次纯化后,采用稀释法进行单孢分离和培养,在显微镜条件下进行形态特征描述。将致病菌再次回接于苦瓜幼苗,对发病苦瓜幼苗进行病原物的再分离,与原接种菌株比较,进行Koch’s法则验证。
1.4 致病菌的rDNA-ITS序列分析
采用CTAB法[8]进行菌体基因组DNA的提取。用真菌rDNA的通用引物ITS1和ITS4进行PCR扩增。采用MEGA version 4.0进行系统发育分析;采用邻位相连法(neighbor-joining, NJ)进行进化距离分析;系统树的检验用Bootstrap 1000次重复。将菌株的rDNA-ITS序列在GenBank核酸数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行BLASTN比对。
1.5 致病性测定
取在培养基上生长旺盛的枯萎病菌菌饼边缘,接种于液体培养基中,并置于26 ℃恒温摇床内震荡培养3~5 d。待菌丝长出后,用双层纱布过滤,去掉菌丝。用血球计数器计算病菌孢子的浓度并调至1×106cfu/L。采用浸移法进行苦瓜枯萎病菌的回接试验;对照组采用无菌水进行处理;待枯萎病发生后,再次从发病幼苗的茎基部分离病原菌,观察分离菌株与原接种菌株在形态上的差别。
1.6 室内毒力试验
采用生长速率抑制法[9,10],将供试的7种化学药剂各配制成一定质量浓度的母液,再根据各药剂说明书推荐的浓度设置中间浓度,配制成系列质量浓度的各种药液:40%五氯硝基苯、50%异菌脲、50%多菌灵(120、60、30、15、7.5 mg/L);25%戊唑醇(200、100、50、25、12.5 mg/L);75%百菌清、70%甲基硫菌灵(116、58、29、14.5、7.25 mg/L);99%噁霉灵(12、6、3、1.5、0.75 mg/L)。最后制作含有不同质量浓度各种药液的培养基平板。每个处理3次重复。在接种后,将培养皿置于28 ℃培养箱中培养7 d,然后采用十字交叉法测量各化学药剂浓度处理的菌落直径,计算各化学药剂浓度处理对菌丝生长的抑制率。取浓度的对数值,将生长抑制率转换成几率值,建立毒力回归方程,并计算各化学药剂的有效抑制中浓度(EC50)和相关系数。抑制率(%)的计算公式为:抑制率=[(对照组菌落直径-菌饼直径)-(处理组菌落直径-菌饼直径)]/(对照组菌落直径-菌饼直径)×100。
1.7 数据统计与分析
采用Microsoft Excel 2017和DPS 7.05软件对试验数据进行统计分析。
2 结果与分析
2.1 苦瓜枯萎病菌的鉴定结果
对采集的病样进行分离纯化,得到5个菌株(编号LP1、LP3、LP4、LP8、LP10)。用肉眼观察这些菌株的菌落和形态学特征,没有发现明显差异;菌丝浓密絮状,呈地毯状平铺,菌落圆形,白色或淡紫色(图1)。在显微镜下,其分生孢子呈镰刀状,3~5隔。依据Booth’s镰刀菌分类鉴定标准初步鉴定这些菌株为尖孢镰刀菌。选择代表性菌株LP1进行Koch’s准则的验证。根据测序结果,将序列在GenBank数据库中进行同源序列搜索。根据真菌的分子分类原则[11],发现其与尖孢镰刀菌(Fusariumoxysporum)序列的相似度较高,同源性达到99%(图2),因此初步鉴定从苦瓜病株中分离出的病原菌均为尖孢镰刀菌(F.oxysporum)。
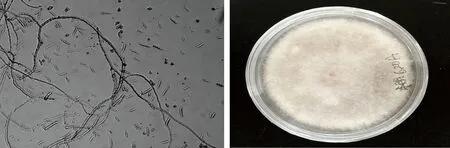
图1 江西省乐平市苦瓜枯萎病菌的形态特征
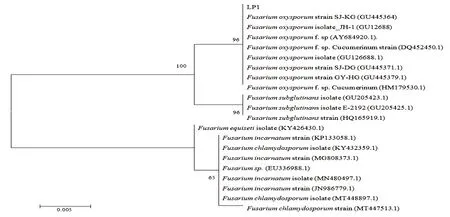
图2 LP1菌株的系统发育树
2.2 致病性鉴定
将本试验分离的病原菌采用伤根法接种无病苦瓜幼苗,苦瓜幼苗于接种后7 d开始出现子叶萎蔫下垂或叶脉黄化等症状,11 d后幼苗叶片发黄、卷曲、变脆,植株逐渐枯萎,15 d后基部无新增发病植株。在乐平的潮湿天气下,后期常能看到苦瓜藤蔓茎基部出现红褐色纵裂,切开病株茎基部可发现其维管束变成褐色(图B1、图B2)。对照苦瓜植株无发病症状,生长发育正常(图A1、图A2)。
从表2可以看出:在接种后,菌株LP1、LP3、LP4的致病性较强;菌株LP9和LP10的致病性较弱。
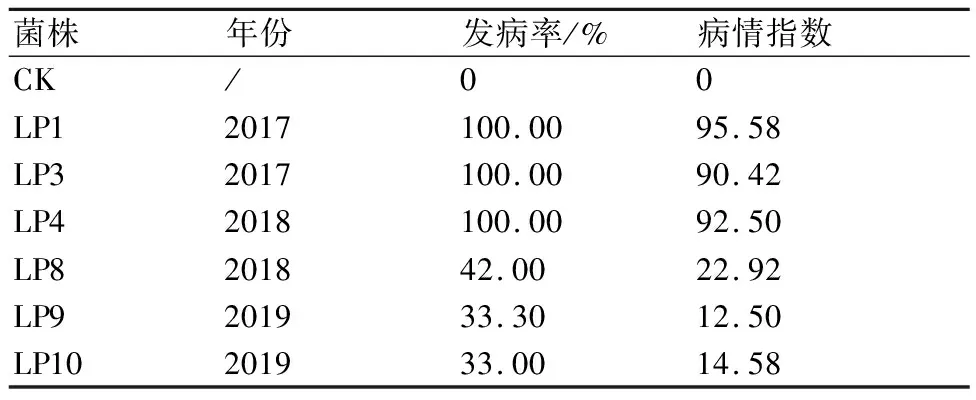
表2 不同菌株接种后苦瓜的发病结果统计
2.3 不同杀菌剂对枯萎病菌菌丝生长的影响
不同杀菌剂对苦瓜枯萎病菌的抑菌作用测定结果(表3)表明,7种杀菌剂对尖孢镰刀菌苦瓜专化型的抑制效果差异明显,在一定的质量浓度范围内,随着质量浓度的增加,药剂的抑菌效果呈现明显增强的趋势,除50%异菌脲外,其余6种杀菌剂在最高浓度下的抑制率均达到了50%。
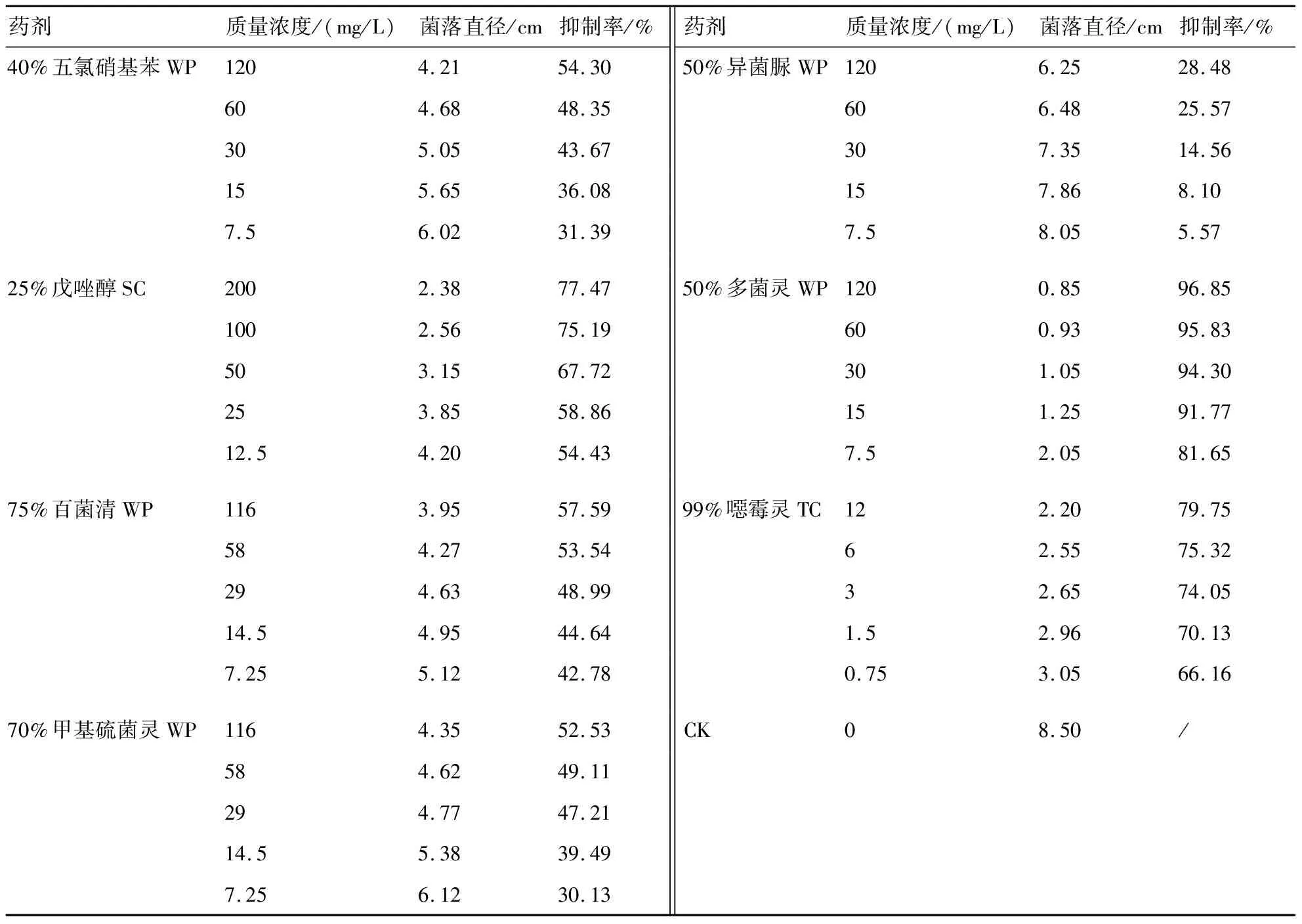
表3 7种杀菌剂对苦瓜枯萎病菌菌丝生长的抑制作用
由表4可见:99%噁霉灵对苦瓜枯萎病菌菌丝生长的抑制活性最强,有效抑制中浓度EC50值为0.0352 mg/L;50%多菌灵和25%戊唑醇次之, EC50值分别为0.3037和8.2324 mg/L;75%百菌清、70%甲基硫菌灵、40%五氯硝基苯的EC50值分别为31.3541、64.5849、71.0890 mg/L;50%异菌脲的抑菌效果最差, EC50值为419.0041 mg/L。
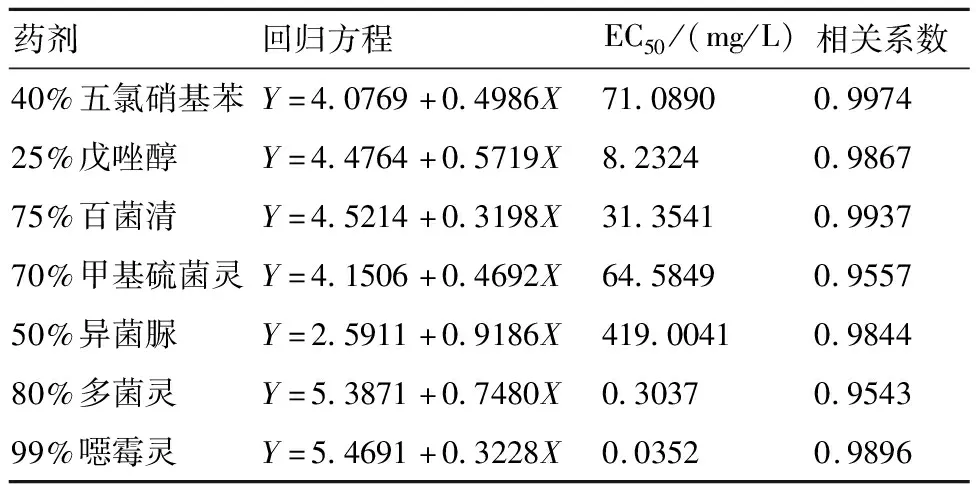
表4 7种药剂对苦瓜枯萎病菌的室内毒力测定结果

A:健康的苦瓜植株和叶片(对照)。B:感病的苦瓜植株和叶片。
3 结论与讨论
枯萎病是严重影响苦瓜产量和品质的一种较难防控的土传病害,近几年苦瓜种植户深受其害,尤其是在多年种植苦瓜的老菜地。乐平市苦瓜种植面积已有660 hm2以上,是当地重要的经济蔬菜品种,苦瓜枯萎病已严重影响到蔬菜种植大户的经济效益。因此,确定苦瓜枯萎病的致病菌种类,对症下药筛选防治药剂对田间防治苦瓜枯萎病具有重要意义。根据乐平市苦瓜病样的组织分离结果,结合rDNA-ITS序列分析,对苦瓜枯萎病的病原菌进行形态学和分子生物学鉴定,结果表明,本研究所分离的病原菌为尖孢镰刀菌苦瓜专化型(FusariumoxysporumSchl.f.sp.momordicae)。
在苦瓜生产中,由于不了解致病菌和杀菌剂的特性,种植户往往盲目用药,造成大量浪费且防治效果降低,并且影响生态环境[12]。因此,需开展苦瓜病害的合理防治研究。本文采用菌丝生长速率法,筛选市场上常见且低毒的7种化学农药对苦瓜枯萎病致病菌进行室内毒力测定,其中99%噁霉灵具有显著的抑制作用,其EC50值为0.0352 mg/L,因此该杀菌剂是田间防治苦瓜枯萎病的较为理想的农药。噁霉灵属于内吸性杀菌剂,可用于土壤杀菌与种子消毒,可以促进作物生长[13]。50%多菌灵也具有较好的抑菌作用。在苦瓜生产上建议多种农药交替使用,避免产生抗药性。
