锌指同源框3基因多态性与不同亚型缺血性卒中结局的特异性关联研究
2021-12-13程丝许喆左颖婷刘阳王安心石延枫李昊王拥军
程丝,许喆,左颖婷,刘阳,王安心,石延枫,李昊,王拥军
研究遗传因素对卒中结局的影响,对于了解疾病发生进展及探索潜在的卒中治疗靶点至关重要[1]。多项研究表明,锌指同源框3(zinc finger homeobox 3,ZFHX3)基因单核苷酸变异(single nucleotide variant,SNV)的3个位点(rs7193343[2-3]、rs879324[4]和rs12932445[5])不同基因型与心源性栓塞型(cardioembolic,CE)卒中的发生风险有关,也有研究表明rs7193343基因型与心房颤动有关[6-7]。但是,ZFHX3基因是否参与了卒中的发生发展,以及其遗传变异是否与卒中预后存在关联尚无研究报道。因此,本研究针对来自中国国家卒中登记研究Ⅲ(third China national stroke registry,CNSR-Ⅲ)[8]中首次发生缺血性卒中或TIA的患者,分析ZFHX3基因上3个变异位点与卒中预后及相关危险因素之间的关系。
1 对象与方法
1.1 研究对象 CNSR-Ⅲ是全国多中心的前瞻性登记研究[8],自2015年8月-2018年3月连续纳入15 166例急性缺血性卒中(14 146例)或TIA(1020例)患者(入组标准:年龄≥18岁;缺血性卒中或者TIA患者;发病至入组时间≤7 d),研究对象覆盖全国22个省和4个直辖市的201所医院。其中,12 603例患者参与了预先设计的遗传亚组研究。研究获得首都医科大学附属北京天坛医院伦理委员会批准(批准文号:KY2015-001-01),患者或家属均签署知情同意书。
本研究纳入标准:①CNSR-Ⅲ中参与了预先设计的遗传亚组研究的急性缺血性卒中或TIA患者;②既往无卒中病史。排除标准:①患者提供的血液样本中DNA含量或质量不符合基因检测要求;②基因分型成功率≤66%;③卒中病因学分类系统(causative classification of stroke,CCS)分型为其他原因型卒中。
1.2 基线信息收集 通过研究数据库收集患者的基线资料。①人口学信息:年龄、性别、BMI;②病史:心房颤动、高血压、冠心病、糖尿病、血脂异常;③临床相关信息:入院时NIHSS评分、CCS分型。
高血压定义为收缩压≥140 mm Hg(1 mm Hg=0.133 kPa)或舒张压≥90 mm Hg,或使用任何降压药物及患者自述的高血压病史;糖尿病定义为住院期间或入院时空腹血糖≥7.0 mmol/L,或使用降血糖药物及医师诊断的糖尿病病史;血脂异常、心房颤动和冠心病定义为患者自述或医师诊断疾病史,或住院期间被医师诊断为此疾病。
采用CCS对患者进行卒中病因学分型[9]:大动脉粥样硬化型(large-artery atherosclerotic,LAA)、CE、小动脉闭塞型(small artery occlusion,SAO)及原因未明型(undetermined causes,UC)。
1.3 卒中结局 对患者发病后1年内随访3次(发病3个月和1年时采用面对面随访,发病6个月时采用电话随访)。从CNSR-Ⅲ数据库中采集患者卒中复发和联合血管事件发生的信息,未住院患者的疑似事件由临床终点事件判定委员会独立评估。卒中复发定义为1年随访期间,患者再次发生缺血性卒中或出血性卒中;联合血管事件包括1年随访期间内发生的缺血性卒中、出血性卒中、心肌梗死及血管性死亡事件;不良功能结局定义为1年随访时mRS>2分。
1.4 基因分型与质量控制 采用竞争性等位基因特异性PCR技术(kompetitive allele specific PCR,KASP)[10]对3个SNV rs7193343、rs879324和rs12932445进行基因分型。为保证基因分型的准确性,在随机选择的10例患者DNA中,采用KASP和Sanger测序两种技术分别检测3个SNV位点,两种方法之间的一致性为100%。排除基因分型成功率(成功基因分型的SNV数目/3)≤66%的患者,要求每个SNV位点的成功检出率(成功基因分型的患者数/7674)>95%,本研究没有进行基因型填补。
1.5 数据分析 分别在纳入总体人群、各CCS亚型人群中进行SNV位点与基线特征的关联分析及SNV位点与卒中结局(1年卒中复发、联合血管事件和不良功能结局)的关联分析,另外,进行SNV的基因型与CCS亚型的交互作用分析。
1.6 统计学方法 采用SAS 9.4软件进行统计学分析。符合正态分布的计量资料用表示,偏态分布的计量资料以M(P25~P75)表示,计数资料以率(%)表示。以3个SNV位点基因型为自变量,以所有基线指标为因变量,进行SNV位点与基线特征的关联分析。当因变量为计量资料时,采用多重线性回归分析;当因变量为计数资料时,采用逻辑回归分析。对SNV位点与卒中结局的关联分析,自变量为3个SNV位点基因型,因变量为卒中结局(1年随访期间卒中复发、联合血管事件及不良功能结局)。分析SNV位点与卒中复发和联合血管事件的关联性时,将发病至事件发生的时间间隔纳入统计模型,年龄、性别和心房颤动作为协变量,采用Cox回归分析;分析SNV位点与1年不良功能结局的关联性时,将年龄、性别、心房颤动、入院NIHSS评分和联合血管事件作为协变量进行校正,采用逻辑回归分析。SNV的基因型与CCS亚型的交互作用分析,两者的交互为相乘模型。进行关联分析和交互作用分析时,只有当相应患者的SNV基因型和表型数据同时不为缺失值时,才将该患者数据纳入分析。以P<0.05为差异有统计学意义。
1.7 生物信息学方法 应用HaploView 4.2软件计算3个SNV位点的相关系数R2值[11],分析3个SNV位点之间的连锁不平衡情况。采用PLINK 1.9软件计算每个位点的哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)情况。为比较3个SNV位点在不同族裔人群中的频率,非中国人群中的等位基因频率检索并计算于千人基因组数据库[12]。
2 结果
2.1 患者基线特征 最终7674例患者符合纳入与排除标准纳入本研究(图1)。总体患者中,平均年龄61.7±11.5岁,女性2438例(31.77%)。其中665例(8.67%)患者在1年随访期间内卒中复发,703例(9.16%)患者发生联合血管事件,829例(10.80%)患者在1年随访时mRS>2分。
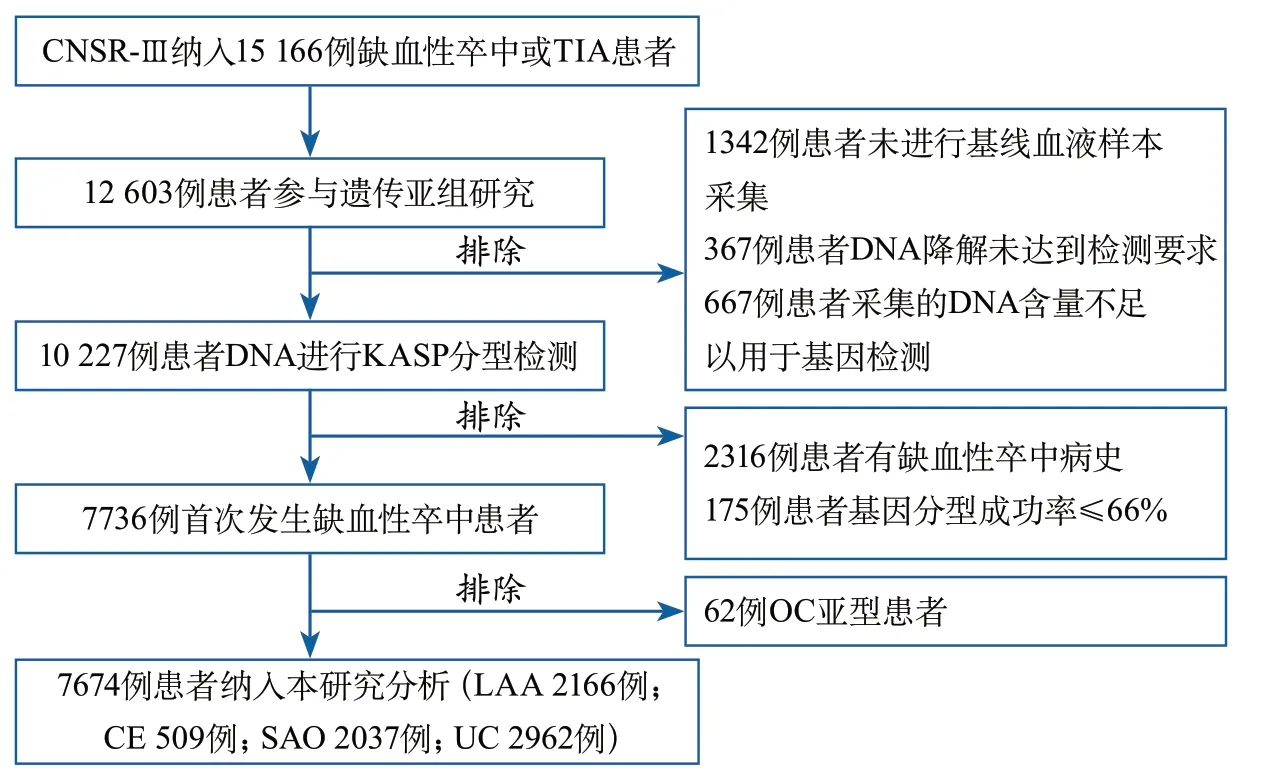
图1 本研究纳入患者的流程图
2.2 基因型人群频率 本研究人群中3个SNV位点的风险等位基因频率与千人基因组数据库中非亚裔的风险等位基因频率不同,这3个SNV位点的风险等位基因频率在中国人群中(CNSR-Ⅲ,北方汉族/南方汉族)高于欧洲人群、混合美国人群及非洲人群,且在CE卒中患者中风险等位基因频率最高(表1)。
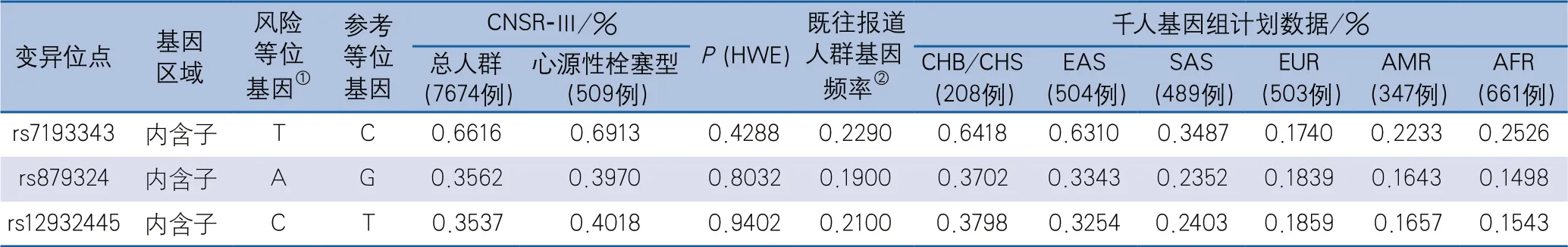
表1 本研究患者与其他人群中ZFHX3基因上3个SNV位点的风险等位基因频率比较
2.3 SNV变异位点基因型与基线特征的关联分析 在进行关联分析时,按照加性模型转换3个SNV位点的基因型,即将rs7193343位点的基因型CC、CT、TT定义为0、1、2,将rs12932445位点的基因型TT、TC、CC定义为0、1、2,将rs879324位点的基因型GG、GA、AA定义为0、1、2,SNV变异位点基因型与基线特征见表2。关联分析结果显示,3个SNV位点中,rs879324和rs12932445位点处于高度连锁不平衡状态(相关系数R2=0.88),同时以上2个SNV位点与心房颤动、入院时NIHSS评分及卒中亚型有关联;未发现3个SNV位点与BMI、高血压、冠心病、糖尿病及血脂异常卒中危险因素有关联(表3)。
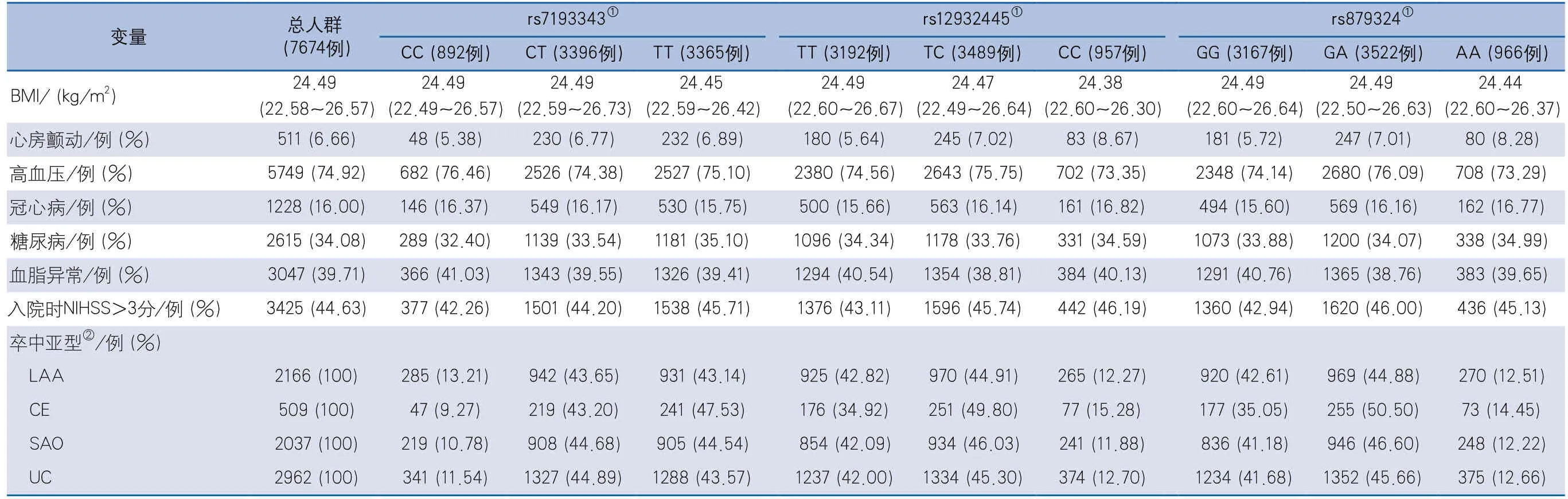
表2 SNV变异位点基因型与基线特征
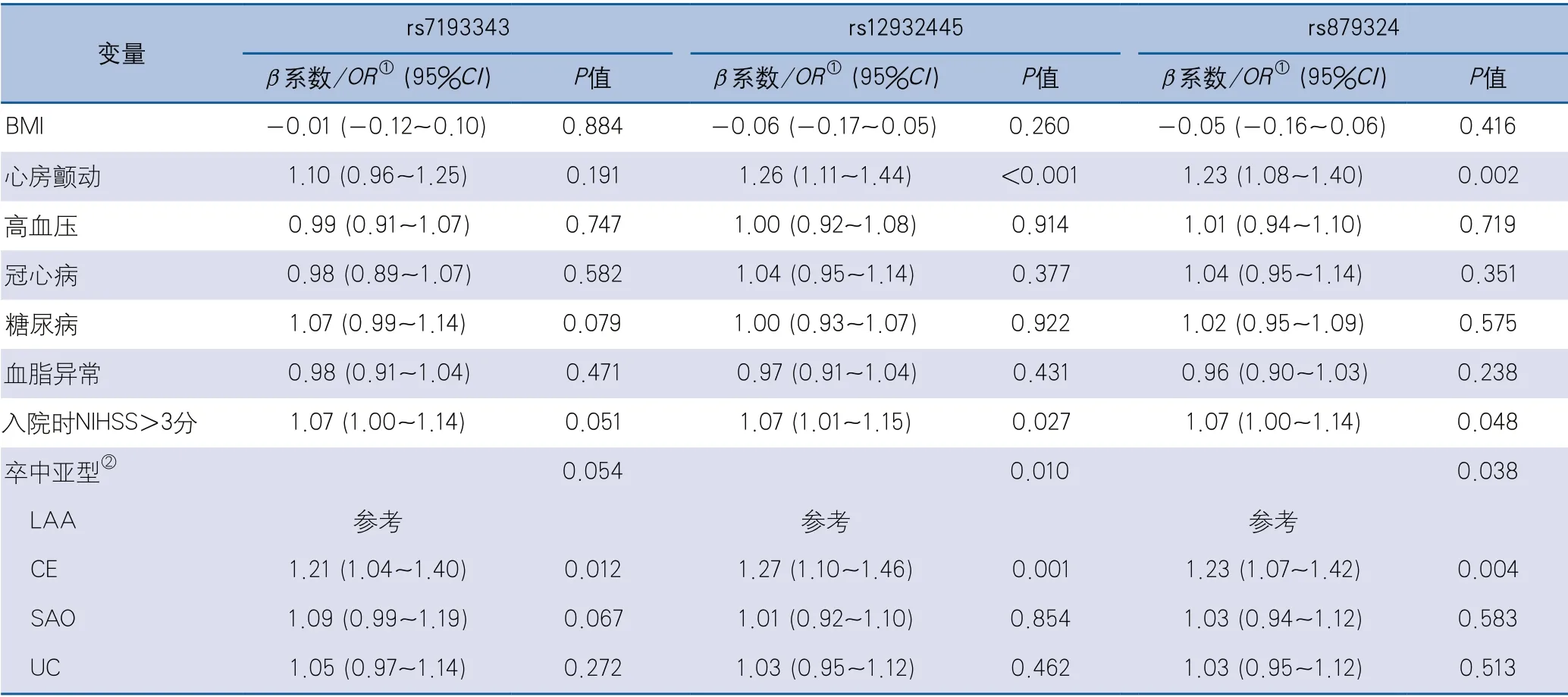
表3 SNV变异位点基因型与基线特征的关联分析结果
2.4 卒中亚型中ZFHX3基因上3个SNV位点与卒中结局风险的关联分析 在不同卒中亚型中,3个SNV位点均与1年联合血管事件有关联,在校正年龄、性别及心房颤动协变量后相关性仍然显著。在CE卒中亚型中,rs7193343位点的T等位基因与卒中复发和联合血管事件的发生有关联(校正HR1.92,95%CI1.21~3.05;校正HR1.95,95%CI1.26~3.01);rs879324位点的A等位基因和rs12932445位点的C等位基因与联合血管事件有关联(校正HR1.58,95%CI1.10~2.27;校正HR1.66,95%CI1.16~2.38)。在UC卒中亚型中,rs7193343位点的T等位基因与卒中复发和联合血管事件的发生有关联(校正HR1.34,95%CI1.09~1.64;校正HR1.36,95%CI1.11~1.66)。校正年龄、性别、心房颤动、入院时NIHSS评分和联合血管事件后,未发现3个SNV位点与不良功能结局之间存在关联。在总体人群中,rs7193343位点的T等位基因与不良功能结局存在关联(HR1.13,95%CI1.01~1.26),但校正年龄、性别、心房颤动、入院时NIHSS评分和联合血管事件后,结果显示3个SNV位点与卒中结局均不存在关联(表4)。
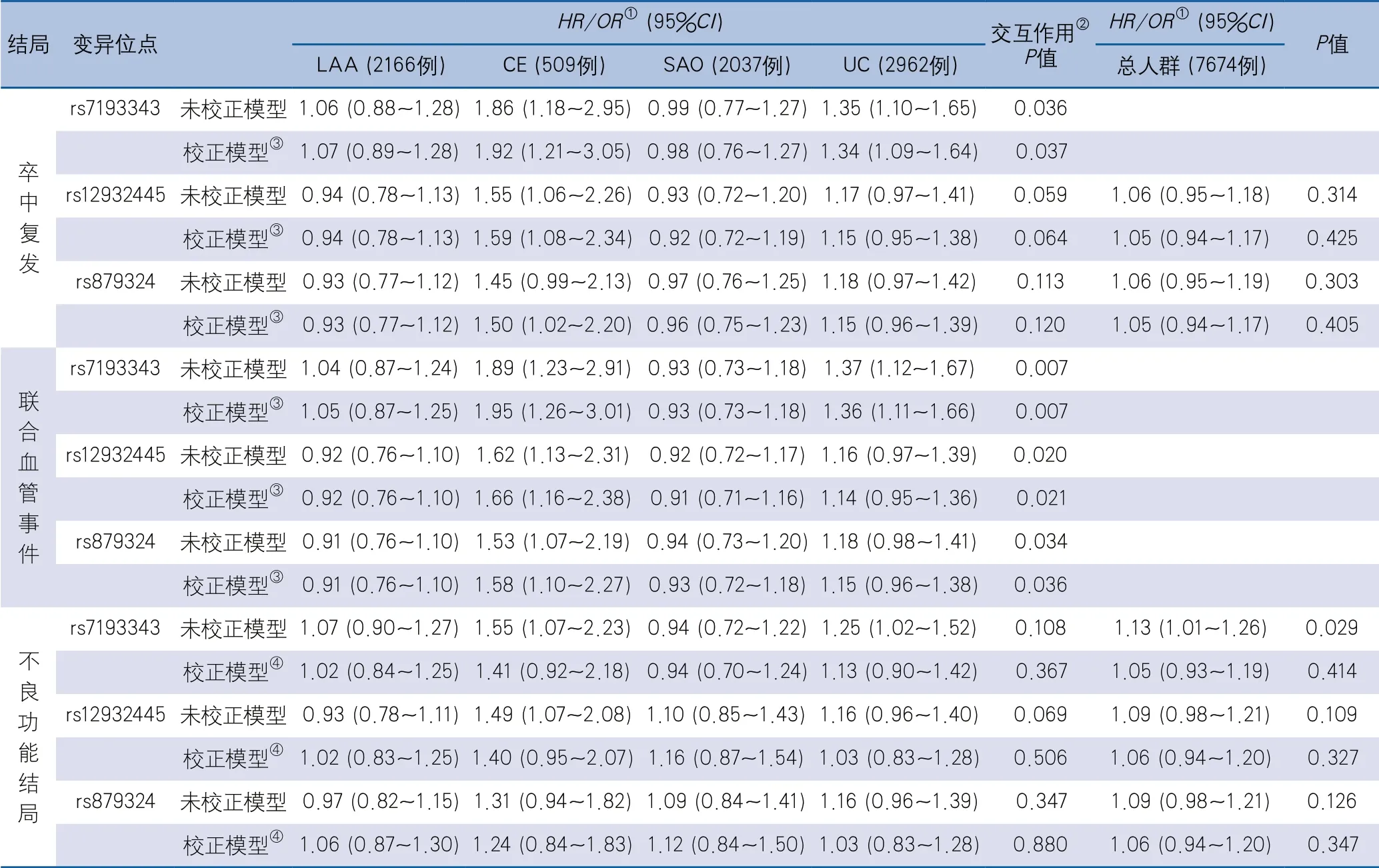
表4 卒中亚型中ZFHX3基因上3个SNV位点与卒中结局风险的关联分析
3 讨论
本研究发现ZFHX3基因上的3个SNV位点(rs7193343、rs879324和rs12932445)与卒中后的卒中复发和联合血管事件结局存在一定关联,且此关联仅发生于CE和UC型卒中人群中。此外,未发现此3个SNV位点与不良功能结局存在关联。该结果提示不同卒中亚型患者卒中结局的遗传机制可能存在差异,且ZFHX3基因上3个SNV位点与卒中结局关联性的机制,可能与心源性血管事件有关。
在本研究中,处于高度连锁不平衡状态的2个SNV(rs879324和rs12932445)曾被报道与CE型卒中的发生有关[4-5],但未表明是否与心房颤动有关。本研究结果首次表明rs879324和rs12932445位点与心房颤动存在一定关联性。此外,既往研究表明ZFHX3基因的rs7193343位点与心房颤动的发生存在关联[2-3,6-7],但本研究结果显示中国脑血管病人群rs7193343位点与心房颤动无关,该结果与既往对香港汉族人群中进行的全基因组关联分析研究结果一致(该研究包括286例心房颤动患者和2763名健康者;OR1.05,P=0.63),但与同一研究中的欧裔人群的结果不一致[2],提示不同遗传背景人群心房颤动的易感基因存在一定差异。本研究在校正心房颤动指标后,结果显示ZFHX3基因的SNV位点与卒中结局之间的关联仍然存在,表明ZFHX3基因与卒中结局的关联可能不仅是由心房颤动介导。除心房颤动因素外,本研究的3个SNV位点与患者BMI、高血压、冠心病、糖尿病及血脂异常均无一定关联,表明3个SNV位点与卒中结局之间的关联可能不是通过这些表型介导的。
3个SNV位点均位于ZFHX3基因的第一个内含子区。ZFHX3编码一个名为AT结合基序的转录因子,可调节肌细胞和神经元分化[13-15],在人体组织中普遍表达,但表达水平较低[16]。既往研究尚未阐明其在卒中进展中的作用[17-18]。rs879324和rs12932445位点位于增强子区域,而rs7193343位点位于绝缘子区域。rs879324和rs12932445位点与ZFHX3基因的表达数量性状基因座位点[19]rs805781处于高度连锁不平衡状态(相关系数R2>0.9)。rs7193343位点与卒中结局的关联与rs12932445或rs879324位点无关,表明这些区域的功能存在差异。
综上所述,本研究分析了ZFHX3基因上3个SNV位点(rs7193343、rs879324和rs12932445)与卒中结局及卒中相关危险因素之间的关联,并首次发现了此3个SNV位点与卒中复发和联合血管事件的关联性,且该关联具有卒中亚型特异性特点。未发现3个SNV位点与卒中发病1年后的不良功能结局有关。本研究还存在以下局限性:第一,本研究为关联分析研究,关联关系不能解释因果关系。第二,卒中临床结局由不同病因的事件组成,因此本研究所发现的ZFHX3基因上3个SNV位点与卒中结局关联结果的具体机制尚需进一步研究。第三,本研究是基于CNSR-Ⅲ的子队列研究,其中患者主要来自城市环境,可能不代表整个中国卒中患者群体。
【点睛】本研究分析了ZFHX3基因上3个SNV位点(rs7193343、rs879324和rs12932445)与卒中结局及卒中相关危险因素之间的关联,首次发现了此3个SNV位点与卒中复发和联合血管事件的关联性,且该关联具有卒中亚型特异性特点。
