肿瘤坏死因子-α通过Wnt通路对脑卒中小鼠缺血再灌注后脑微血管内皮细胞的影响研究
2021-12-13曹杰曾辉黄旭华
曹杰,曾辉,黄旭华
1.赣南医学院第一附属医院,江西 赣州 341000;2.南康区第一人民医院,江西 赣州 341400
脑卒中是由于脑内血管破裂或者阻塞引起的局部大脑血液供应不足,脑组织发生病变坏死的一种脑部疾病,其中大部分为缺血性脑卒中[1]。脑卒中发病人数多,有较高的死亡率和复发率。脑卒中对人机体损伤极大,每年患者不断增多。但治疗方式还十分缺乏,主要还是以预防为主[2]。近年来,抑制缺血再灌注导致的血脑屏障损伤已成为治疗脑卒中的新思路[3],但近几年来未见相关文献报道。探讨肿瘤坏死因子-α(TNF-α)对脑卒中小鼠缺血再灌注后脑微血管内皮细胞的影响的机制,对脑卒中的治疗有一定帮助。
1 材料与方法
1.1 实验材料
SPF 级C57BL 小鼠80 只,6 周龄,体质量范围20~25 g,雌雄各半,购自武汉万千佳兴公司。饲养环境为(1)符合国标的生活环境;(2)符合国标的饲料;(3)无致病菌或无菌的饮用水。ELISA试剂检测盒(上海酶联生物科技有限公司);Evans blue 染色剂(上海跃腾生物技术有限公司);RTPCR 试剂盒(赛默飞世尔科技有限公司);显微镜。
1.2 实验方法
小鼠随机分为A 组(缺血0 min)、B 组(缺血时间30 min)、C 组(缺血时间45 min)、D 组(缺血时间60 min)。除A 组外小鼠利用线栓法[4]构建缺血再灌注小鼠模型。首先,刮掉小鼠颈部的毛,切开皮肤,分离周围组织使左侧颈总动脉显露,结扎左侧颈总动脉和颈外动脉近心端,插线栓入颈内动脉主干,缓缓推进,血流读数骤降停止推进,固定栓线。缺血时间到达之后,立即取出线栓,苏醒后根据Longas 评分标准[5]进行评分,1~3 分的小鼠纳入实验。1 d 后检测各项指标。
1.3 观察指标与方法
1.3.1 ELISA 检测血清TNF-α 表达 每组各选取10只小鼠,取静脉血1 mL,按照ELISA 试剂盒说明书测定其中TNF-α 的水平。
1.3.2 Evans blue 法 每组另选取10 只小鼠,从眼窝静脉窦注射浓度为2%的Evans blue 至正常小鼠和脑卒中模型小鼠体内,每只小鼠注射200 μL。体内循环1 d,处死小鼠,取大脑并拍照。拍照之后,立即将大脑匀浆。通过酶标仪检测吸光度(OD620和OD740),计算出正常小鼠和脑卒中小鼠的脑内Evans blue 的浓度。
1.3.3 免疫组化检测 Wnt3a 表达用Wnt3a 单克隆抗体进行免疫组织化学染色。步骤:脱蜡、抗原修复,3%H2O2孵育10 min,滴加封闭用正常血清,PBS洗3 遍,室温孵育1 h,滴加1∶50 稀释的一抗,4℃过夜。PBS 冲洗,滴加辣根酶标记二抗,室温1 h,PBS 冲洗,DAB 显色剂显色。显微镜下拍摄,阳性表达呈棕黄色。
1.3.4 qPCR 技术检测Axin2、APCDD1 表达 提取总RNA 后,RT-PCR 试剂盒进行反转录,获得cDNA。通过荧光定量PCR 扩增目的基因。反应条件:95 ℃预变性10 min;95 ℃变性15 s、62 ℃退火/延伸60 s,40 个循环。
1.4 统计学方法
2 结果
2.1 小鼠血清TNF-α 水平以及脑内Evans blue 浓度
A 组TNF-α 水平较低,B、C、D 组水平逐渐上升(F=2 064.955,P<0.001)。A 组左脑Evans blue 浓度较低,B、C、D 组浓度逐渐上升(F=242.961,P<0.001)。B 组与A 组、C 组与A 组、D 组与A 组在TNF-α 水平和左脑Evans blue 浓度均差异有统计学意义(P<0.05)。各组右脑Evans blue 浓度差异无统计学意义(F=0.335,P=0.800)。见表2。
表1 小鼠血清TNF-α水平以及脑内Evans blue浓度()
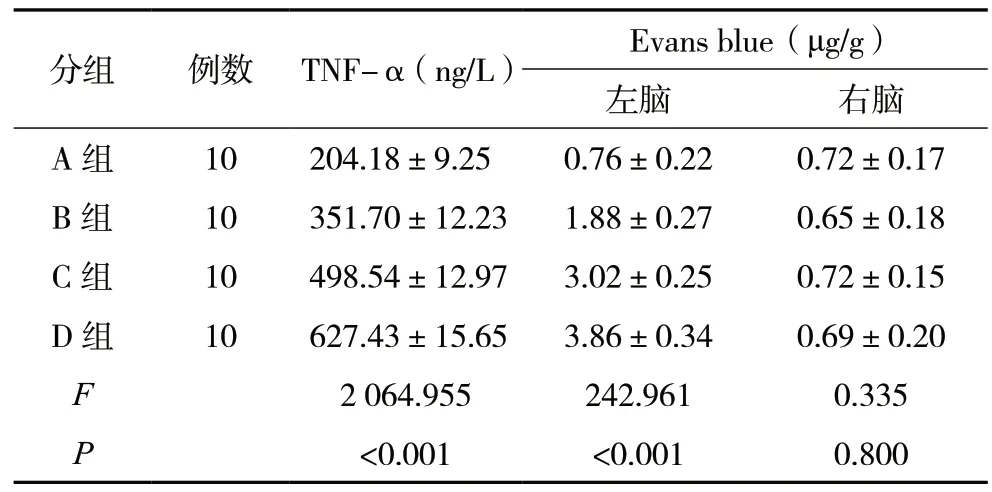
表1 小鼠血清TNF-α水平以及脑内Evans blue浓度()
表2 小鼠脑微血管内皮细胞Axin2、APCDD1 mRNA相对表达()

表2 小鼠脑微血管内皮细胞Axin2、APCDD1 mRNA相对表达()
2.2 小鼠脑微血管内皮细胞Wnt3a 的表达
Wnt3a 主要以胞核表达为主。A 组小鼠Wnt3a表达很少,B、C、D 组表达依次增多。详见图1。

图1 小鼠脑微血管内皮细胞Wnt3a的表达(化学染色,×400)
2.3 小鼠脑微血管内皮细胞Axin2、APCDD1 mRNA的表达
A、B、C、D 组Axin2、APCDD1 mRNA 相 对表达依次增多(F=292.512,1 237.411,P<0.001)。B 组 与A 组、C 组 与A 组、D 组 与A 组 在Axin2、APCDD1 mRNA 的表达差异有统计学意义(P<0.05)。详见表3。
3 讨论
脑卒中多发于中老年人群体,且缺血性脑卒中发病率最高[7]。部分患者通过治疗虽然能够好转,但往往会产生一定程度的后遗症,并且预后状况也不佳。缺血性脑卒中使血脑屏障功能降低,并增加脑出血和脑水肿的风险[8]。研究表明,闭塞的脑血管在疏通之后再灌注,短时间内就能激活一系列的生化反应,引起神经兴奋毒性、炎性因子分泌增多等[9]。炎症因子(TNF-α)进一步激活脑血管内皮细胞,使淋巴细胞进入血脑屏障,分泌促炎因子,从而引起大脑内神经细胞大量死亡。本研究结果显示,随着缺血时间的增加,小鼠机体产生的TNF-α 增多,提示脑卒中会导致机体产生促炎因子TNF-α,且TNF-α 水平呈缺血时间依赖性,另外左脑的Evans blue 浓度上升,表明随缺血时间的上升血脑屏障功能下降。
Wnt 通路与脑血管生成、血-脑脊液屏障的形成及其生物学特征维持有重要联系。Wnt3a 为Wnt信号通路的起始蛋白[10],其表达可激活Wnt 信号通路。本实验结果,小鼠脑微血管内皮细胞Wnt3a的表达逐渐上升。提示脑卒中小鼠的Wnt 通路被异常激活,随着缺血时间的增加,Wnt 通路被激活的情况更加严重。
Wnt 通路的靶基有Axin2、APCDD1。Axin 是一种构架蛋白,它能激发ß-catenin 磷酸化,又能被泛素蛋白酶体分解,导致Wnt 通路保持低活性[11]。APCDD1 因子是与Wnt 信号通路密切相关的膜结合糖蛋白[12]。APCDD1 作为内源性因子可激活或抑制经典Wnt 信号通路。本实验结果,脑卒中小鼠Axin2、APCDD1 的表达逐渐增加。提示Wnt 通路被抑制,随着缺血时间的增加,Wnt 通路的活性越低。
综上所述,研究发现脑卒中小鼠伴随着TNF-α 水平异常增加,Wnt 通路异常激活,脑微血管内皮细胞功能下降,Wnt 通路的靶基因表达上升。TNF-α 可能参与到调控Wnt 通路的活性来影响脑微血管内皮细胞功能。其具体机制还有待进一步研究。
