沙门氏菌耐药基因的核酸恒温扩增快速检测
2021-12-09梁祖源刘雪莲杜昱光
赵 雪,梁祖源,张 琛,王 倬,毛 瑞,刘雪莲,杜昱光
(1.中国科学院过程工程研究所/生化工程国家重点实验室,北京100190;2.中科芯瑞(苏州)生物科技有限公司,江苏苏州215152;3.饲用微生物工程国家重点实验室,北京大北农科技集团股份有限公司,北京100192)
抗生素在20世纪被人类发现,并被广泛应用于细菌感染治疗,极大降低了人类急性病原感染性疾病的死亡率,人类医疗也进入了抗生素的“黄金时代”[1]。然而伴随抗生素的广泛应用甚至滥用,抗生素耐受菌,尤其是多重耐药菌的高频出现,对抗生素用于疾病治疗的效果产生极大挑战。目前,几乎所用抗生素均已发现药物耐受性病原,抗生素耐受性问题已引起全球范围的关注[2]。已有大量研究工作针对耐药菌产生抗药性的原因进行调查,其抗药性机理,包括药物靶点突变、药物靶点修饰、抗生素修饰降解酶的大量表达以及泵出系统功能增强等。沙门氏菌属肠杆菌科,革兰氏阴性肠道杆菌,在自然界中分布广泛,在动物养殖过程中沙门氏菌感染能够引起猪肠道出现炎症和坏死,导致腹泻,并可能导致全身性败血症,以仔猪最为常见[3-4]。沙门氏菌是引起人类食源性感染的重要原因之一,猪是沙门氏菌的第二大宿主,因此人类对猪肉的食用是感染该菌的主要风险因素[5]。养殖业中,为防止疾病感染,抗生素的大量使用使得细菌的耐药性更为严重,严重威胁着动物和人的健康,日益受到人们的重视[6-7]。据报道,耐药性沙门氏菌在世界范围内广泛传播。20世纪90年代,人们已发现对6种常用抗菌药物耐受的多重耐药沙门氏菌。这种耐药性在伤寒及非伤寒沙门氏菌中都在快速扩散,可以说,这是在养殖动物过程中广泛使用抗生素所带来的不可避免的后果[8]。此外,研究表明,国内沙门氏菌耐药性传播的情况也较为严重。据报道,2014~2015年,山东省8个屠宰场中所收集的600多份猪肉样本中有超过22%的样本均存在沙门氏菌,而且在沙门氏菌样本发现较多多重耐药的病原,而对磺胺类药物的耐药性比例已高至91%[9]。此外,2014~2016年在对非伤寒性沙门氏菌患者病例耐药性调查发现,76%的病例都呈现氨苄青霉素耐药性,而对氯霉素、环丙沙星等药物的耐药性也较为常见[10]。由此可见,沙门氏菌的耐药性问题已经非常普遍,通过不同方法减少或代替抗生素的使用将极大有助于减少耐药性的进一步传播。其中对于耐药基因的快速鉴别,将有助于制定对相关病原的针对性用药治疗方案,从而更有效的治疗相关病原感染性疾病,因此可以有利于减少抗生素使用量。
目前,PCR技术是在实验室中应用最为广泛的基因检测技术[11-13]。但该技术需要精密、复杂的变温仪器,需配备专业操作人员。尤其是传统PCR技术步骤繁杂、灵敏度不足、试验时间较长。而荧光定量PCR尽管具有灵敏度高和检测时间短的优势,其较为高昂的价格及对试验环境条件的要求,一定程度限制了其在更广泛领域的应用,尤其难以满足养殖场等基层实地实时快速检测的应用需求。恒温扩增技术能够在恒定的温度下实现对目标分子的体外扩增,仅需一个水浴锅或金属浴即可实现温度控制,大大简化了核酸检测的操作步骤,已成为即时检验技术发展的新趋势[14-15]。环介导等温扩增(LAMP)方法是由日本学者NOTOMI等[16]于2000年开发的一种新型核酸扩增技术。由于具有反应环境条件要求低、反应快速等优势,LAMP目前已成为用途最为广泛的核酸恒温扩增方法[17-19]。但LAMP存在引物设计相对复杂,易出现假阳性等问题,一定程度上限制其更广泛的应用。竞争性互补介导核酸恒温扩增(CAMP)是MAO等[20]研发的一种恒温扩增方法。CAMP基于竞争性自循环成环机理,利用链置换型DNA聚合酶具有核酸链置换及聚合两种活性的特性,形成核酸快速扩增。相较于LAMP方法,CAMP所需的目标核酸片段较短,且同样具有很高的特异性及灵敏度,可通过添加Eva Green(PCR中常用的荧光指示剂,用以反映扩增产物的积累)进行实时荧光定量检测,以及通过添加羟基萘酚蓝(hydroxynaphthol blue,HNB)等通过肉眼直接观察颜色变化判断有无反应。
随着对样品检测结果精度及检测效率要求的提高,微流控芯片技术成为当前的检测技术创新的突破口。微流控研究起始于20世纪90年代已经在多个领域得到认可并广为利用,其产业化趋势亦是愈发明显,而分子诊断是微流控芯片技术具有代表性的应用领域之一[21]。微流控芯片具有体积小、操作简单、试剂用量少等特点,可以有效提高检测分析效率,也能够大幅降低测试成本。此外,由于反应过程处于封闭的环境中,可以消除交叉污染的可能性,可以显著降低假阳性结果出现的几率。因此,将CAMP等温扩增技术进一步与微流控芯片技术结合,实现了对相关病原的现场快速高灵敏度检测[22-24]。
因此,本研究拟基于CAMP技术,分别以β-内酰胺类耐药基因b laTEM-1,四环素类耐药基因tet B,氨基糖苷类耐药基因aadA1,这些基因的保守区域片段为靶序列设计特异性引物,建立沙门氏菌耐药基因的快速检测方法,并对其灵敏性和特异性进行研究,使用从养殖场中采集并完成基因组测序的菌株,对方法进行验证,以期能够满足养殖业及饲料生产企业对致病菌耐药性快速检测的需求。沙门氏菌耐药菌株63A、20A、40A及S16A均由养殖场实地采集而来,基因组由北京六合华大基因科技有限公司测序,确定63A菌株携带b laTEM-1、tet B、aad A1基因,20A菌株携带blaTEM-1基因,40A菌株携带aad A1基因,S16A菌株携带tetB、aadA1基因。
1 材料与方法
1.1 主要试剂
Bst 2.0 DNA聚合酶、10×ThermoPol反应缓冲液(包括200mM Tris-HCl,100mM KCl,100mM(NH4)2SO4,20mM MgSO4及1%Triton X-100)购自纽英伦生物技术(北京)有限公司;10mM dNTPs购自普洛麦格(北京)生物技术有限公司。Eva green购自biotium公司;10mM dNTPs购自普洛麦格(北京)生物技术有限公司;核酸提取试剂盒、无核酸酶水购自天根生化科技(北京)有限公司;羟基萘酚蓝Hydroxynaphthol blue(HNB)、甜菜碱购自西格玛奥德里奇(上海)贸易有限公司。其他试剂均为国产分析纯。
1.2 菌株
沙门氏菌标准菌株Salmonella ent ericaCGMCC1.10603购自微生物所菌种保藏中心;大肠杆菌ETEC K88(the EnterotoxigenicEscherichi a col iK88)BNCC 125988菌株为中国农业大学何平丽教授赠送;沙门氏菌S al monell asp.63A、20A、40A、S16A均为大北农养殖场实地采集菌株。这些菌株用于耐药基因引物特异性检测。
1.3 样本核酸提取
分别采用核酸提取试剂盒及本实验室改进的核酸快速提取方法提取细菌核酸样本[24]。核酸快速提取方法步骤为:将100μL核酸快速提取试剂混合液(包括5%Chelex-100、1%SDS、80mM NaOH)和100μL样本,充分吸打混匀后置于90℃反应10min,上清液即为含目标核酸的粗提物。
1.4 仪器与设备
实时荧光定量PCR仪ABI Step One(ABI公司,美国)、小型高速离心机Eppendorf 5424(Eppendorf公司,德国)、NanoDrop 2000(Thermo Fisher Scientific公司,美国)、Tanon-1600凝胶成像分析系统(天能科技有限公司,上海)、DYY-6C型电泳仪(六一仪器厂,北京)、电热恒温水浴槽(析达仪器有限公司,上海)、生化培养箱(天翎仪器有限公司,江苏)。
1.5 CAMP检测体系
根据GenBank中耐药基因bl aTEM-1、tetB、aadA1的基因序列,经生物信息学分析比对,设计相应特异性引物(表1)。全部引物由北京六合华大基因科技有限公司合成。CAMP反应体系(25μL)包括1.4mM dNTPs,2.5μL 10×ThermoPol Buffer,8U Bst 2.0 DNA聚合酶,1M甜菜碱,6mM MgSO4,1μL Eva green,2μL模板DNA,引物各1.6μM。于63°C孵育60min和80°C反应10min灭活酶终止反应或于63°C孵育80min并80°C反应10min灭活酶终止反应。本试验可采用加入反应体系中加入Eva green后应用实时荧光PCR仪监测反应进程,也可采用在反应体系中预先加入1μL浓度为3mM的HNB溶液至反应结束后观察颜色变化判断有无反应(阳性为天蓝色,阴性为紫罗兰色)。

表1 引物序列及相关信息Table 1 Primer sequences and relative information
1.6 特异性试验
本试验为证明所建立的沙门氏菌耐药基因快速检测方法的特异性,分别对沙门氏菌耐药菌株63A、20A、40A、S16A,沙门氏菌标准菌株S.entericaCGMCC1.10603,大肠杆菌ETEC K88菌株提取的模板DNA进行特异性检测。沙门氏菌耐药菌株63A、20A、40A、S16A均由大北农养殖场实地采集,菌株全基因组由北京六合华大基因科技有限公司测序,经与GenBank中相应耐药基因序列比对,确定63A菌株携带bl aTEM-1、tetB、aad A1耐药基因,20A菌株携带b laTEM-1耐药基因,40A菌株携带aad A1耐药基因,S16A菌株携带tetB、aad A1耐药基因。通过使用药物筛选培养基,确定上述菌株具有其所对应的耐药性。
1.7 灵敏度试验
本试验以沙门氏菌耐药菌株63A菌液提取的DNA作为模板,10倍梯度稀释,DNA浓度从105拷贝稀释到10拷贝进行方法灵敏度研究。
1.8 微流控芯片检测
以建立的CAMP方法对沙门氏菌核酸样本进行微流控芯片检测。微流控芯片为本实验室设计制作[24]。为制作预埋检测引物的微流控芯片,首先将预先混合有0.1%琼脂糖的1.6μM引物注入微流控芯片反应孔内,于室温静置晾干后,将其封膜固定。其中,0.1%琼脂糖的作用主要在于帮助引物固定在芯片反应孔内。在实际检测试验中,通过加样孔加入约75μL含有待检测样品的反应液体系,每个检测孔内约注入5μL含有待测样品的反应液。加样完毕后,将加样孔及排气孔封闭以实现完全封闭避免气溶胶污染。微流控核酸检测芯片于水浴或商品化的芯片恒温扩增核酸分析仪(iChip-400,北京百康芯生物)中63°C孵育60min,反应结束后观察反应孔内试剂颜色变化判断反应结果,或通过iChip-400直接分析实时荧光检测结果。
2 结果与分析
2.1 CAMP 方法建立与结果判定
以所设计的针对沙门氏菌的CAMP引物对目标菌液(107CFU·mL-1)提取的DNA模板在63℃条件下进行等温扩增反应,并在反应体系中加入Eva green荧光染料,利用实时荧光PCR仪监测反应过程及结果。由图1可知,筛选得到的针对b laTEM-1、tetB、aadA1及沙门氏菌通用引物分别在35,24,40,38min开始出现产物积累。上述结果表明,所建立的CAMP检测方法可以实现对沙门氏菌耐药基因的快速检测。

图1 3种耐药基因及通用型引物CAMP检测实时荧光扩增曲线Figure 1 Amplification curve of real time CAMP of 3 antibiotic-resistance genes and S almonel la invA gene
2.2 特异性试验结果
为验证所筛选得到的引物的特异性,使用采集得到沙门氏菌耐药菌株63A、20A、40A、S16A,沙门氏菌标准菌株CGMCC1.10603,大肠杆菌ETEC K88菌株作为检测目标,开展特异性试验。使用筛选得到的针对b laTEM-1基因的CAMP引物,进行等温扩增核酸检测。由图2可知,实时荧光CAMP扩增结果表明,仅在63A和20A样本出现扩增曲线,这一结果与前期测序结果一致。预先于反应体系中加入HNB后,63A和20A样本的可视化检测为阳性的天蓝色,对照组为阴性的紫罗兰色(图2),表明两种结果判断方法的一致性。
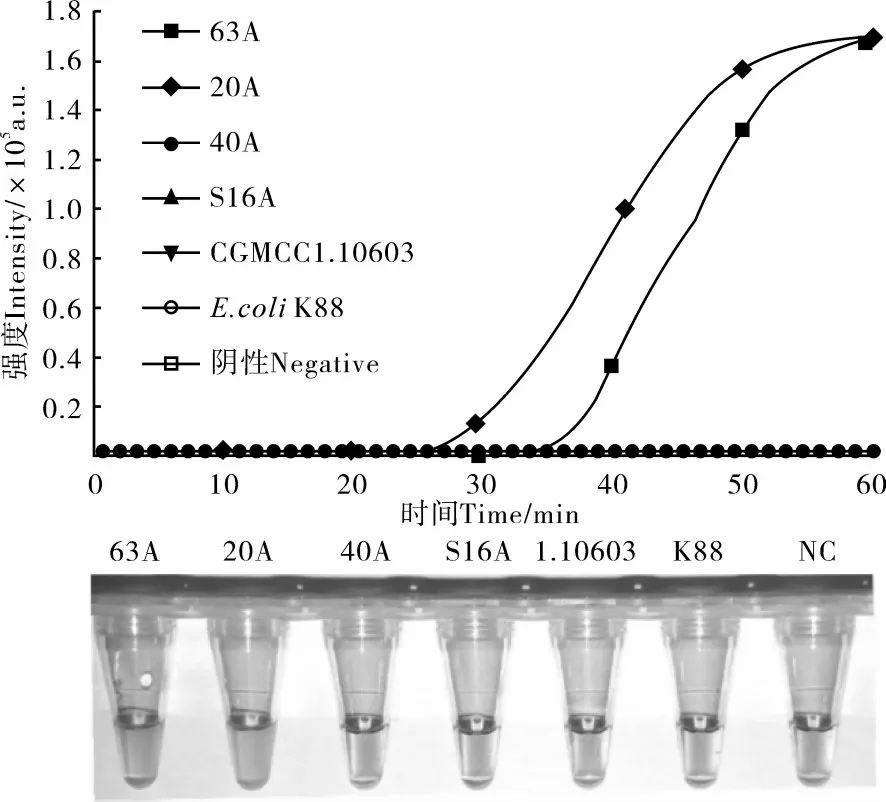
图2 blaTEM-1基因CAMP检测实时荧光及可视化特异性评价Figure 2 Specificity analysis of b laTEM-1 gene detection by fluorescent and visual CAMP
使用针对tetB基因的CAMP引物对上述样本进行检测,实时荧光CAMP扩增结果表明,仅在63A和S16A样本出现扩增曲线,这一结果与前期测序结果一致。预先于反应体系中加入HNB后,63A和S16A样本的可视化检测为阳性的天蓝色,对照组为阴性的紫罗兰色(图3),表明两种结果判断方法的一致性。
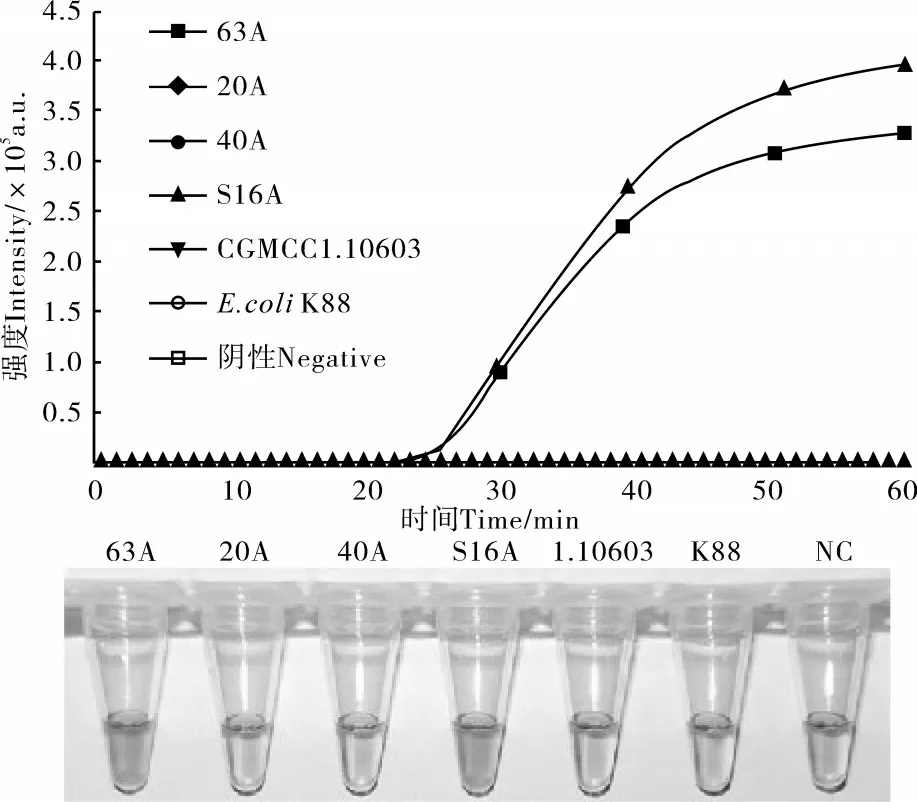
图3 tetB基因CAMP检测实时荧光及可视化特异性评价Figure 3 Specificity analysis of tet B gene detection by fluorescent and visual CAMP
使用针对aadA1基因的CAMP引物对上述样本进行检测,结果表明,仅在63A、40A、S16A样本出现扩增曲线,这3个样本的可视化检测同样为阳性(图4),其他样本皆为阴性。上述结果表明,本研究所开发的CAMP检测体系特异性较好。
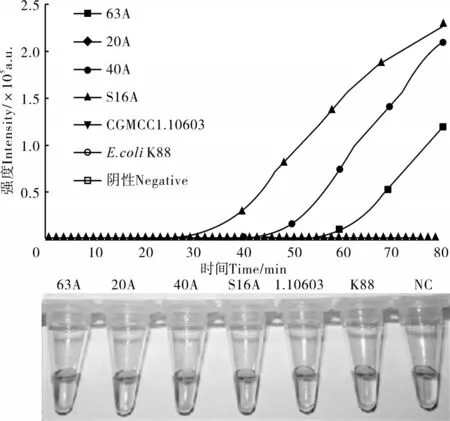
图4 aad A1基因CAMP检测实时荧光及可视化特异性评价Figure 4 Specificity analysis of aadA1 gene detection by fluorescent and visual CAMP
2.3 灵敏度试验结果
将从沙门氏菌耐药菌株63A中提取的基因组DNA进行10倍梯度稀释,作为鉴定沙门氏菌的i nv A、aad A1、tetB、b l aTEM-1基因应用本试验建立的CAMP检测方法灵敏度研究的模板。鉴定沙门氏菌的i nvA基因,当DNA浓度从105拷贝稀释到10拷贝时,实时荧光CAMP方法均可在60min内检出,说明inv A基因检测限为10拷贝(图5)。
鉴定氨基糖苷类耐药基因的aadA1基因应用本试验建立的CAMP检测方法。当DNA浓度为105拷贝稀释到102拷贝时,实时荧光CAMP方法可在60min内检出,说明aad A1基因检测限为102拷贝(图6)。
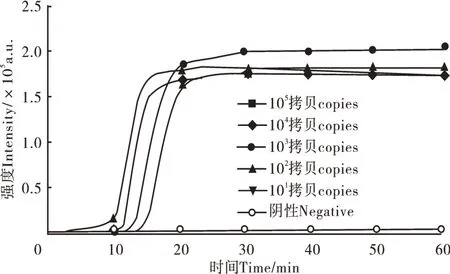
图6 aadA1实时荧光CAMP检测灵敏度分析Figure 6 Sensitivity analysis of aad A1 detection by real time CAMP
鉴定四环素类耐药基因的tetB基因应用本试验建立的CAMP检测方法,当DNA浓度从105拷贝稀释到103拷贝时,实时荧光CAMP方法可在60min内检出,说明tetB基因检测限为103拷贝(图7)。
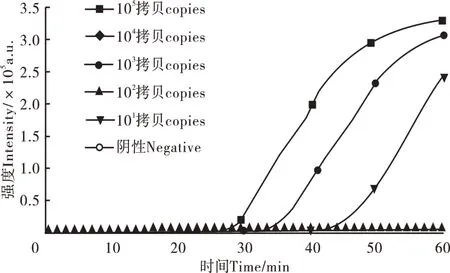
图7 tetB实时荧光CAMP检测灵敏度分析Figure 7 Sensitivity analysis of tetB detection by real time CAMP
鉴定β-内酰胺类耐药基因的b laTEM-1基因应用本试验建立的CAMP检测方法,当DNA浓度从105拷贝稀释到103拷贝时,实时荧光CAMP方法可在60min内检出,说明blaTEM-1基因检测限为103拷贝(图8)。

图8 bl aTEM-1实时荧光CAMP检测灵敏度分析Figure 8 Sensitivity analysis of b laTEM-1 detection by real time CAMP
2.4 CAMP微流控芯片检测
采用本实验室前期所设计开发的多通道微流控芯片对所提取沙门氏菌核酸样本进行检测。提前将沙门氏菌通用引物预埋在芯片a、b孔道,针对b laTEM-1序列的特异引物预埋于c、d孔道,针对tetB序列的特异引物预埋于e、f孔道,针对aadA1序列的特异引物预埋于g、h孔道,i孔道不进行引物预埋,作为阴性对照(图5)。引物经室温晾干、封膜固定后用于对不同菌株DNA的核酸检测试验。结果表明,63A菌株样本的沙门氏菌通用引物、blaTEM-1、tetB、aad A1抗性基因引物均表现为阳性,可视化检测结果均为天蓝色(图9),且3组平行试验的阳性结果重复性良好。20A菌株样本仅blaTEM-1抗性基因可视化检测结果为阳性,与其测序结果吻合(图10)。而ETEC K88菌株样本既不含有沙门氏菌通用引物所对应基因片段,也不含b laTEM-1、tetB、aad A1抗性基因片段,因此没有扩增反应发生,颜色反应均为阴性(图11)。因此,基于微流控芯片的可视化判断结果与实时荧光PCR所得出结果保持一致,表明以微流控芯片为平台的检测方法与实时荧光PCR具有相近的稳定性和准确度。

图5 inv A实时荧光CAMP检测灵敏度分析Figure 5 Sensitivity analysis of inv A detection by real time CAMP

图9 63A样本抗性基因CAMP微流控芯片检测评价Figure 9 Microfluidic chip analysis of antibiotic-resistant genes of sample 63A by visually CAMP

图10 20A样本抗性基因CAMP微流控芯片检测评价Figure 10 Microfluidic chip analysis of antibiotic-resistant genes of sample 20A by visually CAMP

图11 ETEC K88样本抗性基因CAMP微流控芯片检测评价Figure 11 Microfluidic chip analysis of antibiotic-resistant genes of ETEC K88 sample by visually CAMP
3 讨论与结论
近年来,病原微生物的抗生素耐药性问题日趋严重,尤其是水平基因飘移所造成的耐药基因散布传递,严重威胁着人与动物的生命健康[25]。在养殖动保领域常用的抗生素中,β-内酰胺类是一类种类很广的抗生素,包括青霉素及其衍生物、青霉烯类、青霉烯类酶抑制剂、头孢菌素等。这类抗生素具有毒性低、杀菌活性强、临床效果好以及适应症广的优势,因此在养殖场内经常会添加到动物饲料中,日常饲喂[5]。在抗生素广泛使用的压力下,沙门氏菌产生抗药性,其中β-内酰胺酶基因的存在使得沙门氏菌等革兰氏阴性细菌具有了抗β-内酰胺类抗生素的耐药性。β-内酰胺酶通常包含头孢菌素酶,青霉素水解酶,I-III代头孢菌素,头孢西丁,尖孢霉素等,这些酶通常由任一质粒中携带的blaTEM、b l aCTX-M、blaSHV基因编码,这些基因可以在细菌间或染色体上转移[26-27]。从而造成耐药菌的大量存在。氨基糖苷类抗生素是一类广谱抗菌药物,对于革兰氏阳性菌及革兰氏阴性菌均有效果。氨基糖苷类抗生素通过与细菌核糖体结合干扰蛋白质翻译过程从而发挥抗菌活性。细菌对氨基糖苷类抗生素产生耐药性的一种方式是通过核糖体RNA甲基转移酶(RMTase)对核糖体上抗生素结合位点进行修饰,从而阻碍抗生素的结合。RMTase基因一般通过质粒中存在的形式在细菌之间传递。目前,已有100多个RMTase基因被发现,在沙门氏菌中已发现有aadA1、aadA2等RMTase基因参与耐药过程[28]。四环素类抗生素是一类碱性广谱抗生素。四环素类药物通过与细菌30S核糖体亚基结合而抑制了氨酰-tRNA与核糖体的结合,从而抑制了细菌蛋白质的合成,抑制细菌的繁殖,起到抑菌作用。四环素类药物开发了约100种,但是用于临床和兽药的仅有几种主要包括金霉素、土霉素、四环素、甲烯土霉素、二甲胺四环素、多西环素、米诺环素等。兽医临床上应用广泛,多用四环素类药物治疗沙门氏菌引起的犊牛白痢雏鸡白痢及大肠杆菌性的仔猪黄痢、白痢,巴氏杆菌引起的禽霍乱;与卡那霉素联合使用治疗猪喘气病和猪肺疫,局部应用于各动物组织中坏死杆菌感染引起的坏死或子宫脓肿炎症,感染血孢子虫导致的牛边缘边虫病、泰乐焦虫病、钩端螺旋体病等;金霉素多用作饲料添加剂,用于动物促生长,也可用作局部用药如软化剂。在兽药长期大量使用四环素类抗生素的压力下,细菌易产生耐药性,针对四环素类抗生素的耐药机制主要有两类:外排泵系统和核糖体保护因子的表达。外排泵系统是由质粒中的tet A、tetB、t etC、tet D、t etE、tetG、tetH、tetJ、tetK、t etL等基因编码;核糖体保护因子则是由t etM、t etO、tetQ、tet S、t etT等基因编码[29]。
在动物养殖的实践过程中,由于现代养殖企业集约式养殖方式,造成养殖动物的密度往往较大,易造成疾病的传播,而在少量群体感染时的广泛群体用药治疗在实践活动中常常出现,从而造成药物的过量使用,是动物养殖行业耐药性问题严重的一大原因[30]。WHO领导的一项世界范围的调查研究发现,限制减少药物的使用可以有效减少约15%~24%的耐药菌的出现[31]。因此,对于动物养殖过程中发生病原感染,快速即时的检测鉴别病原耐药基因,对于指导药物使用,总体减少抗生素使用量意义重大。沙门氏菌是我国一种常见的人畜共患病原菌,其发病率在细菌性食源性疾病中所占比例最大,严重威胁着我国食品消费者及养殖动物的身体健康。因此,本研究使用等温扩增结合微流控芯片技术,用于开发可方便快速检测沙门氏菌耐药基因的检测芯片。结果表明,所开发的CAMP检测体系,可有效检测沙门氏菌b l aTEM-1、t etB、aadA1共3种耐药基因,结果显示出良好的特异性。此外,所开发的检测体系可使用实时荧光定量PCR设备进行结果判读,也可以使用实验室水浴等温控设备进行基于颜色变化的裸眼结果判读,并可结合微流控芯片进一步提高反应体系密封性,减少试剂用量从而节约检测成本,为该检测体系的养殖现场应用奠定了良好的技术基础。
常规核酸检测技术如PCR等具有准确性好、可靠性高、但检测时间较长、效率较低,且PCR技术对于温控模块要求高扩增时间较长等问题。等温核酸扩增技术具有准确性好、可靠性高、灵敏度和特异性高等优点,已成为即时检验(point-of-care testing,POCT)技术发展的新趋势。此外,基于恒温扩增检测技术的应用目前仍以离心管中的检测为主流。随着对样品检测结果精度及检测效率要求的提高,微流控芯片技术成为当前的检测技术创新的突破口。微流控技术可作为各类检测技术的高效实施平台和微型化载体。该技术在缩短检测时间、减少样品用量的同时,还能提高检测的准确性和灵敏度,减少核酸检测的假阳性问题。本试验所采用的CAMP恒温扩增方法,检测时间短,反应结果直观可见,具有较高的特异性及灵敏度。CAMP检测操作简单,反应仅需水浴锅或者恒温箱即可开展,不需要其他复杂昂贵的仪器。微流控芯片的密封性解决了核酸检测样品易交叉污染所引起的“假阳性”问题,芯片微型化以及等温扩增对温度变化要求的降低,改善了核酸检测设备的便携性同时简化了操作及常规PCR的复杂条件设定。这些优势使得“微流控芯片+等温核酸扩增”检测设备具有良好的传染病原现场检测的应用前景。
