外源硫化氢对不同弱光下高羊茅形态和生理指标的影响
2021-12-09刘博文高双红游翔凯李尤月张士军许岳飞
李 萱, 刘博文, 高双红, 游翔凯, 龙 思, 李尤月, 刘 茜, 张士军, 许岳飞
(西北农林科技大学草业与草原学院, 陕西 杨凌 712100)
近年来,随着城市现代化进程加快,高大密集的建筑物不断增加,从而限制草坪的生长。同时,以高大的乔木和灌木为主的城市立体绿化也使得草坪遮荫尤为严重,这种现象改变草坪生长的坏境小气候,影响草坪所处的立地条件,对草坪草生长发育有明显的抑制作用,影响草坪植物生长[1-2]。虽然遮荫下的植物会通过改变株型和叶片结构等一系列适应机制进行自我调节,但长期处于弱光环境下的草坪植物由于无法获得充足的光照和能量,对高温、践踏等逆境胁迫抵抗性较差,易感染病虫害或黄化[2-3]。因此,研究草坪草在弱光胁迫下形态和生理特征的变化,探究其耐荫机制,能更好地解决草坪产业发展存在的瓶颈问题。
硫化氢(H2S)在常温常压下是一种无色有“臭鸡蛋”气味的气体,是继CO和NO之后生物体内中被发现的第三种气体信号分子[4],除了在调控神经系统和心血管系统等方面发挥重要作用外,适宜浓度的硫化氢处理还能够提高植物对非生物胁迫的耐受性,减轻非生物胁迫对植物的有害影响,同时也能促进植物种子萌发、幼苗生长和根部的发育[5-7]。如外源H2S在重金属胁迫下能够促进紫花苜蓿(Medicagosativa)生长,降低重金属进入食物链的风险[8],而且在盐胁迫下喷施外源H2S能够促进紫花苜蓿种子发芽,减轻盐胁迫对紫花苜蓿的损伤[9],甚至在干旱胁迫下外源H2S能够同NO形成新供体化合物从而增强紫花苜蓿对干旱的适应性[10]。然而关于H2S是如何影响不同遮荫下高羊茅(FestucaarundinacesSchreb.)形态和生理的研究尚未见报道。
高羊茅是禾本科羊茅属的一种多年生冷季型优质牧草或草坪草,其须根发达,适应性广,具有较好的耐寒、耐践踏性,抗病性强,与杂草竞争力强[12]。然而,遮荫限制了高羊茅优良品种的推广和应用。基于此,本研究以不同弱光胁迫下的高羊茅作为研究对象,通过施加外源H2S,研究H2S对弱光胁迫下高羊茅植株的形态指标、光合色素含量、细胞膜稳定性和内源激素与内源H2S含量的影响,探究H2S对高羊茅细胞膜稳定性与生长的调控,为优质耐荫草坪草分子育种提供理论基础。
1 材料与方法
1.1 试验材料与设计
高羊茅‘Arid3’(FestucaarundinaceaSchreb.‘Arid3’),由北京克劳沃草业技术开发中心提供。种子用1.0%次氯酸钠溶液对种子进行消毒5 min,再用蒸馏水反复冲洗干净后置于装有石英砂的黑色塑料盆中萌发,每盆6株,前期培养条件为:16 h光期/8 h暗期;光照强度100 μmol·m-2·s-1;相对湿度75%;温度25℃。培养35 d后对植株进行弱光和外源H2S供体硫氢化钠(NaHS:500 μM)处理,详细处理如表1,其余培养条件均不变。每处理3个重复,7 d后测定高羊茅植株的形态和生理指标。
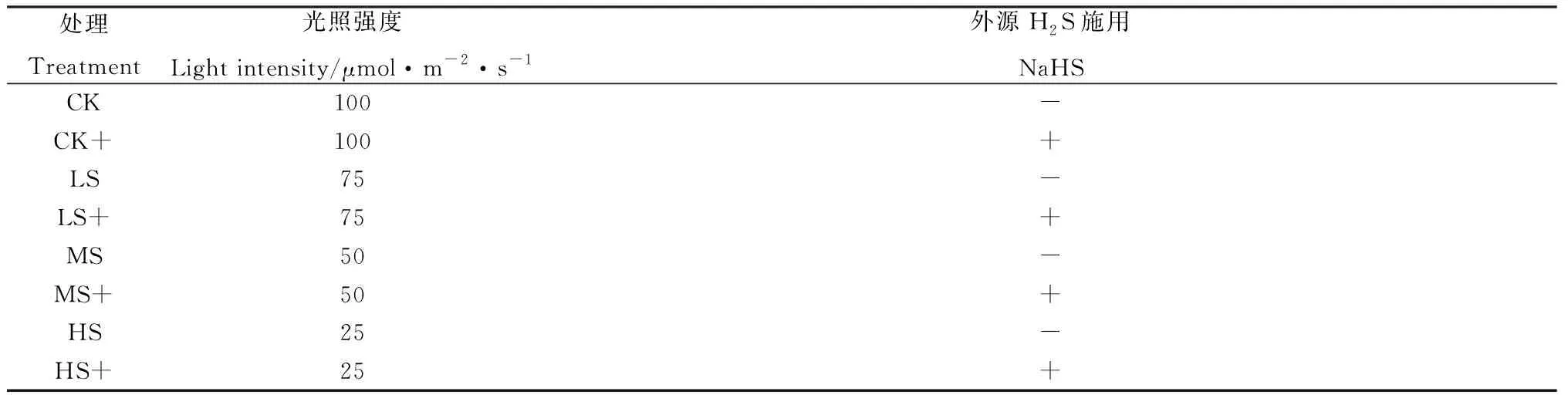
表1 外源H2S对不同弱光胁迫下高羊茅幼苗处理情况Table 1 Effects of exogenous H2S on tall fescue under different low light stress
1.2 测定项目及方法
每个处理选取高度和长势适中的植株,测量株高、叶宽和分蘖数[13];每个处理选取完整的植株,分别取每株植物的地上和地下部分,于105℃杀青30 min,70℃下烘干至恒重后测定其干重,其对应比值为根茎比[11];叶绿素含量的测定采用乙醇提取法[14];丙二醛含量的测定采用硫代巴比妥酸法[14];膜透性采用电导法测定[15];内源激素脱落酸(Abscisic acid,ABA)和赤霉素(Gibberellin,GA)含量测定采用酶联免疫法[16],内源硫化氢含量采用亚甲基蓝法测定[17]。
1.3 数据处理与分析
试验数据通过Excel 2016对原始数据进行整理,采用SPSS 22.0统计软件进行方差分析,采用One-way ANOVA进行单因素方差分析,在P值为0.05的差异显著水平下进行检测,如果差异显著,用Duncan’s新复极差法对平均值进行多重比较,采用SigmaPlot 12.5绘图。
2 结果与分析
2.1 外源H2S对不同弱光胁迫下高羊茅形态的影响
弱光处理能够减少高羊茅分蘖,降低植株高度和叶片宽度,且仅对株高作用达到显著差异水平(P<0.05)。外源H2S处理能够增加LS和MS胁迫下高羊茅的株高、分蘖和叶宽,降低CK处理下高羊茅的分蘖和HS处理下的叶宽和株高。由表2可知,与LS,MS和HS相比,高羊茅的株高在LS+和MS+处理下增加12.02%和37.00%,而在HS+处理中下降16.72%;分蘖数在LS+,MS+和HS+处理下分别增加了71.43%,14.29%和16.67%;叶宽在LS+,MS+处理下增加了9.51%和3.85%,而在HS+处理中下降15.87%。由此可知,外源H2S能够缓解LS和MS处理下弱光胁迫对高羊茅株高、分蘖和叶宽的影响,而对HS无明显作用。
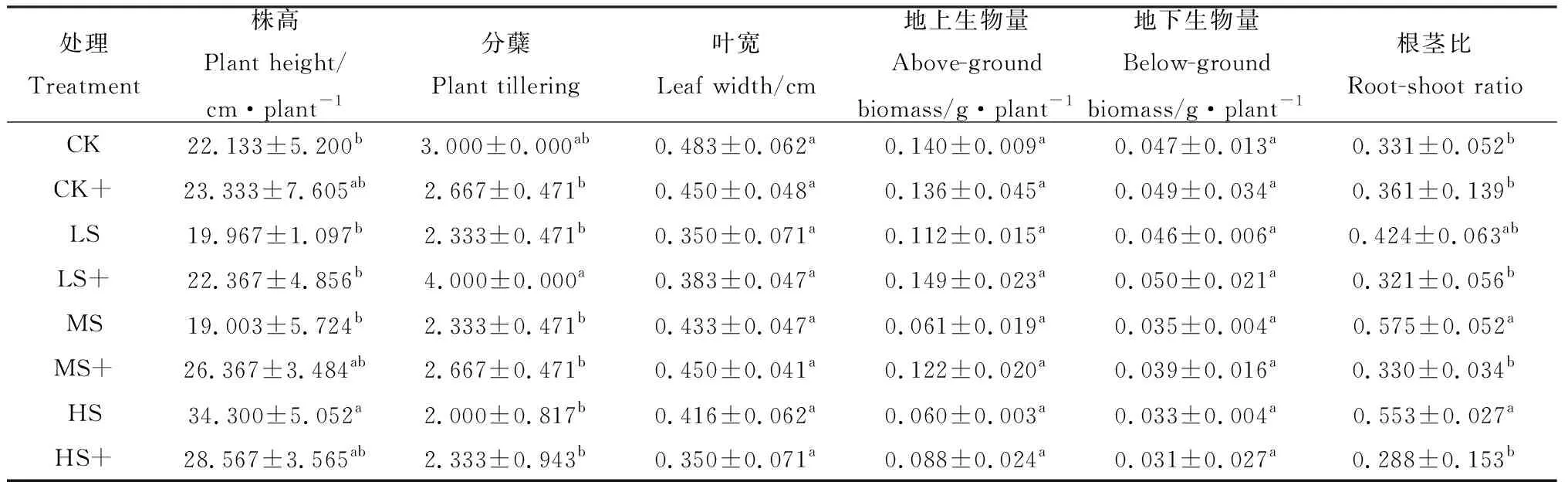
表2 外源H2S对不同弱光胁迫下高羊茅幼苗形态和生物量的影响Table 2 Effects of exogenous H2S on morphological characteristics and biomass of tall fescue under different low light stress
2.2 外源H2S对不同弱光胁迫下高羊茅生物量的影响
随着光照强度的减小,高羊茅幼苗地上生物量和地下生物量也随之减少(表2)。与LS,MS和HS相比,施加外源H2S能够提高LS+,MS+和HS+处理下的地上生物量,分别提高33.04%,99.51%和45.94%;同时,外源H2S也能够提高CK,LS和MS处理下的地下生物量,分别提高3.62%,8.70%和11.42%,而对HS处理下无明显作用;高羊茅的根茎比随着光照强度的降低呈现升高趋势,而喷施外源H2S的会减小LS,MS和HS处理下的根茎比。由此看出,外源H2S的施加使高羊茅幼苗的生物量在LS和MS处理下均有增加,在HS处理下效果不明显。
2.3 外源H2S对不同弱光胁迫下高羊茅光合色素的影响
随着光照强度的减弱,高羊茅光合色素含量呈现先升高后降低的趋势,与不加外源H2S处理相比,叶绿素a,b和叶绿素总含量在CK+,LS+和HS+处理下均增加,而在MS+处理下含量下降。相反,类胡萝卜素含量在LS和MS处理下施加外源H2S时下降,分别降低了1.78%和8.19%。随着遮荫程度的增强,高羊茅对弱光逆境表现出更强的抗性(图1)。
2.4 外源H2S对不同弱光胁迫下高羊茅细胞膜透性的影响
植物细胞的相对电导率的大小和丙二醛含量可以反映植物细胞膜受伤害的程度。高羊茅叶片中的电解质渗透率和丙二醛含量随着光强减弱显著增大(图2),且外源H2S处理降低了高羊茅细胞膜相对电导率和丙二醛含量(P<0.05),与不加外源H2S处理相比,相对电导率在CK+,LS+,MS+和HS+分别降低了16.47%,28.42%,0.91%和15.52%,丙二醛含量分别降低了8.01%,11.40%,11.24%和8.99%。说明弱光导致高羊茅叶片细胞膜过氧化,生物膜结构遭到破坏,而外源H2S能够降低由弱光胁迫引起的细胞膜过氧化伤害。
2.5 外源H2S对不同弱光胁迫下高羊茅激素含量的影响
弱光胁迫能够显著增加高羊茅内源ABA和H2S含量,降低GA含量。同时,外源性H2S与弱光胁迫的交互作用对高羊茅体内内源激素含量的变化具有极显著作用(P<0.01)。与不加外源H2S处理相比,高羊茅体内ABA含量在LS+和MS+处理下增加64.71%和3.48%,而内源H2S含量则在CK+,LS+和MS+光照胁迫下分别增加了35.31%,0.24%和22.27%,GA含量在CK+,MS+和HS+处理下增加7.20%,12.90%和11.05%。结果表明弱光胁迫下,施加外源H2S能够促进GA和内源H2S的合成,对ABA的合成呈现先促进后抑制的现象(图3)。
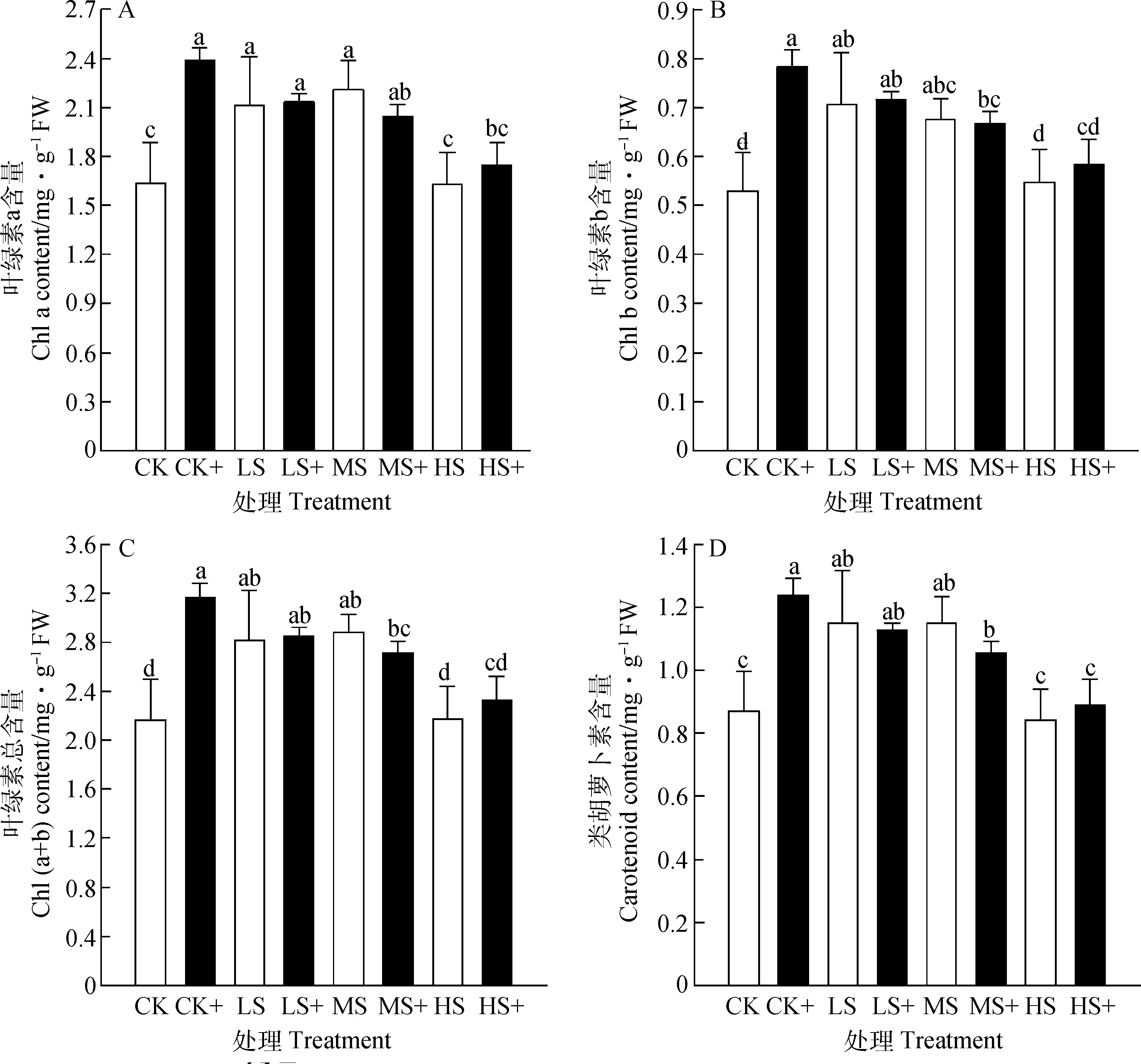
图1 外源H2S对不同弱光胁迫下高羊茅光合色素的影响Fig.1 Effects of exogenous H2S on chlorophyll concentration of tall fescue under different low light stress
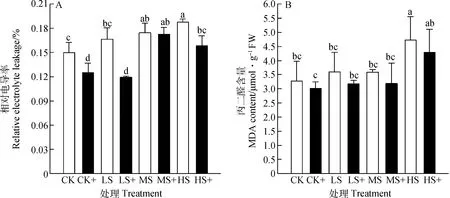
图2 外源H2S对不同弱光胁迫下高羊茅细胞膜透性的影响Fig.2 Effects of exogenous H2S on cell membrane permeability of tall fescue under different low light stress
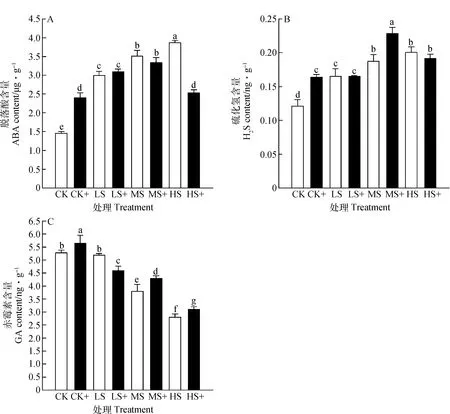
图3 外源H2S对弱光胁迫下高羊茅内源激素的影响Fig.3 Effect of exogenous H2S on the endogenous hormone content of tall fescue under different low light stress
3 讨论
光作为环境因素影响着植物的各个方面,前期研究结果表明光照强度下降会导致草坪草的形态特征、生物量和生理生化发生明显改变[18-21]。随着遮荫强度不断增加,一些草坪草不能正常生长,甚至死亡[20]。本试验结果显示,遮荫条件下高羊茅的分蘖减少,株高、叶宽、地上生物量和地下生物量均下降,这与前期的研究结果一致[22]。外源H2S作为一种气体信号分子,可以减小弱光胁迫对植株造成的伤害,施加外源H2S能够减少LS和MS遮荫强度下的高羊茅幼苗分蘖、株高和叶宽的降低,但对HS处理无明显缓解作用,可能是重度遮荫已经超过外源H2S的调节范围。
叶绿素在光合作用中负责吸收和传递光量子,而类胡萝卜素起保护叶绿素、延缓叶绿素快速分解等作用,是大多数植物的重要光合色素[23]。本试验表明,适度弱光胁迫能够增加高羊茅叶绿素a和叶绿素b的含量,同时喷施外源硫化氢能够提高对LS和HS遮荫胁迫下高羊茅叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量,而在MS遮荫强度下高羊茅幼苗叶绿素含量合成受到抑制,这与前人研究结果一致[35-36],喷施外源硫化氢能够减少弱光胁迫对高羊茅植株光合系统的伤害,促进高羊茅叶片对光能的吸收和利用。以上研究结果表明,在一定遮荫强度下,高羊茅对弱光胁迫表现出抗性,这与前人研究结果相似[24]。可能原因是施加外源H2S能够保护叶绿体结构的完整性,有助于维持高羊茅叶片较高的叶绿素含量,促进遮荫胁迫下高羊茅叶片保持较高的光合速率[25],且叶绿素b含量提高有利于高羊茅叶片捕光能力的增强,吸收更多光能[26]。
MDA是植物细胞发生膜脂过氧化的主要产物,通常利用MDA含量来衡量细胞膜发生膜脂过氧化的程度和植物对外界胁迫应答的强弱[27]。弱光胁迫导致抗氧化系统酶的活性降低,活性氧大量积累,导致细胞膜完整性受到破坏,细胞膜透性增加。本试验中,弱光胁迫导致高羊茅叶片的相对电导率和MDA含量显著增加,而外源H2S处理能够显著缓解弱光处理所导致的这种变化,降低相对电导率,抑制MDA的合成,这与前人研究结果相似[37]。由此说明,外源H2S对弱光胁迫下的高羊茅细胞膜具有一定的保护作用。
植物内源激素对植物的生长发育起着重要作用,植物生理生化活动受多种植物激素综合作用[28],且不同种类的植物激素有相互促进或者拮抗的效果。在非生物胁迫反应中,H2S与脱落酸、乙烯、赤霉素等不同植物激素的相互作用起着重要的作用[29]。前期研究报道,遮荫环境能够降低植物体内GA的含量,提高ABA的含量[30]。本试验表明,不同弱光胁迫处理抑制了GA的合成,而促进了ABA和内源性H2S的合成,这与遮荫胁迫下油用牡丹(PaeoniaSect.MoutanDC.)研究结果一致[31]。施加外源H2S后,随着光照强度的减弱,外源H2S对ABA的作用由促进转为抑制,可能同响应干旱胁迫效应一样,ABA受体编码基因的表达受外源H2S的调节而变化[32],显著提高ABA含量,从而增强高羊茅耐荫性。同时,在一定程度弱光胁迫下施加外源H2S促进了GA的合成,这可能与硼胁迫下番茄(SolanumlycopersicumL.)在GA和H2S两种激素共同调节下提高其抗性的研究相似[33];本研究中喷施外源H2S后高羊茅内源H2S含量增加,这与在玉米(ZeamaysL.)幼苗的研究中施加外源H2S后内源H2S含量增加的结果相符合[34],这可能与植物体内激素系统平衡调节和响应机制有关。近些年,关于外源性H2S在冷胁迫、热胁迫、重金属胁迫等的研究较多,但关于遮荫胁迫下,H2S与ABA等激素在植物中的信号作用关系鲜有报道,深入探究H2S在调节激素相关信号通路中的作用,对进一步深入了解植物代谢的激素调节意义深远。
4 结论
外源H2S在光照强度为50 μmol·m-2·s-1和75 μmol·m-2·s-1条件下能提高高羊茅株高、分蘖和叶宽,增加生物量,降低细胞膜透性,减少膜质过氧化产物MDA的积累,提高ABA含量,从而缓解由弱光胁迫引起的伤害,提高了高羊茅的耐荫性。因此,H2S可能作为一个信号分子在适度的弱光胁迫下能提高高羊茅的耐荫性,研究结果对耐荫高羊茅新品种选育提供理论基础,同时也对遮荫下高羊茅草坪管理提供指导意义。
