V2O5在低共熔溶剂中的存在形态
2021-12-09王道祥汝娟坚黄皓铭程明强付自碧
王道祥,汝娟坚,黄皓铭,程明强,付自碧
(1.攀钢集团研究院有限公司 钒钛资源综合利用国家重点实验室,四川攀枝花 617000;2.昆明理工大学 冶金与能源工程学院,云南昆明 650093)
低共熔溶剂(DESs)是由氢键相互作用形成的独特多组分溶剂体系,由于其具有合成工艺简单、物化性质稳定、熔点低等优点,目前已被广泛应用于多个领域,如有机合成、材料制备、生物催化等[1]。低共熔溶剂对多种金属氧化物(PbO、Sb2O3、Cu2O、ZnO等)均具有良好的溶解性能,从而使其在浸出、选择性分离、金属提取方面显示出独特优势[2-4]。目前,金属氧化物在低共熔溶剂中的存在形态受到关注[5-7]。在尿素-氯化乙酰胆碱低共熔溶剂体系中,尿素和Cl-作为配体与ZnO配位形成[ZnClO·urea]-,从而实现ZnO在该体系中溶解[1];在尿素-1-烯丙基-3-甲基咪唑氯盐低共熔溶剂中,尿素及Cl-与ZnO配位形成[ZnClO·urea]-[8];Cu2O在氯化胆碱-尿素低共熔溶剂中则以{[Cu2O·m(NH2)2CO]·nCl-}n-形式存在[9];在PbO-ChCl-urea体系中,通过控制电流密度可实现不同形貌和粒度铅粉的制备,PbO在该体系中以{[PbO·CO(NH2)2]·Cl-}-形式存在[10-11]。
试验研究了V2O5在ChCl-urea DES体系中的溶解度,同时采用电喷雾质谱和傅里叶红外光谱等手段,结合杂化轨道理论,探讨了V2O5在ChCl-urea DES体系中的存在形态,以期为以ChCl-urea DES作电解质从V2O5中电沉积制备金属钒提供技术参考。
1 试验部分
1.1 试验原料及设备
氯化胆碱(ChCl,98%),乙二醇(EG,≥99%),五氧化二钒(V2O5,99%),均为市售产品,购自上海阿拉丁生化科技股份有限公司。
恒温磁力搅拌器(上海鑫玉仪器有限公司,ZNCL-GS型),真空干燥箱(上海精密仪器仪表有限公司,DZF-6020型),电感耦合等离子体发射光能谱仪(北京吉天仪器有限公司,ICP5000型),红外光谱仪(德国布鲁克光谱仪器公司,VERTEX 70型),电喷雾质谱仪(美国菲尼根公司,Q-TOF型)。
1.2 ChCl-urea DES的合成
首先,分别将氯化胆碱和尿素在真空干燥箱中于80 ℃下干燥24 h,然后按物质的量比1∶2置于锥形瓶中,于恒温加热磁力搅拌器中在80 ℃和500 r/min下加热搅拌24 h,获得无色透明ChCl-urea DES,最后将其置于真空干燥箱中在80 ℃下干燥12 h,密封备用。
1.3 V2O5-ChCl-urea溶液的合成及表征
首先,将过量V2O5粉末加入到ChCl-urea DES中,然后在80 ℃和500 r/min条件下恒温加热搅拌72 h至V2O5溶解达平衡。取静置后的上清液,用电感耦合等离子体发射光谱法测定其中钒含量,确定V2O5在ChCl-urea DES中的溶解度。
将V2O5粉末按一定物质的量比加入到ChCl-urea DES中,然后在80 ℃和500 r/min条件下恒温加热搅拌72 h得到无色透明溶液,用红外光谱仪和电喷雾质谱仪表征V2O5-ChCl-urea溶液。
2 试验结果与讨论
2.1 V2O5在ChCl-urea中的溶解性
采用ICP-AES测定了ChCl-urea-V2O5中元素钒的含量,经分析可知,V2O5在ChCl-urea DES中的溶解度约为0.114 5 mol/L。由于V2O5粉末在其中的溶解度相对较大,因此,在电化学还原V2O5提取钒过程中,可尝试采用溶解-电沉积方式还原V2O5。
2.2 电喷雾质谱分析
ChCl-urea DES与V2O5-ChCl-urea溶液电喷雾质谱分析结果如图1、2所示。可以看出:在质荷比分别约为174.42和315.20位置,出现了2组明显的峰。ChCl-urea DES中可能存在由胆碱阳离子[C5H14NO]+与Cl-交替连接形成的低聚体(…Cl-—[C5H14NO]+—Cl-—[C5H14NO]+—Cl-…),[C5H14NOCl2]-和[(C5H14NO)2Cl3]-基团的相对分子质量分别为175和314.5,与图1中2组峰的位置(174.42和315.20) 吻合得非常好,因此,推测这2组峰分别对应[C5H14NOCl2]-和[(C5H14NO)2Cl3]-,这与文献[12]报道的也很相似。由图2看出:当V2O5溶于ChCl-urea DES后,在质荷比为153.67位置出现1组新峰,但相较于[C5H14NOCl2]-和[(C5H14NO)2Cl3]-基团,这组峰的强度较弱。根据文献[13]可知,金属氧化物易与低共熔溶剂中的Cl-发生配位形成配离子,从而使得氧化物能够溶解于其中。结合文献[14]推断,V2O5溶于ChCl-urea DES后形成的配合物可能为[VO2Cl2]-,其相对分子质量为153.85,即质荷比为153.85。与V2O5-ChCl-urea溶液对比发现,质荷比在153.85左右的位置确实出现了1组新峰,因此,可以得出,V2O5在ChCl-urea DES中通过与Cl-配位形成了配阴离子[VO2Cl2]-,反应式为

(1)
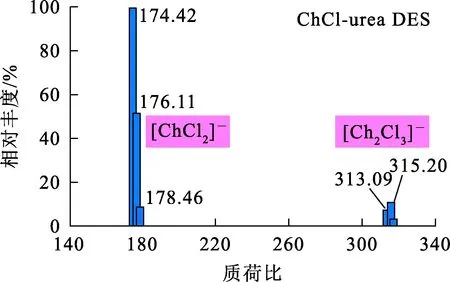
图1 ChCl-urea DES中负离子的电喷雾质谱分析结果
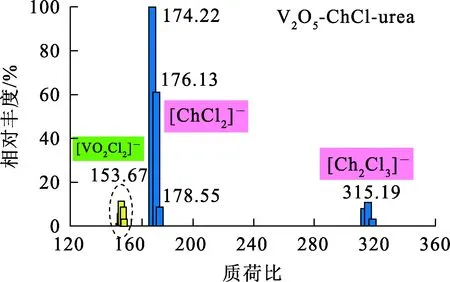
图2 V2O5-ChCl-urea溶液中负离子的电喷雾质谱分析结果
2.3 红外光谱分析
ChCl-urea DES和V2O5-ChCl-urea溶液的FT-IR分析结果如图3所示。可以看出:V2O5溶于ChCl-urea DES后,在2 366 cm-1位置出现新特征峰。V2O5溶解于ChCl-urea DES后,由于氯原子与钒原子之间的电负性差异较大,导致[VO2Cl2]-中V—Cl键的偶极矩发生变化,从而使体系红外光谱出现谱带强度变化。这表明,V2O5-ChCl-urea溶液中形成的[VO2Cl2]-可能破坏了ChCl-urea DES原有的结构,使得在2 366 cm-1位置的红外光谱特征峰强度显著增大。综上所述,由于[VO2Cl2]-中V(Ⅴ)—Cl键的伸缩振动,引起了2 366 cm-1位置的特征峰。
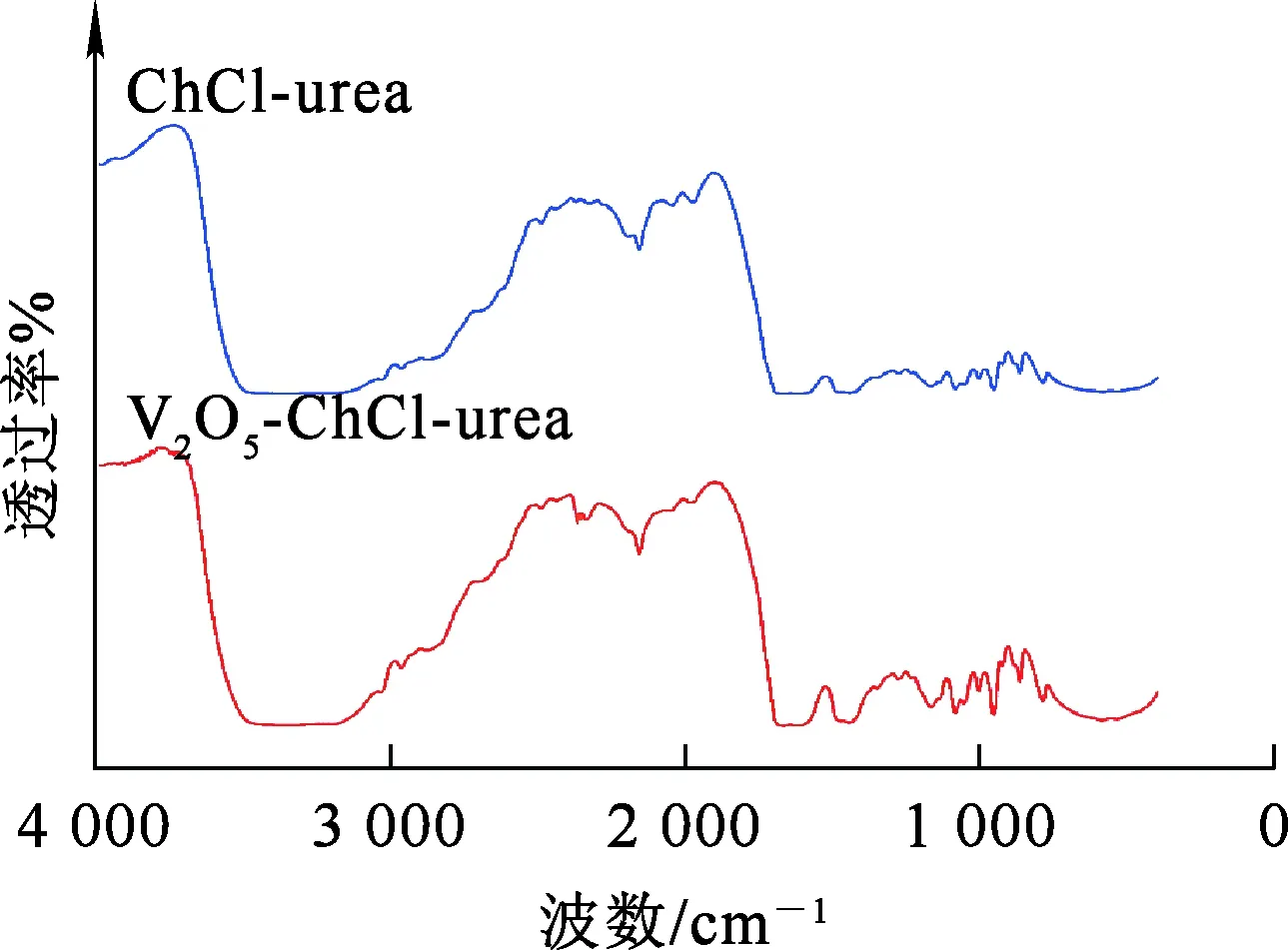
图3 ChCl-urea DES和V2O5-ChCl-urea溶液的红外光谱
2.4 V2O5在ChCl-urea中的存在形态
根据杂化轨道理论,[VO2Cl2]-的空间结构如图4所示。
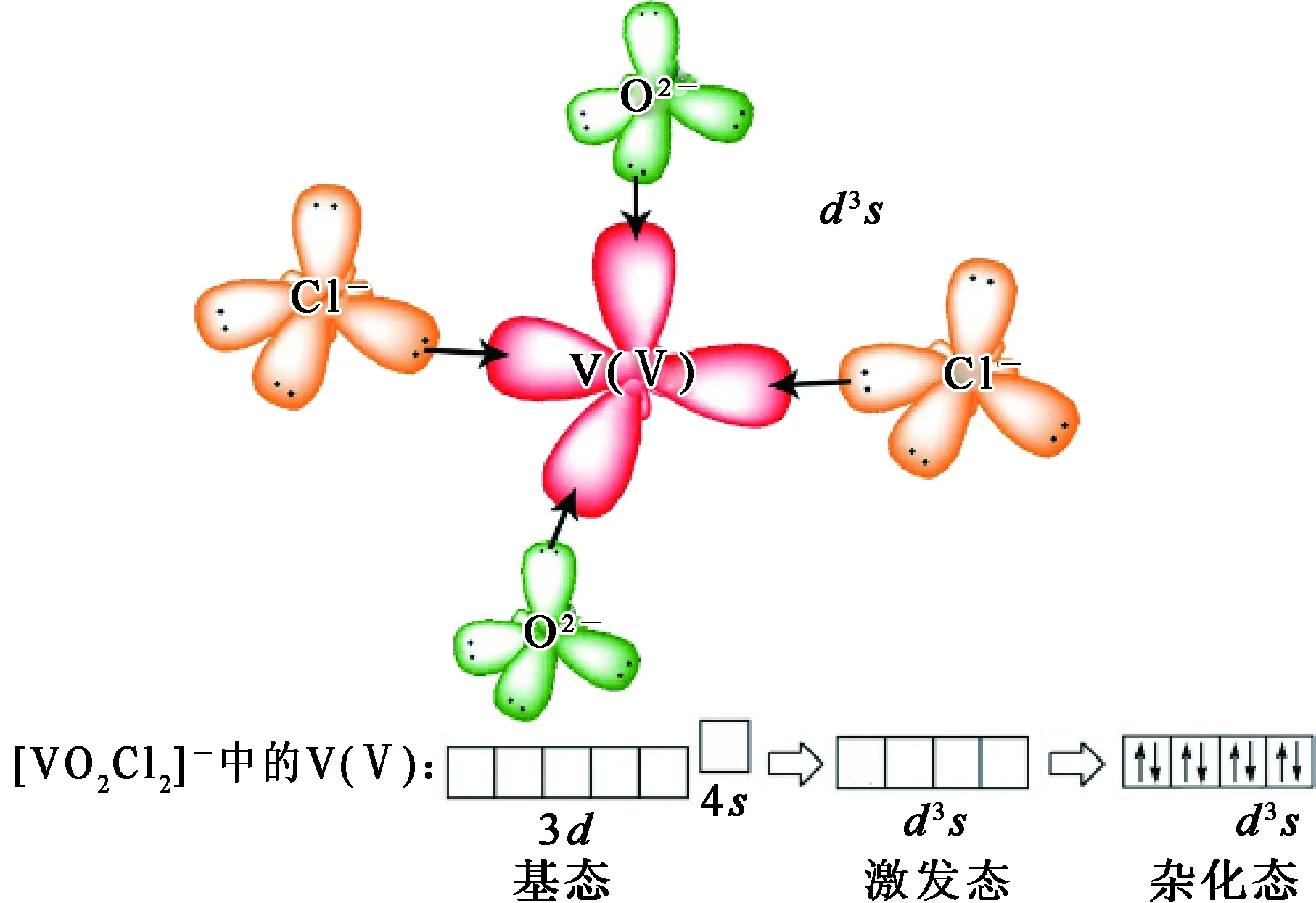
图4 [VO2Cl2]-中V(Ⅴ)的杂化轨道示意
由图4看出:在V(Ⅴ)最外层的3d和4s轨道上无电子填充,因此V(Ⅴ)最外层的3个3d轨道,即3dxy、3dyz及3dxz,和1个4s轨道经d3s杂化后形成4个能量相等、成分相同的杂化轨道。这4个新形成的轨道的空间结构为四面体形,且每个d3s杂化轨道都含有3/4d和1/4s成分。值得注意的是,在这种新形成的电子排布中,由2个Cl-和2个O2-提供的孤对电子来填充4个空轨道,因此,在这4对孤对电子与V(Ⅴ)键合后形成了四面体结构。V2O5在ChCl-urea DES中形成了以V(Ⅴ)为中心的四配位配阴离子[VO2Cl2]-,这与电喷雾质谱分析结果相吻合。
图5为2个Cl-和2个O2-通过给出孤对电子与V(Ⅴ)配位的共振结构。可以看出,在配阴离子[VO2Cl2]-中,钒的价态并未发生改变。由此可知,V2O5之所以能够溶解于ChCl-urea DES中,主要是因为Cl-、O2-与V(Ⅴ)键生成了较大的配合阴离子。另外,前期研究结果[15]表明,随ChCl-urea DES中V2O5浓度提高,溶液黏度显著增大,电导率反之。当不断向低共熔溶剂中加入V2O5粉体后,便形成了阴离子[VO2Cl2]-,其离子浓度也随之提高。但此时低共熔溶剂中的Cl-和O2-则由于被不断消耗而浓度减小。由于配合阴离子[VO2Cl2]-的空间体积要远大于单个Cl-和O2-体积,这将导致体系浓度减小,溶液黏度增大,从而电导率减小。因此,在V2O5-ChCl-urea溶液中电沉积制备金属钒时,应选择恰当的V2O5浓度才有利于提高还原过程的电流效率。
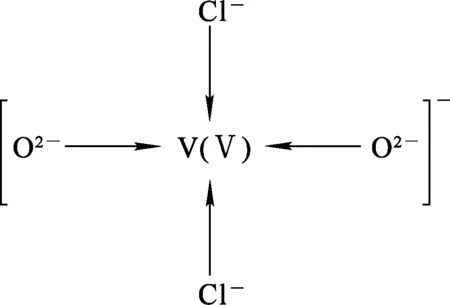
图5 V2O5-ChCl-urea溶液中[VO2Cl2]-的共振结构
3 结论
V2O5在ChCl-urea DES中的溶解度为0.114 5 mol/L,因此可用溶解—电沉积方式还原V2O5。电喷雾质谱和傅里叶红外光谱分析结果表明:在ChCl-urea DES中,V2O5与Cl-之间形成了[VO2Cl2]-,是通过d3s杂化与2个Cl-及2个O2-提供的孤对电子形成以V(Ⅴ)为中心的四配位[VO2Cl2]-的。
