胶孢炭疽菌侵染橡胶树叶片染色方法的建立及显微观察
2021-12-08龙明滕,梁晓宇,杜艳楠,邹丽君,张宇,王萌
龙明滕,梁晓宇,杜艳楠,邹丽君,张宇,王萌

摘 要:本研究建立了一种橡胶树叶片中胶孢炭疽菌的染色方法,通过显微观察明确胶孢炭疽菌在橡胶树叶片中的侵染结构,为橡胶树炭疽病的预测预报提供理论依据。在脱色剂(0.15%三氯乙酸乙醇溶液∶氯仿=5∶1)处理12 h,1%刚果红染色剂抽滤染色3 h的条件下,能清晰观察到胶孢炭疽菌在橡胶树叶片上的发育进程和侵染结构。结果表明,在28 ℃、100%相对湿度培养条件下,接种橡胶树淡绿期叶片2~6 h为分生孢子萌发高峰期,12 h后分生孢子萌发率大于85%;8~12 h为附着胞形成高峰期,接种12 h约75%的芽管顶端产生附着胞,少数附着胞中央部位開始形成侵染钉;24 h为侵染钉形成高峰期,同时分生孢子萌发形成多个芽管;36 h时附着胞顶端再次萌发产生次级附着胞,从而进一步侵染周围细胞,叶片出现零星病斑;48 h时芽管不断分支异化成菌丝并产生次级分生孢子,叶片出现大量典型的炭疽病病斑;72 h后菌丝在叶片表面纵横扩展,随机分支,逐步形成网状分布。随着菌丝的扩展,叶片组织发生一系列的病理变化,侵染部位组织出现褐色坏死病斑。本研究建立了一种着色效果好,简便易行,经济有效的橡胶树叶片中胶孢炭疽菌的染色方法,进一步明确了胶孢炭疽菌的侵染结构。
关键词:橡胶树;炭疽病;胶孢炭疽菌;染色方法;侵染结构
中图分类号:S763.7 文献标识码:A
Establishment of Staining Method and Microscopic Observation of Rubber Tree Leaves Infected by Colletotrichum gloeosporioides
LONG Mingteng1, LIANG Xiaoyu1,2, DU Yannan1, ZOU Lijun1, ZHANG Yu1,2*, WANG Meng1,2*
1. School of Plant Protection, Hainan University, Haikou, Hainan 570228, China; 2. Key Laboratory of Green Prevention and Control of Tropical Plant Diseases and Pests, Ministry of Education, Haikou, Hainan 570228, China
Abstract: The infection structures of Colletotrichum gloeosporioides on rubber trees would be clarified through microscopic observation to provide scientific basis for the anthracnose prediction in rubber trees. After rubber trees leaves treated with decolorizing agent (0.15% trichloroacetic acid-ethanol solution∶chloroform, 5∶1) for 12 h and 1% Congo red staining agent for 3 h, the developmental process and infection structure of C. gloeosporioides infection were clearly observed. Under the inoculation condition of 28 ℃ and 100% humidity, the crest-time of conidial germination was within 2-6 h after inoculated in rubber tree leaves at the light green phase. More than 85% of conidia were germinated after 12 h inoculation. The crest-time of appressorium formation was within 8-12 h after inoculation. About 75% germ tubes generated appressoria and appressoria began forming infection pegs after 12 h inoculation. The crest-time of infection pegs formation was at 24 h inoculation, while several germ tubes formed at the other top of the germinal conidium. The appressorium germinated to produce secondary appressorium, which further infected surrounding cells and caused leaves sporadic lesions at 36 h inoculation. After 48 h inoculation, Germ tubes of abundant branched differentiated into hyphae, some of which produced secondary conidia on the top. A large number of typical anthracnose spots formed. The hyphae spread vertically and horizontally on the leaf surface and gradually formed a net-like distribution after 72 h inoculation. As the hyphae expanded, a series of pathological changes occurred in the leaf tissue. In this study, a method for staining C. gloeosporioides in rubber tree leaves with good staining effects, simplicity, and efficiency was established, which further clarified the infection structures of C. gloeosporioides.
Keywords: rubber tree; anthracnose; Colletotrichum gloeosporioides; staining method; infection structure
DOI: 10.3969/j.issn.1000-2561.2021.10.031
巴西橡胶树(Hevea brasiliensis)起源于亚马逊河流域,后成功引进我国,成为我国天然橡胶的唯一来源,是我国重要的战略资源[1-2]。然而在天然橡胶生产过程中,病害一直是制约产量的重要因素。由胶孢炭疽菌(Colletotrichum gloeosporioides)引起的炭疽病是橡胶树的重要病害之一[3],可侵染橡胶树嫩叶、叶柄、嫩梢等多个部位,危害苗圃小苗、大田幼树直至成龄开割胶树,引起嫩叶脱落、嫩枝干枯等,导致开割延迟,造成重大产量损失。关于橡胶树炭疽病的研究,国内外学者对病原菌分类、生物学特性[4]、群体遗传分析[5]、致病机理[6]、基因表达调控[7]、防治药剂筛选[8]等方面进行了诸多研究,而关于侵染动态的研究只局限于离体疏水表面诱导橡胶树炭疽菌发育分化过程[9],该病原菌侵染橡胶树叶片的显微过程尚未报道。橡胶树炭疽菌发育进程和侵染结构的显微观察是一项重要的组织病理学研究内容,组织染色法是研究叶部真菌病害的组织病理学侵染过程最为经典的方法,杨树、草莓、洋葱、芒果等植物炭疽病菌的组织染色方法已有报道[10-13],但由于橡胶树叶片有较厚的蜡质层和分泌乳胶的特点,这些方法对橡胶树叶片真菌病害研究存在内部菌丝不易着色,染色时间长等缺点。常用的真菌染色方法有台盼蓝、苯胺蓝、苏木素-伊红染色、高碘酸-无色品红染色、六胺银染色、改良革兰氏染色等,这些染色方法存在染色时间不易把控、容易过染,病原菌与叶片组织对比不明显且操作繁琐等缺点[14-16]。Hoechst/Propidiu?mide双荧光染色法能够直接观察病原菌在寄主组织中的位置,还能提供寄主细胞活力等信息,但荧光染色的高昂费用限制了其在田间病原菌检测的大规模应用[17-18]。此外,荧光染色剂存在荧光淬灭现象,荧光强度持续时间不长,植物的自发荧光也会影响染色效果[19-20]。本研究将建立一种着色效果好,简便易行,经济有效的橡胶树胶孢炭疽菌染色方法,对胶孢炭疽菌的发育进程和侵染结构进行显微观察,为进一步揭示橡胶树炭疽病病害的发生发展规律,对掌握其病害流行规律及预测预报具有重要意义,同时可为该病害的有效防控提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试品种 供试橡胶树品系采自中国热带农业科学院橡胶研究所培育的巴西橡胶树品种‘热研7-33-97,种植于海南大学(儋州校区)试验基地。
1.1.2 供试菌株 供试菌株为本实验室分离纯化并鉴定的橡胶树胶孢炭疽菌(Colletotrichum siamense)菌株HN-23。
1.1.3 供试药剂 台盼蓝、刚果红购于北京索莱宝科技有限公司,苯胺蓝购于上海麦克林生化科技有限公司,三氯乙酸和分析纯试剂氯仿、乙醇等购自广东光华科技股份有限公司。
1.1.4 培养基 马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂粉15 g,加水定容到1000 mL,121 ℃高压湿热灭菌20 min。
马铃薯葡萄糖液体培养基(PDB):不含琼脂粉,其他同PDA培养基。121 ℃高压湿热灭菌20 min。
1.2 方法
1.2.1 分生孢子悬浮液制备 选择PDA平板上生长4~6 d的炭疽菌菌落,用打孔器打取直径为5 mm的胶孢炭疽菌菌碟,接入PDB培养基中,28 ℃摇培3 d至产生大量分生孢子,经4层无菌纱布过滤,12 000 r/min离心浓缩,弃上清液,加入适量无菌水,涡旋振荡,摇匀,用血球计数板计数,制备浓度为106个/mL的分生孢子悬浮液备用。
1.2.2 接种方法 采集健康的不同时期橡胶树叶片,用蒸馏水冲洗干净,无菌水漂洗3次。用喷壶将分生孢子悬浮液均匀地喷到叶片表面,使液滴刚好滴下,接种后,将叶片放置于垫有湿润纱布保鲜盒中,叶柄处包裹无菌水脱脂棉。置于28 ℃、相对湿度100%的人工气候箱中培养。
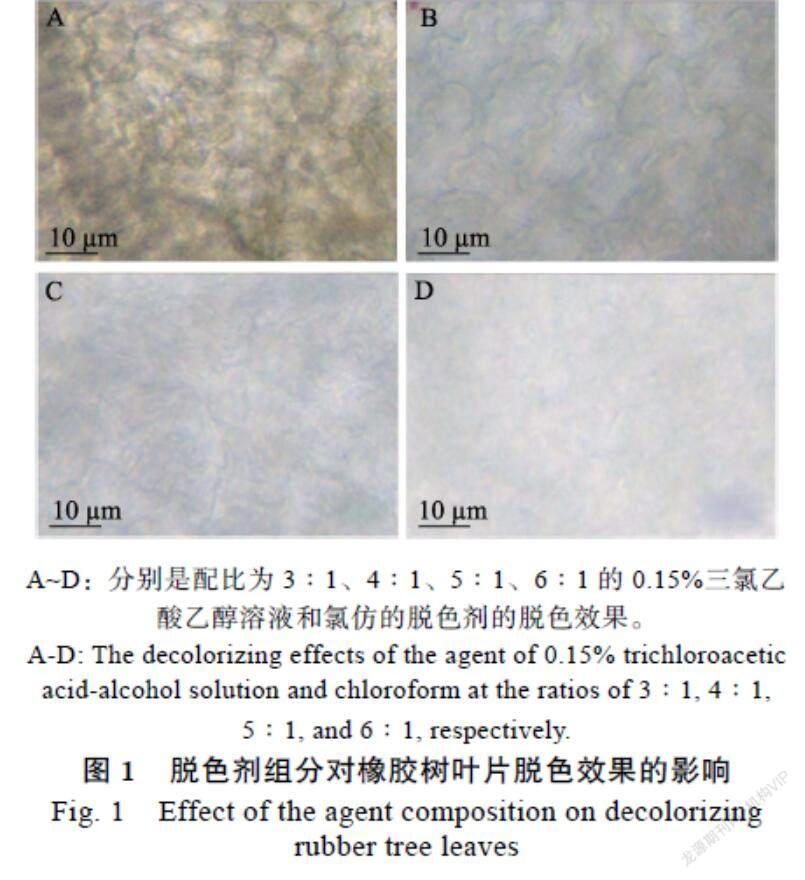
1.2.3 脱色剂组分与脱色时间优化 采集古铜、淡绿、成熟3个时期的健康橡胶树叶片,用蒸馏水冲洗干净,无菌水漂洗3次。参考Knight等[21]的脱色方法,将0.15%三氯乙酸乙醇和氯仿按不同体积比(3∶1、4∶1、5∶1、6∶1)混合制成脱色剂,对橡胶树叶片分别脱色5、10、12、15、20 h,将叶背面朝上置于载玻片上,水作浮载剂,用BDS400倒置生物显微镜观察脱色效果。
1.2.4 染色剂筛选 取接种胶孢炭疽菌的淡绿期橡胶树叶片,剪取1.5 cm × 1.5 cm的小块样品,采用张敬泽等[22]的染色方法,脱色后分别置于浓度均为1%的台盼蓝、苯胺蓝和刚果红水溶液中,真空抽滤至叶片不悬浮于染色液表面时立即观察叶片染色效果,继续静置于染色剂中2 h,显微观察分生孢子染色效果。
1.2.5 染色时间优化 取接种胶孢炭疽菌的淡绿期橡胶树叶片,脱色后置于1%刚果红水溶液中,真空抽濾直至叶片不悬浮于染色液表面,分别静置0.5、1、1.5、2、3、4 h,显微观察侵染结构。
1.2.6 胶孢炭疽菌侵染橡胶树叶片的症状及侵染结构观察 接种0、2、4、6、8、12、24、36、48、72、96、120 h的淡绿期橡胶树叶片,观察症状后采用上述最优染色条件进行染色,显微观察侵染结构。
1.3 数据处理
参照万三连等[23]的方法对试验数据进行统计分析。统计孢子萌发率,计算附着胞形成百分率。附着胞形成百分率=形成各结构孢子数/孢子统计总数×100%。
2 结果与分析
2.1 脱色剂组分和脱色时间优化
通过对比发现,当使用的脱色剂中0.15%三氯乙酸乙醇溶液和氯仿配比为3∶1时,橡胶树叶片组织脱色不彻底,配比为4∶1、5∶1、6∶1的脱色剂均有较好的脱色效果,但配比为6∶1的脱色剂需要较长的脱色时间。考虑氯仿属于易制毒化学品,故最优脱色剂组分为5∶1的0.15%三氯乙酸乙醇溶液和氯仿(图1)。最优组分脱色剂在脱色时间小于10 h时,古铜期叶片有色素残留,不利于染色观察。脱色20 h后叶片泛黄,底色不清,不利于染色观察。脱色12~15 h时染色效果最理想,色素脱色完全,叶片呈白色。考虑到时效性,本研究选择脱色时间为12 h。5∶1脱色剂脱色12 h,均能使橡胶树古铜、淡绿、成熟3个时期的叶片脱色彻底,显微观察清晰。
2.2 染色剂筛选
通过研究对比台盼蓝、苯胺蓝、刚果红3种染色剂对橡胶树叶片中胶孢炭疽菌的染色效果,结果如图2所示,台盼蓝和苯胺蓝均能够使孢子着色,但橡胶树叶脉及叶肉细胞容易着色,干扰观察视野。刚果红能使孢子着色,染色效果极佳且不容易使橡胶树叶脉及叶肉细胞着色,孢子和叶肉细胞区别明显。综合考虑操作难易程度、价格成本和毒性等因素,刚果红染色剂更适用于橡胶树叶片中胶孢炭疽菌的染色观察。
2.3 染色时间优化
为了清晰地观察胶孢炭疽菌在橡胶树叶片中的侵染结构,进一步优化了刚果红染色剂的染色时间。结果表明,当1%刚果红染色液处理时间低于2 h时,孢子、菌丝、芽管和附着胞均着色较浅,不利于發育进程和侵染结构的观察(图3A~图3D);染色3 h达到理想效果,能清楚地看到芽管和附着胞(图3E);染色4 h后着色效果没有明显的变化(图3F),染色时间的延长导致染色剂的残留。综合考虑观察的清晰度和染色效率,1%刚果红染色液处理3 h更适用于橡胶树叶片中胶孢炭疽菌的显微观察。
2.4 胶孢炭疽菌接种橡胶树叶片后侵染症状
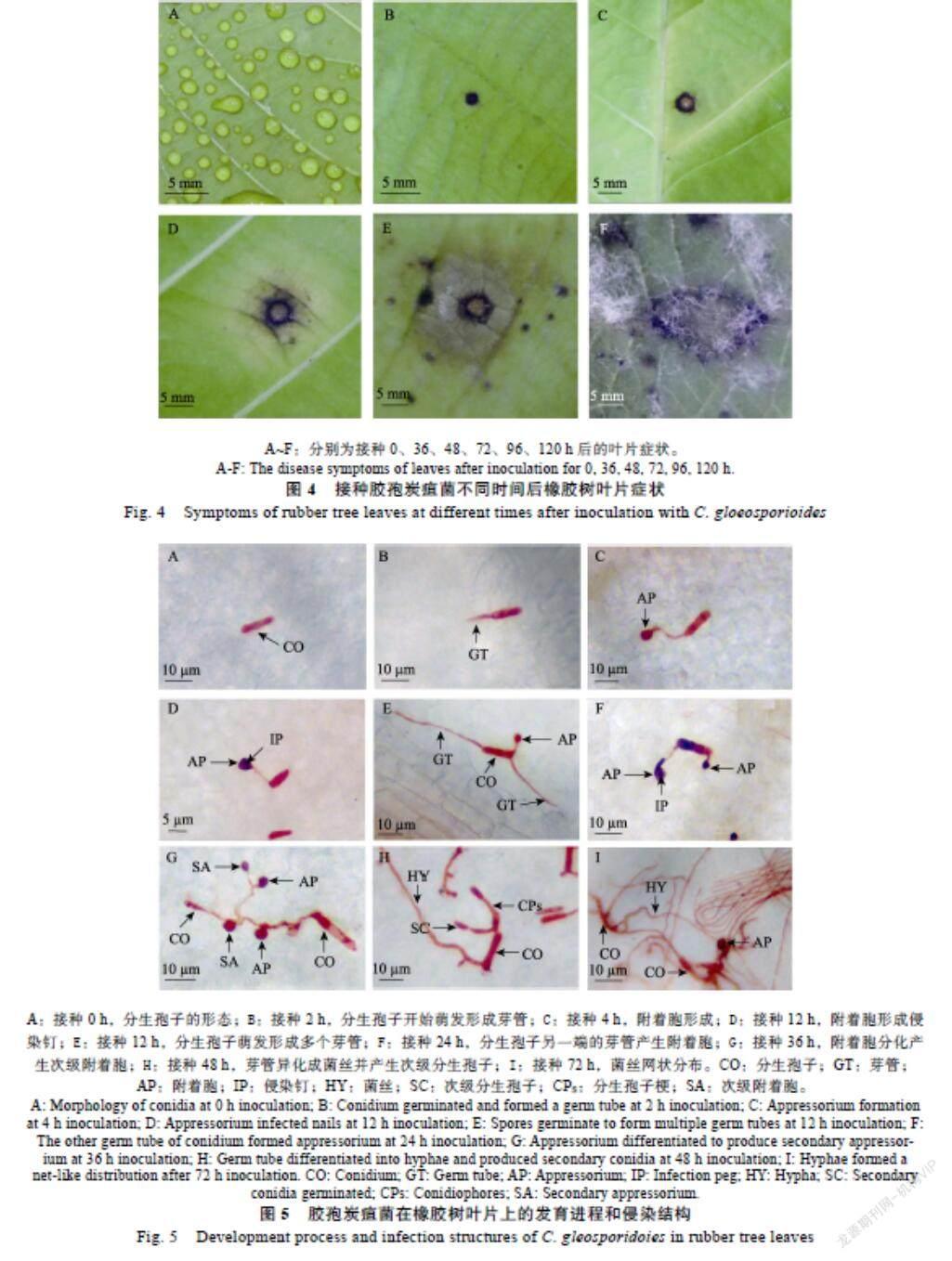
将胶孢炭疽菌接种到橡胶树叶片,持续观察,发现接种36 h,叶片开始出现肉眼可见的褐色病斑(图4B)。接种48 h病斑周围开始褪绿(图4C),接种72 h病斑逐渐扩大,叶片病斑颜色加深(图4D)。接种96 h寄主组织坏死塌陷,最终在叶表面产生典型的褐色坏死病斑(图4E)。接种120 h,在病斑周围产生肉眼可见的白色绒毛状菌丝(图4F)。
2.5 胶孢炭疽菌在寄主叶片上的发育进程及侵染结构的显微观察
胶孢炭疽菌分生孢子接种到橡胶树淡绿期叶片2 h后,28 ℃、相对湿度100%条件下培养2 h,孢子萌发形成芽管(图5B)。2~6 h为分生孢子萌发高峰期,接种12 h超过85%的分生孢子已萌发。4~8 h时孢子肿大,芽管顶端形成附着胞(图5C)。12 h时约75%的芽管顶端产生附着胞,且多在寄主表皮细胞间隙或接近间隙处。少数附着胞在中央部位形成一个黑色的圆点,即侵染钉(图5D),同时一个分生孢子可从不同部位萌发形成多个芽管,以提高病原菌侵染率(图5E)。24 h时侵染钉数量达到高峰,分生孢子另一端萌发的芽管产生附着胞(图5F)。36 h时附着胞顶端再次萌发产生次级附着胞,从而进一步侵染周围细胞(图5G)。48 h时芽管不断分枝异化成菌丝并产生次级分生孢子(图5H),72 h时菌丝在寄主叶表面纵横扩展,随机分枝,逐步形成网状分布(图5I)。
3 讨论
目前真菌侵染寄主植物的显微观察一般采用台盼蓝和苯胺蓝作为染色剂进行组织染色[24-25],但这2种染色剂容易出现过染现象,且均为致癌疑似物,对身体的伤害较大,不宜长期使用。另外台盼蓝常用于检测细胞存活率的拒染试验,只有细胞破损或者死亡,内部真菌才易着色,不适用于橡胶树炭疽菌这类半活体营养侵染型真菌的早期检测[26]。因此,本研究致力于开发一种适用于橡胶树病原菌显微观察的染色剂及染色方法。在对橡胶树叶片中胶孢炭疽菌的染色过程中,发现台盼蓝和苯胺蓝容易染色橡胶树叶脉及叶肉细胞,观察背景颜色深,干扰观察视野,不利于炭疽菌发育进程和侵染结构的显微观察。刚果红毒性低、价格便宜,作为染色剂常用于筛选产纤维素酶的真菌菌株[27],未见用于观察真菌侵染植物过程的研究报道。本研究采用刚果红染色橡胶树叶片中的胶孢炭疽菌,发现该染色剂可以使分生孢子、附着胞、侵染钉、菌丝、分生孢子梗、次级分生孢子等结构着色,染色效果好,观察背景颜色浅。另外,刚果红染色法适应性强,自然pH,无需获得荧光蛋白标记菌株,普通光学显微镜即可清楚地观察到炭疽菌的侵染动态[13],便于大田检测,对橡胶树炭疽病的早期检测有重要意义。
胶孢炭疽菌侵染途径有2种,一种是通过自然孔口(气孔、皮孔)或伤口侵入;另一种是必须依赖于病原菌独特的侵染结构——附着胞的直接侵入[28]。本研究利用刚果红染色方法成功地观察到了胶孢炭疽菌在橡胶树叶片上的第2种侵染途径,其过程如下:2 h粘附在寄主表面的分生孢子萌发产生芽管,4 h芽管顶端形成膨大的附着胞,附着胞经过一系列的细胞变化,12 h后附着胞逐渐黑化形成侵染钉,侵入叶片组织。炭疽菌与稻瘟菌一样,附着胞会积累高膨压的溶质,产生巨大的压力。Bechinger等[28]测量了C. graminicola附着胞产生的压力,发现附着胞能形成高达5 Mpa的压强,迫使侵染钉穿透寄主表面角质层和表皮细胞壁后分化成初生菌丝在表皮细胞内生长。
本研究发现胶孢炭疽菌在橡胶树上的发育进程与在其他寄主上的发育进程非常相似,但也存在一些差异。胶孢炭疽菌分生孢子在橡胶树叶片上可萌发产生多个芽管,附着胞形成后还会伴随次级附着胞的形成,大大提高其侵染率,致使橡胶树炭疽病在条件适宜的情况下便可在极短时间内暴发成灾,但胶孢炭疽菌在侵染番石榴、草莓等寄主的过程中却很少产生多个芽管及附着胞[29-30],初步分析其原因可能是橡胶树叶片表面蜡质层这一疏水结构在短时间内有利于附着胞的形成[31]。另外,橡胶树胶孢炭疽菌的分生孢子芽管顶端可以形成次级分生孢子,但没有发现次级分生孢子萌发和产生附着胞的现象。此时次级分生孢子可能处于休眠状态,于叶片残体越冬后,在雨水和气流作用下传播侵染新叶,成为翌年的初侵染源[32]。
4 结论
本研究建立了一种着色效果好,简便易行,经济有效的橡胶树叶片中胶孢炭疽菌的染色方法,进一步明确了胶孢炭疽菌的侵染结构,发现该病原菌通过分生孢子萌发形成多个芽管、附着胞、次级附着胞和次级分生孢子等侵染结构来提高其侵染橡胶树的几率。本研究结果对橡胶树炭疽病的组织病理学及流行病理学研究具有重要意义,为该病害的预测预报提供了科学依据。
参考文献
[1] 刘少军, 周广胜, 房世波. 中国橡胶树种植气候适宜性区划[J]. 中国农业科学, 2015, 48(12): 2335-2345.
[2] 刘少军, 周广胜, 房世波. 中国橡胶种植北界[J]. 生态学报, 2016, 6(5): 1272-1280.
[3] Sangu S S, Muid S. Effects of inoculum concentrations of Colletotrichum gloeosporioides on disease development and severity on leaves of rubber tree (Hevea brasiliensis)[J]. Borneo Journal of Resource Science and Technology, 2016, 6(1): 50-54.
[4] 李继锋, 刘先宝, 蔡吉苗, 等. 橡胶树炭疽病菌的鉴定及rDNA-ITS序列分析[J]. 中国农学通报, 2010, 26(12): 221-226.
[5] 林春花, 董 瑛, 刘文波, 等. 多基因序列比较分析海南橡胶树炭疽病菌遗传种群[J]. 热带作物学报, 2016, 37(5): 943-951.
[6] Cai Z Y, Li G H, Lin C H, et al. Identifying pathogenicity genes in the rubber tree anthracnose fungus Colletotrichum gloeosporioides through random insertional mutagenesis[J]. Microbiological Research, 2013, 168(6): 340-350.
[7] Liu Z Q, Wu M L, Ke Z J, et al. Functional analysis of a regulator of G-protein signaling CgRGS1 in the rubber tree anthracnose fungus Colletotrichum gloeosporioides[J]. Archives of Microbiology, 2018, 200(3): 391-400.
[8] Thaochan N, Pornsuriya C, Chairin T, et al. Roles of systemic fungicide in antifungal activity and induced defense responses in rubber tree (Hevea brasiliensis) against leaf fall disease caused by Neopestalotiopsis cubana[J]. Physiological and Molecular Plant Pathology, 2020, 111: 1-7.
[9] 林春花, 牟保輝, 刘文波, 等. 疏水表面诱导橡胶树炭疽菌侵染结构的发育分化过程[J]. 植物保护学报, 2018, 45(3): 470-477.
[10] Panday S S, Alberto R T, Labe M S. Ultrastructural characterization of infection and colonization of Colletotrichum gloeosporioides in onion [J]. Plant Pathology, 2012, 2(2): 168-177.
[11] 赵玳琳, 卯婷婷, 赵兴丽, 等. 草莓炭疽菌初期侵染过程显微观察[J]. 南方农业学报, 2016, 47(7): 1140-1145.
[12] 莫贱友, 赵 广, 李其利, 等. 杧果炭疽病病原菌侵染特性研究[J]. 中国南方果树, 2017, 46(2): 20-25.
[13] 张晓林, 张俊娥, 贺璞慧中, 等. 胶孢炭疽菌侵染杨树叶片的组织病理学研究[J]. 北京林业大学学报, 2018, 40(3): 101-109.
[14] Ryan N J, Sutherland G, Coughlan K, et al. A new trichrome-blue stain for detection of microsporidial species in urine, stool, and nasopharyngeal specimens[J]. Journal of Clinical Microbiology, 1993, 31(12): 3264-3269.
[15] Moura H, Schwartz D A, Bornay-llinares F, et al. A new and improved “quick-hot gram-chromotrope” technique that differentially stains microsporidian spores in clinical samples, including paraffin-embedded tissue sections[J]. Archives of Pathology Laboratory Medicine, 1997, 121(8): 888-893.
[16] 杨茂霞, 林国彪, 陈彩虹, 等. 胶孢炭疽菌侵染柱花草叶片的显微观察[J]. 草业学报, 2015, 24(5): 175-181.
[17] Bassi D, Cappa F, Cocconcelli P S. A combination of a SEM technique and X-ray microanalysis for studying the spore germination process of Clostridium tyrobutyricum[J]. Research in Microbiology, 2009, 160(5): 322-329.
[18] D Incecco P, Ong L, Gras S, et al. A fluorescence in situ staining method for investigating spores and vegetative cells of clostridia by confocal laser scanning microscopy and structured illuminated microscopy[J]. Micron, 2018, 110: 1-9.
[19] Bhadauria V, Miraz P, Kennedy R, et al. Dual trypan-aniline blue fluorescence staining methods for studying fungus-plant interactions[J]. Biotechnic & Histochemistry, 2010, 85(2): 99-105.
[20] 劉甜甜, 周 倩, 吴秋云, 等. 马铃薯晚疫病菌侵染的Solophenyl Flavine荧光染色方法研究[J]. 植物科学学报, 2016, 34(2): 316-324.
[21] Knight N K, Sutherland M W. Histopathological assessment of wheat seedling tissues infected by Fusarium pseudograminearum[J]. Plant Pathology, 2013, 62(3): 679-687.
[22] 张敬泽, 胡东维, 徐 同. 柿树炭疽菌侵染柿树叶柄的超微结构观察[J]. 植物病理学报, 2005, 35(5); 434-441.
[23] 万三连, 梁 鹏, 刘文波, 等. 橡胶树与白粉病菌Oidium heveae亲和互作组织细胞学研究[J]. 植物保护, 2014, 40(3): 26-36.
[24] 李富军, 张新华, 姚永花, 等. 利用苯胺蓝染色检测苹果冷藏表皮病害的研究[J]. 果树学报, 2011, 28(4): 703-707.
[25] 刘丹丹, 姚姿婷, 赖小群, 等. 甘蔗梢腐病轮枝镰刀菌侵染甘蔗叶片的显微观察[J]. 中国糖料, 2019, 41(4): 41-45.
[26] 支添添, 周 舟, 韩成云, 等. 台盼蓝染色鉴定拟南芥sdl1突变体的细胞死亡[J]. 作物研究, 2013, 27(3): 217-218, 223.
[27] 梁 倩, 李 荷, 王卓娅. 产纤维素酶细菌的分离、鉴定与酶学性质研究[J]. 广东药学院学报, 2019, 35(1): 120-125.
[28] Bechinger C, Giebel K F, Schnell M, et al. Optical measurements of invasive forces exerted by appressoria of a plant pathogenic fungus[J]. Science, 1999, 285(5435): 1896-1899.
[29] Moraes S R G, Tanaka F A O, Júnior N S M. Histopathology of Colletotrichum gloeosporioides on guava fruits (Psidium guajava L.)[J]. Revista Brasilra De Fruticultura, 2013, 35(2): 657-664.
[30] Leandro L F, Gleason M L, Nutter F W, et al. Germination and sporulation of Colletotrichum acutatum on symptomless strawberry leaves[J]. Phytopathology, 2001, 91(7): 659-664.
[31] Chaky J, Anderson K, Moss M, et al. Surface hydrophobicity and surface rigidity induce spore germination in Colletotrichum graminicola[J]. Phytopathology, 2001, 91(6): 558-564.
[32] 冯淑芬, 刘秀娟, 王绍春, 等. 橡胶树炭疽病流行规律研究[J]. 热带作物学报, 1998, 19(4): 39-45.
责任编辑:谢龙莲
