木薯MeLHCB4基因的克隆及表达分析
2021-12-08丁凯旋,郑婉茹,李琳琳,潘月云,张银东,耿梦婷,陈银华
丁凯旋,郑婉茹,李琳琳,潘月云,张银东,耿梦婷,陈银华

摘 要:本研究采用RT-PCR技术克隆了木薯叶绿素a/b结合蛋白基因MeLHCB4编码区序列。通过生物信息学对其基因结构、基因编码蛋白的理化性质等进行分析,并对不同物种的LHCB4氨基酸序列进行比对和构建进化树。结果表明,木薯MeLHCB4基因的CDs序列全长858 bp,编码285个氨基酸,蛋白理论相对分子质量约为30.9 kDa,理论等电点为5.47,该蛋白属于稳定的亲水性蛋白,预测该蛋白可能定位于细胞核或细胞质中。实时荧光定量PCR检测该基因的表达模式发现,MeLHCB4基因主要在木薯叶片和茎中表达,受到茉莉酸甲酯(JA)、水杨酸(SA)和乙烯前体(ACC)等激素的诱导表达,推测其可能参与了JA、SA、ACC信号途径。细菌性枯萎病病原菌侵染木薯叶片12 h后,MeLHCB4的表达量显著提高,表明MeLHCB4参与了木薯对病原菌的响应过程。
关键词:木薯;叶绿素结合蛋白;MeLHCB4;基因克隆;基因表达
中图分类号:S533 文献标识码:A
Cloning and Expression Analysis of MeLHCB4 from Cassava
DING Kaixuan1,2, ZHENG Wanru1,2, LI Linlin1,2, PAN Yueyun1,2, ZHANG Yindong1,2, GENG Mengting1,2*, CHEN Yinhua1,2
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresources, Haikou, Hainan 570228, China
Abstract: In this study, the MeLHCB4 coding region of cassava chlorophyll a-binding b binding protein gene was cloned by the RT-PCR technique. The structure of the gene and the physical and chemical properties of the protein encoded by the gene were analyzed by bioinformatics, and the LHCB4 amino acid sequences of different species were compared and the evolutionary tree was constructed. The results showed that the CDs sequence of cassava MeLHCB4 was 858 BP, encoding 285 amino acids, the theoretical molecular weight of the protein was about 30.9 kDa, and the theoretical isoelectric point was 5.47. The protein was a stable hydrophilic protein, and it was predicted that the protein might be located in the nucleus and cytoplasm. The expression pattern of MeLHCB4 was detected by real-time fluorescence quantitative PCR. It was found that MeLHCB4 was mainly expressed in the leaves and stems of cassava, and was induced by hormones such as JA, SA and ACC, which was speculated to be involved in JA, SA, ACC signal pathway. After 12 hours of Xanthomonas axonopodis pv. manihotis infecting cassava leaves, the expression of MeLHCB4 increased significantly, indicating that MeLHCB4 was involved in the response process of cassava to pathogens.
Keywords: Manihot esculenta; chlorophyll binding protein; MeLHCB4; gene cloning; gene expression
DOI: 10.3969/j.issn.1000-2561.2021.10.009
捕光色素蛋白復合体主要由色素分子和其结合的叶绿素a/b结合蛋白组成[1-2]。植物中存在2类捕光复合体[3],即LHCⅠ和LHCⅡ,分别位于光系统Ⅰ(PSI)和光系统Ⅱ(PSII)[4]。LHCII由Lhcb基因家族编码,主要具有捕获及传递光能、调节不同光系统中光能分配、光保护及过剩能量耗散及维持叶绿体中类囊体膜结构的功能[5]。根据目前的研究结果,Lhcb基因家族包含Lhcb1~Lhcb8等8个亚家族[1]。在被子植物中,Lhcb亚家族包含Lhcb1~Lhcb7等7个亚类;在双子叶植物中,Lhcb4还进化出一个新的亚类,即Lhcb8[6]。Lhcb基因家族成员除了参与光合作用,还广泛参与植物的抗逆响应[7-8]。
木薯(Manihot esculenta Crantz)是大戟科(Euphorbiaceae)多年生灌木状植物,是世界三大薯类之一[9]。木薯作为热带和亚热带地区重要的粮食作物,同时也是一种可再生能源作物,其产品广泛的分布在各行各业[10]。在生产上,细菌性枯萎病病害严重制约了木薯产业的发展[11]。促分裂原激活蛋白激酶MeMAPK8是木薯免疫反应PTI途径的MAPK级联通路的关键蛋白。本实验室前期利用酵母双杂交技术筛选获得MeMAPK8的互作蛋白MeLHCB4,本研究利用RT-PCR技术克隆获得MeLHCB4基因的编码区并进行生物信息学分析,利用实时荧光定量PCR分析MeLHCB4在不同组织及响应细菌性枯萎病病原菌侵染和植物激素信号通路的表达特征,以期为MeLHCB4的功能研究与利用提供参考依据。
1 材料与方法
1.1 材料
本研究采用的木薯品种为‘华南8号(SC8),由海南大学儋州校区木薯种质资源圃提供。选取生长45 d左右木薯SC8幼苗为试验材料,用于基因克隆、组织器官表达、激素和木薯细菌性枯萎病菌诱导表达分析,每个材料设置3个生物学重复。
木薯幼苗不同处理试验方法如下:(1)水杨酸(SA)、茉莉酸甲酯(JA)和乙烯前体(ACC)处理:分别使用2 mmol/L的SA、100 μmol/L的JA和2 mmol/L的ACC溶液喷施于木薯叶片,直至叶片滴水。于处理后0、0.5、1、2、4、6 h取木薯叶片。(2)XamHN11病原菌接种:XamHN11浓度调整为1×108 CFU/mL(OD600约为0.1),幼嫩叶片用2 mm无菌注射器注射接种,10 mmol/L MgSO4作为阴性对照。于接种后0、1、6、12、24 h取木薯叶片。
1.2 方法
1.2.1 木薯RNA提取和cDNA第一链合成 取100 mg木薯新鲜叶片于液氮中充分研磨成细粉,转移至RNase-FreeEp管中,加入1 mL TRIzol? Reagent试剂,立即涡旋振荡混匀。室温放置5 min。每1 mL TRIzol试剂添加0.2 mL氯仿,摇管15 s,室温孵育2~3 min。4 ℃,12 000 ×g离心15 min。将上层水相转移至新的无RNase的离心管。加入与水等体积的异丙醇,室温孵育10 min,4 ℃,12 000 ×g离心10 min。弃上清,加入1 mL用DEPC水配制的75%乙醇洗涤总RNA沉淀。4 ℃,5000 ×g离心10 min,弃上清。室温干燥5~10 min后用DEPC水溶解总RNA,保存于?80 ℃。采用Thermo Fisher Scientific公司cDNA第一链合成试剂盒RevertAidTM First Strand cDNA Synthesis Kit(货号:K1622),合成cDNA第一链。具体操作根据反转录试剂盒说明书。获得的cDNA保存于?20 ℃备用。
1.2.2 目的基因克隆 根据phytozome数据库中获得的MeLHCB4基因的序列信息,采用Premier 5.0软件设计基因扩增引物,由生工生物工程(上海)股份有限公司合成引物。上游引物序列:ATGGCTGCCTCCACAGCT,下游引物序列:TTAAGATGTCAAGTTATCAATAATGG。使用A9高保真酶和MeLHCB4基因扩增引物,以木薯总RNA反转录所得的cDNA第一链为模板進行PCR扩增,克隆木薯MeLHCB4基因编码区序列。PCR扩增体系如下:2×A9酶Mix 25 μL,10 mmol/L上下游引物各1 μL,木薯cDNA 2 μL,去离子水补足至50 μL。反应程序设置如下:95 ℃预变性3 min;30个循环包括95 ℃变性10 s,55 ℃退火15 s,72 ℃延伸20 s;最后72 ℃再延伸5 min。产物经1%琼脂糖凝胶电泳检测、凝胶回收试剂盒切胶回收,并克隆到pEASY-Blunt(TransGen,货号:CB101)载体中,转化进入大肠杆菌Trans5α感受态细胞,菌落PCR检测挑选可能的阳性克隆,双酶切鉴定并送华大基因测序验证。
1.2.3 MeLHCB4基因的生物信息学分析 运用MEGA 5.0对木薯、拟南芥、巴西橡胶树、麻疯树、蓖麻、番木瓜、苦瓜、甜瓜、可可树、甜樱桃等物种的LHCB4蛋白序列进行同源比对,邻位相连算法构建进化树。采用GSDS(Gene Structure Display Server)对MeLHCB4基因结构进行分析,分析MeLHCB4基因序列的内含子-外显子结构。利用在线预测软件LocTree3对MeLHCB4基因的亚细胞定位进行生物信息学预测。MeLHCB4蛋白的生理生化性质由在线网站ExPAsy站点工具Protparam(http://web.expasy.org/ protparam/)分析。
1.2.4 MeLHCB4基因的表达模式分析 提取木薯根、茎、叶、以及激素处理和木薯细菌性枯萎病菌接种不同时间的木薯总RNA,并反转录成cDNA,用于MeLHCB4基因的表达模式分析。采用SYBR Premix Ex TaqTM II(TaKaRa公司)的荧光定量PCR试剂盒进行分析。荧光定量PCR反应体系为10 μL:正、反向引物(10 mmol/L)各0.8 μL,模板cDNA 2.0 μL以及ddH2O 6.4 μL。荧光定量PCR引物,上游引物序列:AAGCAA GC CTACCTCAGACC,下游引物序列:CTGTATGG CTGGAACGGTGT。反应程序为:95 ℃预变性30 s;40个循环包括95 ℃变性5 s,58 ℃退火30 s,72 ℃延伸30s,最后72 ℃延伸5 min。每个样品至少进行3次生物学重复。Ubq10基因作为参照基因,F:CACCTTGCATCTCGTTCTC,R:TCCGTCCTCTAGCTGCTTC。采用2?ΔΔCT法计算基因表达值。
2 结果与分析
2.1 MeLHCB4基因的克隆
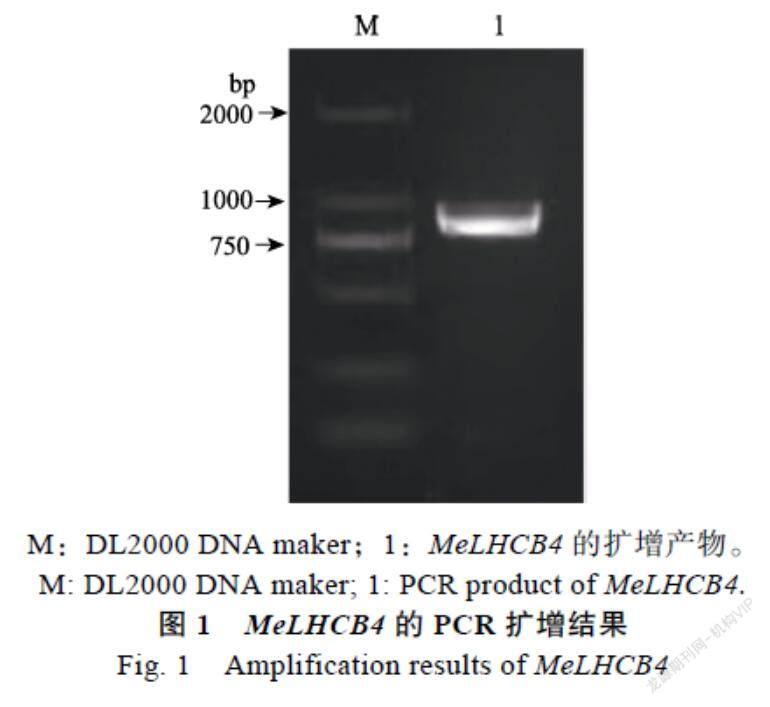
提取木薯SC8叶片RNA并反转录成cDNA,利用RT-PCR方法,以cDNA为模板,利用特异性引物扩增得到1条约800 bp的目的片段(图1)。电泳条带单一清亮,且大小与预期一致。将该电泳条带切胶回收、TA克隆到中间载体pEASY- Blunt后转化大肠杆菌感受态、筛选阳性克隆测序分析。结果表明,扩增得到的序列全长858 bp,编码285个氨基酸。将该基因命名为MeLHCB4
M:DL2000 DNA maker;1:MeLHCB4的扩增产物。
M: DL2000 DNA maker; 1: PCR product of MeLHCB4.
(GenBank登录号:XP_021621616.1;Phytozome编号:Manes.08G091700.1)。
2.2 MeLHCB4蛋白的理化特性分析
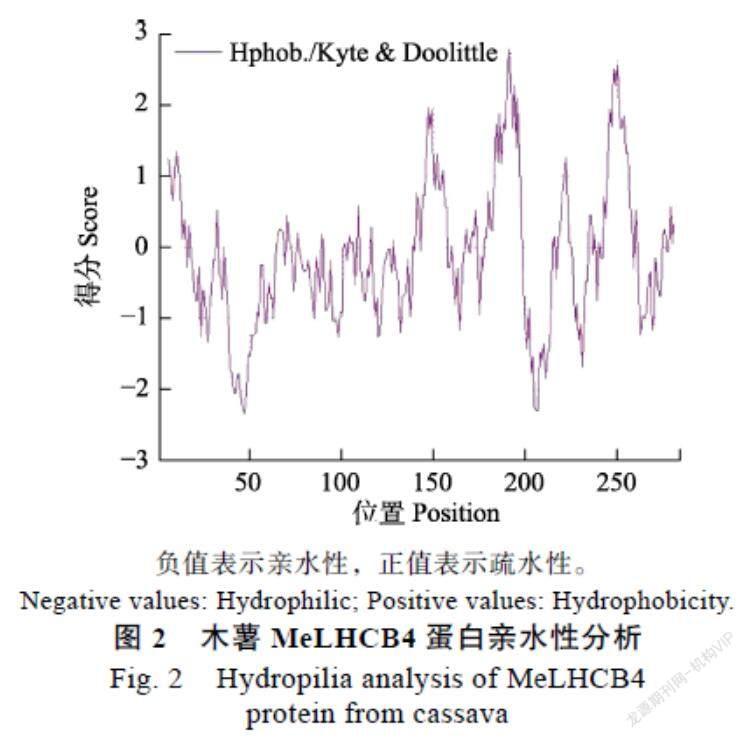
木薯MeLHCB4蛋白进行理化性质分析,发现该蛋白分子式为C1400H2159N367O411S5,理论相对分子质量(Mw)约为30.9 kDa,理论等电点(pI)约为5.47。蛋白组成中丙氨酸Ala(10.9%)、亮氨酸Leu(10.9%)、甘氨酸Gly(9.5%)含量相对较高,占全部组份30%以上。图2所示,MeLHCB4蛋白的亲水性平均系数为?0.109,脂溶指数84.98,蛋白不稳定指数为31.36,表明MeLHCB4蛋白为稳定的亲水性蛋白。通过LocTree3预测该蛋白可能定位于细胞核或细胞质中。
负值表示亲水性,正值表示疏水性。
Negative values: Hydrophilic; Positive values: Hydrophobicity.
2.3 MeLHCB4序列分析与多序列比对
多序列同源性比对结果表明(图3),木薯MeLHCB4(XP_021621616.1)与多种植物LHCB4蛋白均具有84%以上的同源性,与同属大戟科的麻疯树JcLHCB4蛋白同源性高达94.39%。
MeLHCB4氨基酸序列分析表明(图3),第60~257氨基酸序列为捕光叶绿素a/b结合蛋白保守域;第25~27、44~46、49~51、259~261氨基酸序列为潜在的蛋白激酶C磷酸化位点;第282~ 285氨基酸序列为潜在的N-糖基化位点;第35~ 40、66~71氨基酸为可能的N-肉豆蔻酰化位点;第101~104、108~111、160~163、217~220、278~281氨基酸为可能的酪蛋白激酶Ⅱ磷酸化位点。
2.4 MeLHCB4系统进化分析
运用MEGA5.0的邻接法(Neighbor-joining,
下划线表示典型的捕光叶绿素a/b结合蛋白功能域;*表示蛋白激酶C磷酸化位点;▼表示N-肉豆蔻酰化位点;◇表示N-糖基化位点;▲表示酪蛋白激酶II磷酸化位点;McLHCB4:苦瓜,XP_022151483.1;CmLHCB4:甜瓜,XP_008449241.1;QsLHCB4:
栓皮栎,XP_023894409.1;PaLHCB4:甜樱桃,XP_021830340.1;JcLHCB4:麻疯树,XP_012087873.1;HbLHCB4:
巴西橡胶树,XP_021652391.1;RcLHCB4:蓖麻,XP_002528105.1;CpLHCB4:番木瓜,XP_021888643.1;TcLHCB4:
可可树,XP_007026729.1;AtLHCB4:拟南芥,OAP04488.1。
The underline represents typical chlorophyll a/b binding domain; * represents the phosphorylation site of protein kinase C; ▼ represents the N-myristoylation site; ◇ represents the N-glycosylation site; ▲ represents the casein kinase II phosphorylation site. McLHCB4: Momordica charantia, XP_022151483.1; CmLHCB4: Cucumis melo, XP_008449241.1; QsLHCB4: Quercus suber, XP_023894409.1; PaLHCB4: Prunus avium, XP_021830340.1; JcLHCB4: Jatropha curcas, XP_012087873.1; HbLHCB4: Hevea brasiliensis, XP_021652391.1; RcLHCB4: Ricinus communis, XP_002528105.1; CpLHCB4: Carica papaya, XP_021888643.1; TcLHCB4: Theobroma cacao, XP_007026729.1; AtLHCB4: Arabidopsis thaliana, OAP04488.1.
NJ)1000次自检举(Boot straping)构建木薯MeLHCB4与其他10个植物LHCB4的系统进化树。结果表明(图4),MeLHCB4蛋白与同属于大戟科的几种植物的LHCB4蛋白亲缘关系很近,如麻疯树、巴西橡胶树、蓖麻。表明LHCB4蛋白在大戟科植物中的进化上相对保守。
2.5 MeLHCB4基因的表达模式分析
MeLHCB4基因在木薯的根、茎、叶中的表达分析发现(图5A),该基因在所有检测部位中均表達,在叶片中表达量最高,其次为茎,在根中的表达量最低,仅为茎的1/5。表明MeLHCB4基因主要在茎叶中表达,具有组织特异性。采用木薯细菌性枯萎病菌XamHN11接种木薯SC8幼苗叶片,结果发现(图5B),接种后12 h,MeLHCB4基因的表达量极显著提高,表明该基因可能参与了木薯对病原菌侵染初期的应答途径。
采用JA、SA、ACC等植物激素处理木薯叶片发现(图5C),MeLHCB4基因被诱导表达
MeLHCB4:木薯;JcLHCB4:麻疯树;HbLHCB4:橡胶树;RcLHCB4:蓖麻;QsLHCB4:栓皮栎;TcLHCB4:可可树;McLHCB4:苦瓜;CmLHCB4:甜瓜;CpLHCB4:番木瓜;PaLHCB4:甜樱桃;AtLHCB4:拟南芥。
MeLHCB4: Manihot esculenta; JcLHCB4: Jatropha curcas; HbLHCB4: Hevea brasiliensis; RcLHCB4: Ricinus communis; QsLHCB4: Quercus suber; TcLHCB4: Theobroma cacao; McLHCB4: Momordica charantia; CmLHCB4: Cucumis melo; CpLHCB4: Carica papaya; PaLHCB4: Prunus avium; AtLHCB4: Arabidopsis thaliana.
100 μmol/L的JA處理0.5~4 h时,MeLHCB4基因的表达量没有明显变化,但是处理6 h后表达量急剧升高,为对照的60倍;2 mmol/L的SA处理后,MeLHCB4基因的表达快速被激活,处理后0.5 h表达量即升高3倍,而随着时间的延长,表达量回到正常水平;2 mmol/L的ACC处理后0.5 h和1 h,MeLHCB4基因的表达量极显著提高,随着处理时间的延长表达量降低,但表达量仍显著高于对照。这些结果表明MeLHCB4可能参与了JA、SA、ACC信号途径。
3 讨论
LHCB蛋白作为光系统Ⅱ(PSⅡ)中的色素结合蛋白在植物光合作用中发挥重要作用。1975年LHCII最早被发现,LHCB蛋白由一个基因家族编码,该家族成员最早于1981年在豌豆中被克隆,之后水稻、小麦、拟南芥等植物的Lhcb基因被陆续报道[1, 12-13]。研究表明LHCB蛋白不但参与了光合作用,还广泛参与了植物对生物和非生物胁迫的响应[14]。Liu等[15]通过研究水稻LHCB5,在通常情况下,会与PsbS(Photosystem Ⅱ subunitS,电子转运相关蛋白)互作参与叶绿体电子传递过程。当水稻受到稻瘟病菌入侵时,LHCB5 的第24位苏氨酸发生磷酸化,LHCB5会加速向叶绿体积累,撇开PsbS独自作用,导致叶绿体正常的电子传递受阻并大量积累,导致活性氧的迸发,调控了叶绿体内的抗病相关基因表达,从而提高了
A:MeLHCB4基因在不同组织器官中的表达模式;B:木薯细菌性枯萎病菌XamHN11侵染下MeLHCB4基因的表达模式;C:不同激素处理下MeLHCB4基因表达模式分析;*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
A: Expression pattern of MeLHCB4 in different tissues; B: Expression analysis of MeLHCB4 under the treatment of cassava bacterial
blight pathogen XamHN11; C: Expression analysis of MeLHCB4 under different treatment of hormone solutions;
* means significant difference (P<0.05); ** mean extremely significant difference (P<0.01).
水稻对稻瘟病菌的抗性。此研究表明LHCB蛋白的磷酸化是其调控植物抗病性的关键步骤。
本实验室前期研究发现,木薯PTI途径的MAPK级联通路中的促分裂原激活蛋白激酶MeMAPK8参与木薯对细菌性枯萎病病菌侵染的响应。采用酵母双杂交技术筛选获得MeMAPK8的互作蛋白MeLHCB4。因此,本研究利用RT-PCR技术从木薯的叶片中克隆获得MeLHCB4基因全长。该基因全长858 bp,编码285个氨基酸,MeLHCB4蛋白分子式为C1400H2159N367O411S5,等电点约为5.47,MeLHCB4含有2个外显子和1个内含子。预测该蛋白可能定位于细胞核和细胞质中,与同属大戟科的麻疯树JcLHCB4蛋白同源性高达94.39%。表达分析显示,木薯MeLHCB4基因在茎叶中的表达量明显高于根,且在叶片中表达量约为茎中表达量的2倍,该基因在叶片中的表达最高,与邹智等[16]研究表明的橡胶树叶片中HbLhcb2表达量最高结果一致。MeLHCB4基因的表达具有组织特异性,可能在木薯叶片生长或免疫防御的过程中发挥重要作用。研究表明,当受到植物激素的诱导,MeLHCB4基因的表达都有不同程度的上调,与邓永胜[17]研究表明SA能在短时间内诱导番茄LeLhcb2基因的表达上调,且随着处理时间的延长,基因的表达水平逐渐降低的结果一致。MeLHCB4基因的表达响应植物激素JA、SA、ACC的诱导,表明该基因可能参与了相关激素的信号途径与逆境胁迫的应答。为了探究木薯MeLHCB4基因能否响应病原菌的入侵,用木薯细菌性枯萎病菌XamHN11处理木薯SC8幼苗,结果表明基因表达显著提高。笔者推测MeLHCB4与MeMAPK8参与了木薯对病原菌侵染初期的应答途径,在木薯抗病信号转导及免疫中发挥重要作用。在下一步的研究工作中,将利用转基因技术对MeLHCB4基因功能开展验证。
参考文献
[1] 赵 彦, 高 鑫, 王 丹, 等. 蒙古冰草lhcb1基因克隆及干旱胁迫下的表达分析[J]. 西北植物学报, 2017, 37(2): 211-216.
[2] De Bianchi S, Betterle N, Kouril R, et al. Arabidopsis mutants deleted in the light-harvesting protein Lhcb4 have a disrupted photosystem II macrostructure and are defective in photoprotection[J]. Plant Cell, 2011, 23(7): 2659-2679.
[3] Barros T, Kühlbrandt W. Crystallisation, structure and function of plant light-harvesting Complex II[J]. Biochimica et Biophysica Acta, 2009, 1787(6): 753-772.
[4] Nelson N, Yocum C F. Structure and function of photosystems I and II[J]. Annual Review of Plant Biology, 2006, 57(1): 521-565.
[5] Green B R, Durnford D G. The chlorophyll-carotenoid proteins of oxygenic photosynthesis[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1996, 47(1): 685-714.
[6] 阳江华, 张希财, 邹 智. 橡胶树捕光叶绿素a/b结合蛋白基因CAB2的克隆与分析[J]. 西南林业大学学报(自然科学), 2019, 39(1): 88-94.
[7] Xia Y S, Ning Z X, Bai G H, et al. Allelic variations of a light harvesting chlorophyll A/B-binding protein gene (Lhcb1) associated with agronomic traits in barley[J]. PLoS One, 2012, 7(5): e37573.
[8] Xu Y H,Liu R,Yan L,et al. Light-harvesting chlorophyll a/b-binding proteins are required for stomatal response to abscisic acid in Arabidopsis[J]. Journal of Experimental Botany, 2012, 63(3): 1095-1106.
[9] 蔡 坤, 李開绵, 陈松笔. 保鲜剂联合热处理对木薯品质及贮藏效果的影响[J]. 热带作物学报, 2016, 37(5): 979-983.
[10] 李超萍, 时 涛, 刘先宝, 等. 国内木薯病害普查及细菌性萎蔫病安全性评估[J]. 热带作物学报, 2011, 32(1): 116-121.
[11] 方 佳, 濮文辉, 张慧坚. 国内外木薯产业发展近况[J]. 中国农学通报, 2010, 26(16): 353-361.
[12] Klimmek F, Sjo?din A, Noutsos C, et al. Abundantly and rarely expressed lhc protein genes exhibit distinct regulation patterns in plants[J]. Plant Physiology, 2006, 140(3): 793-804.
[13] Lohman K N, Gan S S, John M C, et al. Molecular analysis of natural leaf senescence in Arabidopsis thaliana[J]. Physiology Plant, 1994, 92(2): 322-328.
[14] Damaraju S, Schlede S, Eckhardt U, et al. Functions of the water soluble chlorophyll-binding protein in plants[J]. Journal of Plant Physiology, 2011, 168(12): 1444-1451.
[15] Liu M X, Zhang S B, Hu J X, et al. Phosphorylation-guarded light-harvesting complex II contributes to broad-spectrum blast resistance in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(35): 17572-17577.
[16] 邹 智, 王丹华, 戴雪梅, 等. 橡胶树lhcb2基因的克隆与表达特性分析[J]. 西南林业大学学报, 2015, 35(6): 14-18.
[17] 邓永胜. 低温胁迫下番茄PSⅡ捕光天线蛋白基因LeLhcb2的功能分析[D]. 泰安: 山东农业大学, 2014.
责任编辑:黄东杰
