注水黏膜切开刀推进式内镜黏膜下剥离术切除早癌及癌前病变的应用研究
2021-12-08熊英韩静朱亚男于晓欢陈玉杰侯丛然于占江高雪梅张金卓
熊英,韩静,朱亚男,于晓欢,陈玉杰,侯丛然,于占江,高雪梅,张金卓
[1.保定市第一中心医院消化三科(河北省分子病理与肿瘤早期诊断重点实验室),河北保定 071000;2.保定市第一中心医院内镜诊疗中心,河北保定 071000]
我国是胃癌高发区之一。随着内镜清晰度的提高、色素内镜、电子染色内镜和放大内镜等技术的广泛应用,早期胃癌及癌前病变的发现率逐年升高[1-2]。有研究[3]表明,内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗早期胃癌及癌前病变的有效率和术后复发率与外科手术相近[4-5],已逐渐代替外科手术成为治疗早期胃癌的首选方法。贲门黏膜下血管及脂肪组织丰富,ESD术中易产生烟雾及切断血管引起活动性出血;黏膜下层组织相对疏松,易导致黏膜下注射液弥散吸收快,病变抬举时间短;贲门区域空间相对狭小,翻转内镜位置较高不易够到病变,内镜操控较困难;而大面积的贲门黏膜病变,ESD手术时间长,并发症发生率高。因此,贲门ESD一直被内镜医生认为是胃ESD中最困难的术式[6]。
近年来,ESD手术器械发展迅速,注水型电刀实现了黏膜下注射与切开和剥离同时进行,避免了反复更换器械的缺点。本文应用注水型电刀行推进式内镜黏膜下剥离术(pushing endoscopic submucosal dissection,PESD),可以在直镜身状态下于病变口侧边注水边剥离至病变肛侧。现报道如下:
1 资料与方法
1.1 一般资料
选取2017年1月-2020年12月保定市第一中心医院内镜诊疗中心通过白光胃镜和色素胃镜寻找贲门区域可疑病灶、经活组织病理证实为贲门早癌或高级别上皮内瘤变、病变最大径>2.0 cm 的病例43 例,术前经电子染色+放大内镜及超声内镜评估病变局限于黏膜下层以上者。其中,男29 例,女14 例。所有内镜手术均由同1 名具有500 例次以上ESD 经验的高年资内镜医师完成,采用双盲法随机分配ESD 和PESD 治疗,由助理将ESD 和PESD 的手术方式装入相同的非透明信封中,由患者抽取装有手术方式的信封并签署手术知情同意书,再由助理告知术者具体手术方式。本研究是前瞻性研究,已获得保定市第一中心医院伦理委员会的批准。
剔除标准:①活检病理提示低分化腺癌或印戒细胞癌;②术前放大内镜及超声内镜评估病变浸润深度超过黏膜下层深层;③术前CT 等检查发现>1.0 cm的淋巴结或远端转移。
1.2 手术方法及术后处理
1.2.1 内镜与器械GIF-Q260J 内镜、透明帽、GIF-H260Z、GIF-H290Z 放大胃镜及黑帽(生产厂家:奥林巴斯);黏膜注射针[生产厂家:安瑞医疗器械(杭州) 有限公司,型号:AMH-SYB-2423-2304];注水型电刀(型号:MK-T-2/4-195)、止血钳(生产厂家:南京微创医学科技股份有限公司,型号:HBF-23/2000);一次性金属夹(生产厂家:杭州安杰思医学科技股份有限公司);高频电刀[生产厂家:爱尔博(上海)医疗器械有限公司,型号:VIO 200D];氩离子凝固器[生产厂家:爱尔博(上海)医疗器械有限公司]。
1.2.2 ESD于胃底倒镜白光发现贲门黏膜病变,用靛胭脂染色后病变边界清晰,呈0~Ⅱc+Ⅱa型。然后标记病变范围,每个标记点间隔0.3 cm,并于病变肛侧双标;环周切开病变周边黏膜;沿黏膜下层中下2/3的部位进行剥离,剥离过程中需反复黏膜下注射。完整剥离病变后,用止血钳电凝处理创面内暴露的血管;最后体外固定离体病变标本,靛胭脂染色后可见标记点完整。见图1。

图1 贲门ESD过程Fig.1 The procedure of ESD in cardia
1.2.3 PESD电子染色内镜下观察到病变(0~Ⅱc+Ⅱa型)区域后,用0.5%靛胭脂染色,以勾勒病变范围及边界,用内镜下氩离子束凝固术(argon plasma coagulation,APC)于病变边缘0.3~0.5 cm 处行环周标记,每个标记点间隔约0.3 cm,并标记病变口侧或肛侧。于病变口侧标记点上方的黏膜下层注射含靛胭脂的1∶10万肾上腺素盐水,待病变抬举,用注水型电刀在标记点外弧形切开黏膜。切开刀于黏膜下层2/3 处进行分离,依据先分离黏膜下层再沿标记点开边的顺序,边注水边剥离,从病变口侧向肛侧推进;开边顺序应依据重力,先切开重力对侧的黏膜,使病变悬吊于胃内,再切开重力侧黏膜。完整切除病变后,用止血钳和APC 处理创面内暴露的小血管和血管断端,必要时用金属夹处理。取出切除的病变标本,固定于预先准备好的塑料泡沫板上,靛胭脂染色后观察是否切除完整,标记口侧和肛侧,体外测量病变大小后放入福尔马林液中固定送病理。见图2。
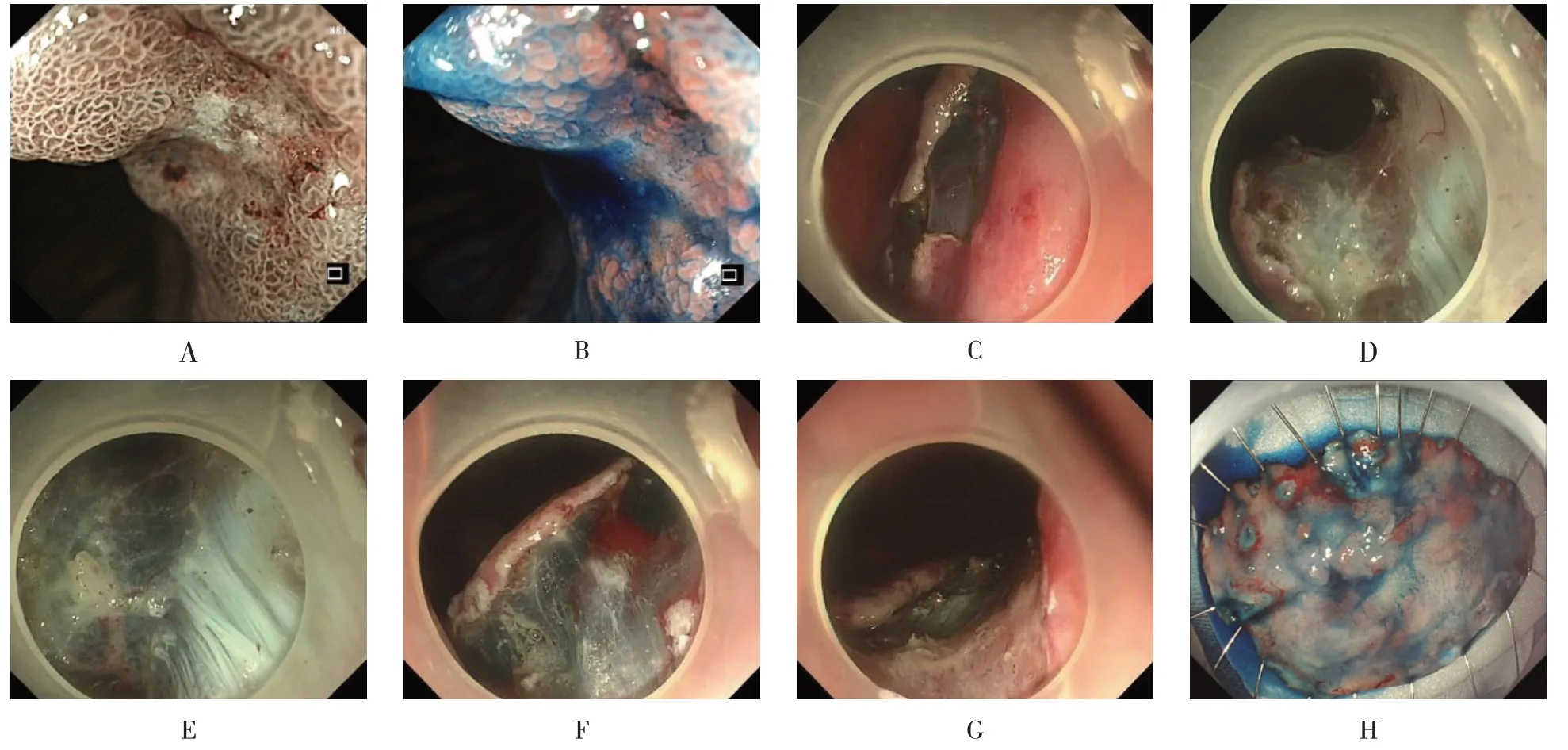
图2 贲门早癌PESD过程Fig.2 The procedure of PESD in cardia
1.3 术后处理
患者术后禁食水48~72 h,常规静脉营养补液并应用质子泵抑制剂。术中出血量较多、损伤固有肌层或穿孔的患者,术后禁食水72 h,给予静脉抗生素预防感染,必要时行胃肠减压。禁食结束后从流食逐渐过渡至半流食和软食。于术后3、6 和12 个月复查胃镜,观察创面愈合情况、是否有病变残留及复发等情况。
将所有切除的病变送病理检查,以明确性质及浸润深度,观察切缘有无残留及基底部有无病变累及。
1.4 记录术中和术后相关情况
术中记录每例患者的病变大小、病变剥离时间、术中出血和术中穿孔的情况。病变剥离时间指从黏膜下注射开始至病变完全切除结束所需的时间。术中出血指ESD术中电刀或止血钳切断血管引起的活动性出血,需要用止血钳处理,不包括切缘及创面表面小血管渗血。
术后记录迟发性出血及穿孔情况、术后病理结果和住院时间等。迟发性出血:ESD术后出血需再次内镜下止血。迟发性穿孔:患者术中未见明显穿孔,术后24 h后出现突发腹痛等穿孔迹象,并经影像学检查证实。
1.5 统计学方法
选用SPSS 25.0 统计软件对结果进行分析,计数资料以例(%)表示,行χ2检验,计量资料以均数±标准差(±s)表示,行配对t检验,P<0.05为差异有统计学意义。
2 结果
PESD 组(n=32)病变直径2.0~8.0 cm,平均(5.1±2.9)cm;其中1处病变位于前壁,16处位于后壁,3处位于大弯侧,12处位于小弯侧;30处病变为一次性切除,2 处病变(贲门大弯侧)为分块切除;剥离时间19~112 min,平均(65.5±48.3)min;术中出血8例(25.0%),术中出血病例均成功内镜下止血,无迟发性出血及穿孔发生,术后住院3~5 d。2处病变(1 处位于小弯侧,1 处位于后壁)深度浸润至黏膜下层深层(>500 μm),追加外科手术。1 处浸润深度达460 μm(位于后侧),患者及家属拒绝外科手术,目前密切随访中,暂未发现复发及转移。其他病变均为高级别上皮内瘤变或浸润深度<300 μm的高中分化腺癌。
ESD 组(n=17) 病变直径2.0~6.5 cm,平均(4.2±2.2)cm;2 处病变位于前壁,10 处位于后壁,5处位于小弯侧;所有病变均为一次性切除;剥离时间26~157 min,平均(91.5±26.5)min;术中出血8例(47.1%),均成功内镜下止血,术中穿孔2 例(11.8%),均给予金属夹夹闭并内科保守治疗取得成功,无迟发性出血和迟发性穿孔发生,术后住院3~6 d。1处病变(位于后壁)为高分化腺癌,浸润深度超过黏膜下层500 μm,与患者及家属协商,综合考虑患者高龄(男,79 岁)且基础疾病较多,未追加外科手术,目前密切随访中。1 处病变(位于后壁)术后病理提示为低分化腺癌(术前病理未检测到低分化癌细胞),虽浸润深度仅在黏膜下层100 μm,但考虑肿瘤恶性程度高、患者较年轻(男,52 岁)且一般情况良好,经患者及家属同意后,追加外科手术切除。其余病变均为高级别上皮内瘤变或浸润深度<300 μm 的高中分化腺癌。两组手术相关情况比较见附表。

附表 两组患者手术相关情况比较Attached table Comparison of operation related conditions between the two groups
3 讨论
近年来,我国贲门癌在胃癌中所占比例逐年增加[1,5],由于贲门癌早期症状不明显,超过90.0%的患者就诊时已属中晚期,其5年生存率不足20.0%。因贲门内镜活检取材困难,早期检出率很低,影响了患者接受根治性治疗的可能性和治疗效果。随着人们对健康的重视以及内镜诊断水平的提高,特别是高清晰度内镜、色素内镜和放大内镜等技术的发展,使早期贲门癌和癌前病变检出率大幅提高,大部分早期贲门癌患者在内镜下即可获得根治性治疗,5年生存率超过90.0%[7-8]。由于贲门的特殊解剖结构,手术难度在胃ESD中最大。
贲门ESD 的手术难点主要包括:①贲门空间狭窄,正镜状态下视野不佳,倒镜状态又因病变位置较高、内镜角度不够,导致操作困难;②传统ESD的步骤是先开边再剥离,但贲门黏膜下层组织疏松,完全开边后黏膜下注射液弥散快,液体垫隆起时间短,在黏膜下注射后器械还没有更换好的情况下,液体垫就消失了,尽管有研究[9-10]报道了许多应对方法,如:牙线法、磁石悬吊法和弹力线法等,但都是在无液体垫的情况下进行剥离,而对于内镜操控水平不成熟的医师或黏膜下层有粘连的病变者,在没有液体垫的情况下剥离易发生穿孔,本研究ESD组病例术中穿孔发生率达11.8%,也证实了这一观点,如果不完全开边仅做“黏膜下隧道”,在打通“隧道”后切边因为没有着力点,在进一步切开时比较困难[11];③贲门处黏膜下血管丰富,在黏膜下液体隆起不充分的情况下,电切常导致活动性出血,影响操作视野,频繁的电凝止血会造成组织过多的灼伤,产生较多的烟雾,影响视野,给ESD手术带来困难,本研究ESD组术中出血率达47.1%。虽然术中出血和穿孔没有延长患者住院时间,但延长了手术操作时间,增加了危险性,同时需要使用金属夹和尼龙绳等器械,且术后要留置胃肠减压管、静脉应用抗生素等,加重了患者经济负担和身体上的不适。
注水型电刀实现了边黏膜下注射边剥离,且术中不用经常更换器械,缩短了ESD手术时间,由病变口侧向肛侧行PESD,避免了贲门区域内镜需高位翻转造成角度不够的问题,还可以将注水、剥离同时进行,可以清晰地发现黏膜下层血管,提前用止血钳或电刀电凝干预,最大程度地减少了出血和穿孔的发生。本研究中,PESD组术中穿孔发生率为0.0%,术中出血发生率为25.0%,均明显低于ESD组(P<0.01),两组病变平均大小无明显差异(P>0.05),PESD组的剥离时间明显少于ESD组(P<0.01),两组完整切除率比较差异亦无统计学意义(P>0.05)。考虑原因可能为:①正镜身状态下内镜可更好地进入到病变黏膜下层,视野良好,在电刀与固有肌层平行的情况下,不易出现穿孔;②由近至远的推进式剥离方式,可以充分利用重力使病变悬吊于胃内,更好地显示病变局部解剖结构;③由于电刀兼顾注水和剥离的作用,完全开边后不存在液体弥散快的问题,黏膜下剥离过程中液体垫隆起状态始终良好,使病变剥离速度更快;④贲门黏膜下层一些看似很粗的血管,其实是由很多细支的栅栏状血管聚集而成[12],盲目电凝切断会导致多个出血点一起出血,在黏膜下剥离时若发现较粗的血管,可以先于血管周围注射液体垫,待血管丛分离成多个相对较细的血管后再逐个电凝切断,对于分离后仍然粗大的血管,可采用止血钳柔和电凝完全碳化后再切断,以避免术中出血[13],而常规ESD由于要更换注射针等器械,过程较繁琐,很多内镜医师会选择直接电凝切断,常导致活动性出血。
综上所述,注水型电刀行PESD 是一种切除贲门区域较大面积早癌及癌前病变快捷且安全的治愈性切除方法,但本研究所涉及的样本量较小,有待进一步大样本的研究进行佐证。
