哺乳期犊牛健康管理
2021-12-07李诗晴庄豪华
李诗晴,张 鑫,易 霞,庄豪华,马 翀
中国农业大学动物医学院,北京 100193
0 引言
犊牛出生时,其先天性免疫几近于无,也未发育成为反刍动物。在瘤胃发育及功能逐渐完善的过程中,犊牛面临获得免疫力和类似“单胃动物”饲养模式这两大挑战[1]。犊牛的健康不仅会直接影响其生长发育和牧场当期效益,还会影响其成年后的生长性能,多年来一直是影响奶牛养殖业的问题之一。虽然随着生产管理水平的提高,发病率逐年下降,但导致哺乳期犊牛死淘的原因仍以消化道疾病(各种原因诱发的肠炎为主,表现为腹泻,NCD)和呼吸道疾病(BRD)为主,其他疾病如败血症、关节炎、脐带炎等虽在个别牛场阶段性暴发,但并非是主要健康问题。
1 哺乳期犊牛健康状况
根据曹志军等[2]出版的《中国后备奶牛培育现状白皮书》(2020)报道,2015—2019年统计的504 003 头哺乳期犊牛数据显示,发病率由43.30%降至25.40%;Zhao(2021)等[3]对98 家国内牧场的调查结果表明,哺乳期犊牛B R D的平均发病率和死亡率分别为11.73%(95%CI:10.20%~13.23%)和3.65%(95%CI:2.85%~4.45%),有腹泻症状的哺乳期犊牛平均发病率和死亡率分别为14.17%(95%CI:12.46%~15.88%)和3.61%(95%CI:2.97%~4.25%)。有报道称一些国家哺乳期犊牛发病率和死亡率分别为35.00%和7.00%,澳大利亚的牧场调查结果中二者分别为23.80%和5.60%[4];乌拉圭的哺乳期犊牛死亡率高达15.20%[5];在英国,2011—2018年3月龄内犊牛死亡率为6.00%[6];美国牧场的犊牛在哺乳期有38.10%至少发病一次,死亡率为5.00%[7];其他国家和地区报道数据高低各异。
除可导致死淘率和治疗成本升高外,犊牛在哺乳期罹患NCD和BRD还可能对其后续生产性能和繁殖性能造成长期影响。虽然上述观点一直存在争议,但Abuelo等[8]通过回顾性队列研究探讨了上述两类健康问题对平均日增重(ADG)、繁殖指标、305 天成年当量(305ME)等指标的影响程度。通过对487 头有BRD病史和926 头有NCD病史的犊牛进行生存分析和混合模型对比,发现有BRD病史的牛参配月龄、产犊月龄、ADG、305ME和妊娠率与哺乳期未患病犊牛无差异,而在哺乳期有NCD病史的牛头胎305ME与哺乳期未患病的犊牛相比低325 kg,可能与其ADG低50 g相关。总的来说,其研究结果表明哺乳期犊牛罹患BRD或NCD对其后续繁殖效率和头胎305ME有影响,但对关键繁殖指标的影响有限。而Schaffer等[9]对同一牧场出生的14 024 头荷斯坦犊牛的研究表明,120日龄内有BRD病史的牛在首次产犊前淘汰出群的风险为健康牛的1.62~4.98 倍,有哺乳期BRD病史犊牛比断奶后有BRD病史犊牛被淘汰风险升高2.62 倍,120日龄内有BRD病史的牛头胎被淘汰的风险是健康牛的1.28 倍,且其305ME较后者低233 kg。
虽然哺乳期犊牛健康问题一直困扰着牧场管理者,但目前的研究及实践结果表明科学的饲养管理可降低牧场因此造成的损失。其中初乳管理、饲养方式、饲喂管理、环境管理等均为非常重要的影响因素,本文将对初乳管理和健康管理措施进行简述。
2 初乳管理
初乳管理是决定犊牛健康和存活率的唯一最重要的管理因素[9]。在过去20 年内,相关研究取得了有限的进展,但在生产实践中仍有很大的提升空间。
由于牛胎盘组织结构的特殊性,免疫球蛋白不能通过胎盘从母体传播至胎儿血液内,所以犊牛出生时体内无丙种球蛋白(γ球蛋白),其体内的免疫球蛋白(Ig)几乎完全来自初乳[10]。犊牛在出生后24 h内,通过小肠吸收母体的Ig,称为被动免疫,可保护犊牛免于常见病原感染后发病,直至其自身免疫系统发育完全。除了降低犊牛在哺乳期发病和死亡的风险外,成功的被动免疫还可降低断奶后的死亡率、提高ADG、降低首次产犊年龄、提高头胎和二胎产奶量[10]。
被动免疫成功与否可通过测定血清IgG的浓度判定,在犊牛出生后24~72 h,如果血清IgG浓度低于10.0 g/L,曾认为被动免疫失败(FPT)[11,12]。由于血清IgG的检测金标准为放射免疫扩散法(RID),需在专业实验室完成且成本昂贵,所以牧场在生产中多以血清总蛋白(STP)含量测定为FPT监测手段。对于个体犊牛,如血清IgG<10.0 g/L或STP<5.5 g/dL(24 h~10 d)[13],则认为被动免疫失败。在生产实践中,管理者可通过群体评估的方式判断初乳管理的状况。McGuirk和Collins[14]的研究表明,进行群体评估时最少需要采集12 头健康犊牛的血液样本检测,当STP≥5.5 g/dL的样本超过80.00%时,可认为群体被动免疫成功。而Calloway等[15]的研究认为,群体被动免疫成功的标准可修改为90.00%的样本STP≥5.0~5.2 g/dL。但2018年美国的一篇研究报告表明,15.60%的参测犊牛被动免疫失败[7]。STP的现场检测可使用折光计或糖度计(Brix),检测值为5.0~5.5 g/dL(折光计)或8.10%~8.50%(Brix)时较为理想[10]。故此,被动免疫的判定标准已重新修订。新修订的判定标准国内[2]和国外[10,16]稍有差异,对应指标参见表1。
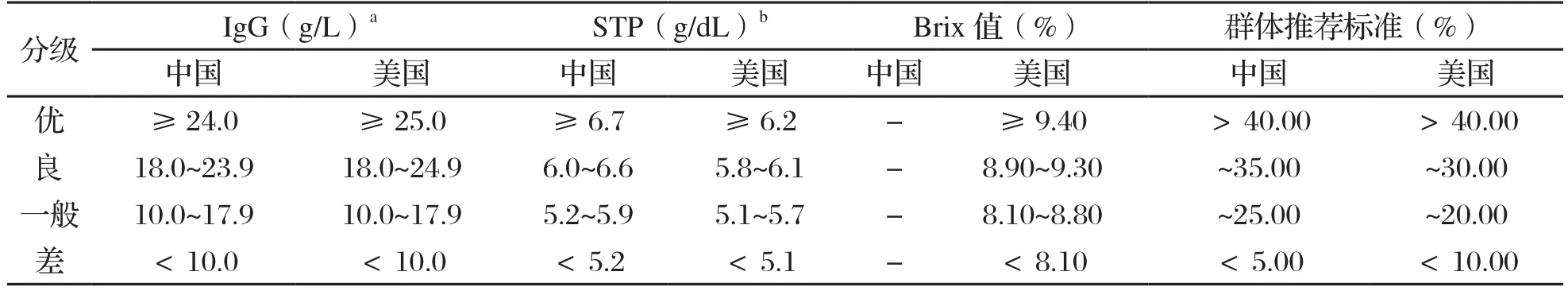
表1 犊牛被动免疫判定标准[2,10,16]
被动免疫成功与否会受初乳质量、初乳储存、初乳处理方式、饲喂管理以及犊牛自身的吸收能力等因素的影响,现将重要的影响因素分述如下。
2.1 影响初乳质量的因素
初乳质量是影响被动免疫的主要因素之一,其成分包括大量的免疫球蛋白、白细胞、生长因子、激素、非特异性抗菌因子和营养成分。初乳的质量可通过初乳计或Brix等测定,通过测定值估计IgG含量,优质初乳(IgG>50.0 g/L)的比重>1.05(初乳计)或Brix值≥22.00%[17]。在生产实践中,使用初乳计测定初乳比重时会受到初乳温度和脂肪含量的影响,而Brix受温度影响较小,故现多用Brix判定初乳质量。
初乳由母牛产出,所以其质量由母牛决定。其影响因素有品种、母牛的年龄和胎次、围产前期营养、产犊季节、干奶期疫苗免疫、干奶期长短、初乳产量和初乳挤出时间等。研究表明,荷斯坦奶牛初乳中Ig含量(5.60%)低于更塞牛(6.30%)、瑞士褐牛(6.60%)、艾尔夏牛(8.10%)或娟姗牛(9.00%)[18]。虽然很多研究和传统观念都认为,年龄越大的奶牛产出的初乳质量更高,但新近的一项研究表明,头胎牛和二胎牛的初乳质量相似(IgG含量分别为73.2 g/L和71.7 g/L),二胎以上的奶牛初乳质量较高(IgG含量83.3 g/L)[19]。围产前期日粮的能量水平、VE、硒和烟酸的含量均可对初乳的产量和质量有影响。对于产犊季节对初乳质量及产量的影响,不同的研究结果存在差异,其关系尚不明确。干奶期的疫苗免疫不会提高初乳中Ig的含量,但在干奶前期进行免疫,有助于对部分病原(巴氏杆菌、鼠伤寒沙门氏菌、大肠杆菌、轮状病毒和冠状病毒)的特异性抗体滴度增加。如果干奶期过短(<21天),初乳的Ig含量较低,且较正常干奶期(~60天)相比,干奶期较短的奶牛初乳产量更低[20]。此外,奶牛在干奶期时的营养平衡、饲槽管理、适口性、应激等也会影响初乳的质量。很多研究表明,奶牛产犊后第一时间挤出的初乳中Ig浓度最高,随着挤出时间的延迟,Ig浓度逐渐下降。Conneely等[21]的研究表明,胎次、从产犊到初乳的挤出时间间隔、产犊季节、初乳产量和牛群均与初乳中IgG的浓度相关。在爱尔兰,初乳产量每增加1 kg,IgG浓度降低1.7 g/L(P<0.01)。胎次高的奶牛、产犊到初乳的挤出时间间隔较短的奶牛以及在春季或秋季产犊较早的奶牛产生的初乳IgG浓度较高。胎次(P<0.001)、产犊到挤奶的时间间隔(P<0.01)、初乳IgG浓度(P<0.01)、犊牛出生重(P<0.05)和牛群均与第1次挤奶时的初乳产量相关。Morin[22]等经试验证明,在奶牛产犊后,初乳挤出时间每延迟1 h,IgG的浓度下降3.70%。相似结果也见于Moore等[23]的报道,其研究结果表明在奶牛产后6 h、10 h或14 h挤出的初乳,IgG浓度分别下降17%、27%和33%。
2.2 初乳储存与处理
通常情况下,牧场内以两种方式储存初乳——短期冷藏和长期冻存。Cummins等[24]对在不同条件下储存不同时间初乳的IgG浓度、细菌和pH影响进行了研究,结果表明,初乳中细菌在储存的前6 h增殖速度最快,随后下降,但当储存温度>4 ℃时,细菌繁殖的速度显著加快;初乳在<13 ℃的温度下储存时,pH没有显著变化,但在20 ℃的温度下储存24 h后,pH显著降低。根据其另一项研究结果[25],建议即使是优质初乳(IgG>50.0 g/L) ,也不要在挤出后直接饲喂犊牛,最好在≤4 ℃下储存2 天,以确保被动免疫的效果。有研究表明,4 ℃条件下短期储存初乳不会影响IgG的浓度和细胞活力,但在较高温度(>22 ℃)下储存时,细菌总数可增加至1.0×106CFU/mL以上,并与犊牛FPT呈正相关[26]。初乳冻存后,使用前需解冻处理,所以很多学者都对冻存和解冻方式、温度开展了研究。Wiking和Pedersen[27]研究了几种在微波炉中解冻的方法,发现冷冻初乳样品加热不会直接导致IgG的损失,但用微波解冻初乳会导致初乳加热不均匀和结块,但是没有关于IgG浓度的信息报道。Jones等[28]比较了两种不同的功率(325 W和650 W)下通过微波解冻初乳,发现与专用水浴解冻设备(45 ℃)相比,IgG或IgM含量没有差异,但有少量IgA损失。Balthazar等[29]发现,增加微波功率可使IgG1损失更高:在200 W时损失20.00%,而在350 W时损失31.00%。将水浴解冻设备加热到50 ℃和60 ℃时,IgG的损失率与40 ℃(8.00%)下相似,但加热到60 ℃以上会导致IgG1显著减少(26.00%)。这与巴氏杀菌的其他研究一致,当初乳加热到60 ℃以上时,IgG损失更多。关于反复冻融,Haines等[30]在37 ℃水浴条件下研究了多次冻融后,未发现初乳样品中IgA、IgM或IgG浓度发生显著变化。但该研究仅有一个样本,因此需对此结果审慎使用。Morrill等[31]的研究表明,单次冻融不会使初乳IgG浓度下降。与新鲜初乳相比,反复冻融两次可使IgG分别下降7.80%和7.70%。
根据曹志军等[2]的调研结果,目前我国91.80%的牧场在饲喂初乳前会以60 ℃加热60 min的条件进行巴氏杀菌处理。Saldana等[32]对比了不同质量等级(IgG含量分别为92.5 g/L、59.4 g/L和 48.1 g/L)的初乳在不加热、60 ℃条件下加热30 min和60 min处理,结果发现加热30 min组的初乳IgG浓度下降9.00%,加热 60 min组下降 12.00%。对于细菌计数,加热 60 min组初乳比加热 30 min组和未加热组更低(分别为 1.8 log CFU/mL、2.0 log CFU/mL 和 3.6 log CFU/mL)。24 h犊牛血清IgG浓度与初乳质量呈正相关(18.0 g/L、22.2 g/L和24.8 g/L),且随着热处理时间的增加而增加(19.7 g/L、20.3 g/L和25.0 g/L)。与饲喂优质初乳的犊牛相比,饲喂中等质量初乳的犊牛的IgG吸收效率更高(分别为38.10%和25.00%)。这些结果表明在特定时间段内IgG的吸收量可能存在上限,并且饲喂相同体积的中等或优质初乳时犊牛血液中IgG浓度相似。虽然巴氏杀菌处理可杀灭初乳中的绝大部分细菌,但需注意的是,60 ℃加热60 min并不能杀灭初乳中所有病原菌,副结核阳性率较高的牧场尤需注意[33]。
2.3 饲喂管理
自然状态下,犊牛会从母牛的乳房采食初乳。此时,犊牛的前胃尚未发育完全,真胃容积约占体重的10%,采食过程中,食管沟闭合使初乳直接进入真胃内,自然采食量难以完全充盈真胃。有研究表明,使用奶瓶饲喂时,犊牛的采食量仅为2.2 L(1.0~4.0 L)[34],单次饲喂难以建立良好的被动免疫。建议犊牛在第1次饲喂时通过胃管饲喂其体重(BW)10.00%~12.00%的初乳(荷斯坦犊牛为3~4 L),但这种方式可能不会触发食管沟反射,导致部分初乳进入瘤胃内。犊牛出生后通过其肠道细胞的胞饮功能非选择性吸收大分子(如IgG),再释放至淋巴管,继而通过胸导管进入循环系统。这一功能在犊牛出生后24 h内逐渐减弱,直至通道完全闭合[11]。在一项随机分配初乳饲喂(饲喂量为7.50%BW,约含200 g IgG)新生犊牛的研究中,犊牛出生后45 min饲喂的犊牛血清IgG含量为25.5 g/L,而6 h和12 h饲喂初乳的犊牛血清IgG含量分别为18.2 g/L和18.5 g/L,表明饲喂初乳的时间越早,吸收效率和血清IgG水平越高[35]。尽早饲喂初乳还会使肠道中细菌定植的速度更快,如双歧杆菌。因此建议在犊牛出生后1~2 h内饲喂初乳。根据曹志军等[2]的调研结果发现,我国规模化牧场的初乳饲喂模式较多,主要为“4+2+2”“4+2+0”“4+0+0”和“4+4+0”,其中“4+2+0”和“4+2+2”饲喂模式最普遍。
3 犊牛健康管理
如前所述,哺乳期犊牛死亡率为6.00%~10.00%,死亡原因以腹泻(NCD)和呼吸道疾病(BRD)为主。虽然有些疫苗或兽药有助于预防NCD和BRD,但绝大多数群发性问题源于初乳管理、饲养环境、营养、卫生或应激。疾病预防的关键在于4 个主要方面:(1)清除犊牛环境中的传染源;(2)将犊牛转出污染环境;(3)提高犊牛的免疫力;(4)减少犊牛的应激。
3.1 犊牛消化道疾病的防控
腹泻是消化道疾病中肠炎的临床症状,多种病因可引发犊牛腹泻,可将其分为感染性腹泻和非感染性腹泻两类。在可引起犊牛腹泻的病原中,牛轮状病毒(Bovine Rotavirus,BRoV)、牛冠状病毒(Bovine Coronavirus,BCoV)、大肠杆菌F5(E.coliF5,旧称K99)和微小隐孢子虫(Cryptosporidium Parvum,C.parvm)最为常见[36]。沙门氏菌(Salmonellaspp.)、产气荚膜梭菌(Clostridium Perfringens)、贾第鞭毛虫(Giardia)、球虫(Coccidium)等病原多为点状暴发[37~40]。另外,近年来多种新病原也不断在腹泻犊牛粪便中检出。腹泻是这些病原感染后犊牛表现出的主要临床症状,但仅凭症状难以确定病原。管理不当是导致犊牛腹泻的最重要风险因素[40],因此牧场管理者应认识到管理是一个持续性的过程,需要不断评估,不断改进。关键控制点如下。
3.1.1 初乳饲喂管理
前文中已对初乳饲喂管理做了部分叙述,在此仍需提示的是,初乳中可能含有一些疾病的重要病原,如都柏林沙门氏菌。控制初乳饲喂相关的疾病传播风险关键控制点有:(1)初乳收集及储存设备的卫生;(2)尽量不要使用混合初乳;(3)冻存初乳的冰柜要定期检查;(4)如牧场内所有初乳都冻存后饲喂,要尽量购置快速制冷设备;(5)冷藏的初乳保存时间不可超过2 天,在容器上标注日期;(6)定期维护初乳解冻、巴氏杀菌设备。饲喂新生犊牛的初乳,总细菌数应控制在1.0×105CFU/mL以下,大肠杆菌数应控制在1.0×104CFU/mL以下。
3.1.2 产圈管理
粪-口传播是引起犊牛腹泻的主要传染途径,许多犊牛在出生时就会接触到病原。保持产圈清洁,并在犊牛出生后尽快与母牛分离,是限制病原传播的重要工作程序。当犊牛接触到环境中的母牛粪便时,或当犊牛在试图采食时接触到母牛的乳房,犊牛可能会接触到各种能够导致腹泻的病原,如沙门氏菌。细菌和病毒可以在产圈常用的有机垫料中存活。有研究表明,犊牛出生后与母牛在一起的时间超过1 h是其患隐孢子虫性腹泻的主要风险因素[41]。
3.1.3 饲养环境及饲养方式
在理想状态下,犊牛的饲养环境应保持干净、干燥,排水顺畅,且不会与成年牛的粪污接触。使用犊牛岛个体饲养可减少病原在犊牛间传播,当一头犊牛从犊牛岛转出后,应彻底清理消毒,以免将病原传播给下一头犊牛,同时需对饲养的位置清理消毒或更换。通过环境管理可减少环境中病原的数量,但无法彻底清除病原。群饲的犊牛虽可使饲养空间的利用率更高,且能够通过使用自动饲喂器减少劳动力成本,但也会更加容易使病原在犊牛间传播。如果采用群饲模式,每个犊牛栏内集中饲养的犊牛日龄段尽可能窄一些,最好采用“全进全出”模式,日龄宽度较大的群饲模式不仅便于病原的传播,还会使弱小的犊牛面临采食竞争。有趣的是,研究奶牛福利的学者除了对单独饲养和群饲进行了对比外,最近也有学者对单独和成对饲养进行了研究,结果表明成对饲养的犊牛行为表现优于单独饲养的犊牛,且前者的日增重(ADG)比后者高150 g[42]。
在极端的气候条件下,犊牛健康会受到温度、湿度和风速等因素的影响。Roland等[43]发表的综述中总结了前人的研究成果,认为犊牛的适温区(TNZ)为0~26 ℃,会受到年龄、体重、品种、营养、被毛、行为、垫料及气候的影响。但适温区下限(Tlc)和上限(Tuc)的主要影响因素不同,其中报道的Tlc为0~18 ℃,年龄、湿度和风速的影响最大;而Tuc的证据较少,26 ℃这一指标基于犊牛呼吸率增加而设定。在炎热高温的暑期,为犊牛提供有效的遮阴和通风条件可降低犊牛发病率,对于单独饲养的犊牛,简单地用砖或其他物品垫高犊牛岛即可起到良好的通风作用,可显著降低犊牛岛内温度和二氧化碳浓度,改善空气循环[44]。无论单独饲养还是群饲方式,尽可能将犊牛饲养环境周围的围墙降至犊牛鼻端高度以下,以加强通风,均可降低哺乳期犊牛发病率。对于群饲的犊牛,通风和饲养密度至关重要,哺乳期犊牛的饲养面积最好≥2.8 ㎡,单独饲养的犊牛,犊牛岛的间距以相互间不能直接接触为宜。而在寒冷的冬季,犊牛需要消耗大量的能量御寒,但此时通风与防寒保暖同样重要。
3.1.4 营养及饲喂管理
犊牛摄入充足的营养是保证其机体抵抗力的关键,摄入能量不足的犊牛更易发腹泻,使发病率和死亡率升高。有数据表明[45,46],与传统的牛奶饲喂方案相比,采用更高营养水平喂养的犊牛对疾病的抵抗力更强。Godden等[45]的研究表明,与饲喂代乳粉(20%蛋白质,20%脂肪)的犊牛相比,饲喂巴氏杀菌废弃奶的犊牛日增重(ADG)更高,发病率和死亡率更低。Ollivett等[46]也报道了与饲喂一般营养浓度代乳粉(20%蛋白质,20%脂肪)的犊牛相比,饲喂更高营养浓度代乳粉(28%蛋白质,20%脂肪)的犊牛生长发育状况更佳,并且在用微小隐孢子虫进行试验性攻虫后,有腹泻症状的病程更短。但需注意的是,如果使用经过巴氏杀菌方法处理的废弃奶饲喂犊牛,尽可能不要使用乳房炎患牛的废弃奶,以免牧场在后续出现耐药菌的问题。
为避免病原在犊牛间传播或由大牛传播给犊牛,应注意饲喂顺序、工具的清洗消毒以及工作流程。例如兽医每班工作应从健康犊牛开始,每班工作结束后,应彻底清洁防护用品及工具。
3.1.5 疫苗免疫
目前国内可用于预防犊牛腹泻的疫苗几近于无,国外可用的疫苗以大肠杆菌K99类毒素疫苗和轮状病毒-冠状病毒灭活苗为主。Al Mawly等[47]对新西兰97个牧场的犊牛腹泻风险因素调查发现,为干奶牛免疫接种相关疫苗是降低犊牛腹泻的一个重要因素。
总之,管理是预防犊牛腹泻的最佳方法。国外预防犊牛腹泻的主要原则有3 个:(1)干奶牛的疫苗免疫;(2) 确保良好的初乳管理,确保犊牛能够摄入足量的Ig;(3)通过清洁、卫生管理、饲养环境管理和牧场管理,减少环境中病原数量。使用药物、益生菌或其他功能性饲料控制犊牛腹泻缺乏足够的证据支持,不应视为管理、设施或卫生状况差的牧场的有效解决方案。
3.2 犊牛呼吸道疾病的防控
与NCD一样,BRD的病因十分复杂,其中常见的病原性原因包括细菌性、病毒性、寄生虫性和真菌性病原。常见的病原有支原体、巴氏杆菌、曼氏杆菌、嗜血杆菌、链球菌、牛病毒性腹泻病毒(BVDV)、牛疱疹病毒1型(IBR的病原,BHV-1)、牛冠状病毒(BCoV)、牛呼吸道合胞体病毒(BRSV)和副流感病毒3型(PI3)等。
BRD是导致哺乳期犊牛死亡的第二大原因,也是导致断奶犊牛死亡的第一大原因。尽管BRD的防控在临床上十分重要,但在发病症状明显前能够进行早期诊断和治疗的措施有限。当牛群中长期存在BRD时,牛群的生长发育、繁殖状况、产奶量和使用年限等关键指标均会受到影响,造成大量的潜在经济损失。预防BRD的关键是让犊牛获得足量的母源抗体,建立有效的被动免疫,相关措施参见前文,在此不再赘述。下面将对其他关键因素如通风、疫苗免疫及疾病早期诊断进行叙述。
3.2.1 通风
犊牛在转出产房与母牛分离后的环境可能是BRD的病原菌来源之一。Nordlund[48]调查研究结果表明,大多数情况下通风不足是犊牛罹患慢性BRD的主要原因。通常,牧场的犊牛饲养区以自然通风的设计为主,以降低成本。但自然通风的犊牛舍的空气质量大多很差,尽管通风良好,但犊牛舍空气中的细菌数量仍然很高。对于犊牛岛的设计,建议每头犊牛的最小面积应为3 ㎡,两侧可用实心板或增加犊牛岛间的宽度以避免犊牛间的直接接触,前后可用铁网确保空气流通,在寒冷的气候或地区,可用麦秸或稻草等垫料和马甲为犊牛提供舒适、有效的保温措施。对于群饲模式的牧场,改善空气质量的方法有降低饲养密度、增加饲养面积、降低犊牛饲养区周围挡墙或挡板的高度,并增加辅助机械通风等方式。正压通风管是改善老式牛舍通风的一个很好方法,通过正压通风管,新鲜的外部空气被强制进入正压管道系统,改善舍内饲养环境的通风。
3.2.2 疫苗免疫
由于犊牛出生时免疫系统尚未完全发育,所以对于新生犊牛的疫苗免疫一直存在争议。对于某些病原,母源抗体的保护期可持续数月,如牛病毒性腹泻病毒(BVDV),其保护期可达4~5 个月。而对于牛疱疹病毒1型(BHV-1)和牛呼吸道合胞体病毒(BRSV),母源抗体仅可保护犊牛2~4 周,使之在幼龄阶段即可发生感染。基于病原学和免疫学的研究结果[49],目前国外有少量鼻内接种的疫苗用于免疫新生犊牛,其理论基础为通过粘膜免疫的方式激发细胞免疫以预防有些病原(BHV-1、PI3和BRSV)的感染。但对于其他病原,如多杀性巴氏杆菌、溶血性曼氏杆菌或牛支原体疫苗的使用,仍存争议。这些病原在牛体内的清除以体液免疫为主,犊牛过早的接种疫苗难以产生理想的免疫反应。
3.2.3 疾病早期诊断
对于BRD而言,早期诊断是预防和治疗能否成功的关键。目前可用的早期诊断方法主要有美国威斯康辛大学、美国加州大学戴维斯分校和加拿大圭尔夫大学开发的BRD评分系统,通过这些评分系统,犊牛兽医可根据犊牛鼻分泌物、眼分泌物、耳朵的位置、是否咳嗽和直肠温度等信息快速作出早期诊断,以及时采取干预措施。此外,近年来有学者致力于犊牛肺炎新诊断方法的研究,主要有通过B超等方法进行诊断。
3.2.4 应激管理
虽然大家都理解“应激”一词,但难以给出明确的定义。对于犊牛,应激可理解为其对环境或管理过程中异常刺激的生理或行为反应。这些反应使犊牛能够适应或应对应激的不利影响。热应激、冷应激、饲养密度过大、转群、断奶、去角、营养不良和饲喂管理不稳定等因素都会导致应激,使犊牛更容易患病。应激对免疫系统有很大影响,并能显著增加疾病的发病率。曾有调查研究结果表明[50],犊牛腹泻的最大风险因素是恶劣天气(寒冷)、地面条件差(潮湿、寒冷的牧场)和饲养密度过大,这些因素均会增加犊牛的应激。对于犊牛,病原在环境中是持续存在的,尽管犊牛一直会接触到病原,但疾病暴发多为散发,通常集中在发生应激的阶段。在犊牛饲养的过程中不可避免地会有一些应激,但如何降低应激,使之对犊牛的影响最小,需通过管理手段解决。
3.2.5 患犊管理
患犊可能成为犊牛群的传染源,如果不能尽早作出诊断并采取有效治疗措施,牧场内的犊牛健康管理就很难达到期望目标。与其他阶段的牛一样,如果在发病初期对犊牛作出诊断并进行治疗,治疗效果会更理想。一旦发展为慢性病例,治疗成功率会下降,且可能导致患犊长期排出病原,增加对健康犊牛的感染风险。因此,建议牧场与专业兽医合作,培训犊牛饲养员,使之了解疾病的早期症状,如(1)腹泻患犊的粪便性状;(2)咳嗽、流涕或呼吸困难;(3)头颈歪斜、脐部或关节肿胀;(4)虚弱无力、卧地不起;(5)跛行,等。除了疾病早期症状的培训外,牧场还应与专业兽医合作,制订统一的疾病定义和规范的治疗方案,以免发生病名不统一、超标签用药等问题。但上述问题在国内的牧场,无论是规模化牧场还是私人牧场,都很常见。
4 结语
犊牛健康管理是一个相当大的问题。由于篇幅所限,本文对一些重要的因素进行了梳理,以期对读者有所启发。究其根本,犊牛健康管理的重点应落在“管理”一词。牧场管理是一项系统工程,例如初乳管理会涉及到干奶牛管理、产房管理和新生犊牛管理等多个方面,管理者应正视存在的问题,考虑如何协调部门间的分工协作以及对外合作,使牧场的运营更加平稳顺畅。所以说,“管理”是保障犊牛健康的根本!
