CircRNA在胃癌液体活检中的研究进展
2021-12-07朱昊贾剑超俞兰
朱昊,贾剑超,俞兰
0 引言
胃癌是消化系统最常见的恶性实体瘤之一,GLOBOCAN 2018年的统计数据表明,全球胃癌发病率居第五位,死亡率排名第三;当年我国新确诊胃癌病例数逾45万例,约占全部癌症发病数的10.6%,发病率为30.00/10万,且呈上升趋势[1-2]。近年来,随着内镜技术的迅猛发展和普及,显著提高了胃癌的早诊率,但其五年生存率仍徘徊在20%左右,仍有多数患者确诊时已处于晚期[3-4]。恶性程度较高的胃癌,其进展至晚期的过程也很迅速,手术治疗后仍有可能复发或转移[5-6]。此外,胃癌发生发展各阶段缺乏可靠的早诊、疗效判定、转移监测及预后评估的生物标志物,胃癌患者预后差的现状未得到有效扭转[7-8]。
寻找生物标志物一直是此领域的研究热点,基因检测为胃癌组织分型和靶向治疗提供了依据,但由于检测手段和成本的限制,在短期内普及还很难[9]。液体活检无创且便易,目前临床液体活检的辅助诊断肿瘤标志物,如癌胚抗原(CEA)、糖类抗原19-9(CA19-9)敏感度和特异性相对较低,体液中有多种标志物在胃癌的早诊、疗效和预后评估等方面具有较高的敏感度和特异性;随着研究的深入,液体活检有望成为胃癌早诊和监测的常规检测方法[10-14]。
环状RNA(circular RNA,circRNA)是一类含量丰富的内源性非编码RNA,具有共价闭合环状结构,且生物学特性稳定便于检测;circRNA不仅成为肿瘤靶向治疗领域研究的热点,而且作为液体活检的新主角备受关注[15]。本文就circRNA的肿瘤生物学特性、存在形式、在胃癌早诊、疗效监测及预后评估等方面作一综述。
1 circRNA液体活检的生物学基础
1.1 circRNA的特性、分类与功能
circRNA主要由前体mRNA通过反向剪接形成,其下游的5′剪接位点与上游的3′剪接位点共价连接,使其缺少3′端poly A尾和5′端帽结构,不易被核酸外切酶RNaseR降解[16];同时,研究发现血浆中circRNA的平均半衰期超过48 h,而mRNA仅为10 h[17],表明circRNA比线性mRNA具有更高的稳定性。此外,circRNA丰富且特异,尤其外泌体中的circRNA含量是其分泌细胞中的两倍;且差异表达的circRNA能够用来区分癌症患者与健康人群[18]。这些特性使circRNA的液体活检具有可靠性和可行性。
circRNA含量丰富可能与其形成方式有关,基因组的任何区域均可合成,同一基因也可产生多种类的circRNA[18]。circRNA按不同的编码环化方式主要分为三类:(1)外显子circRNA(exonic circular RNA,ecircRNA),主要通过套索驱动环化形成,也可通过RNA结合蛋白介导的环化形成,在胞质含量丰富,是最常见的circRNA;(2)内含子circRNA(circular intronic RNA,ciRNA),主要由内含子配对驱动的环化形成;(3)外显子-内含子circRNA(exon-intron circular RNA,EIciRNA),是由外显子和内含子共同构成,主要位于细胞核,参与亲本基因调控[19-20]。
circRNA多元化的结构赋予其不同的功能,不仅可作为microRNA(miRNA)海绵,通过竞争性结合miRNA间接调控其下游靶基因的表达;而且,circRNA也是蛋白结合RNA,与RNA结合蛋白的结合可调控基因转录,进而调控蛋白功能;同时还被证实circRNA可行使编码功能,有部分circRNA可以编码多肽,通过该多肽行使下游调控功能[10,18,21]。目前,多项报道已揭示circRNA的异常表达与各类癌症密切相关,参与肿瘤细胞的增殖、侵袭、迁移和凋亡,在癌症基因表达调控中发挥重要作用[10,21]。
1.2 circRNA在体液中的特性
circRNA存在于人体多种体液中,因其不易被RNaseR降解,故能在人类细胞、血浆或胃液中稳定表达[22-23],也为血浆circRNA分析研究提供了先决条件。与尿液、唾液及脑脊液相比,外周血是circRNA液体活检最常用的体液样本[24];根据circRNA在循环血中不同的存在形式可将其分为两类:游离于细胞外的circRNA(cell-free circRNA,cf-circRNA)和血细胞中的circRNA。血液中的circRNA由不同的组织细胞产生并释放进入血液,包括血浆、血清和细胞外囊泡中的circRNA。cf-circRNA作为生物标志物具有追踪其组织来源的临床意义[25-26];单核细胞、红细胞、中性粒细胞和血小板等血液细胞均含有circRNA,不同血液成分中circRNA的异常表达可以反映疾病的状态和水平[26]。circRNA作为生物标志物在全血中代表了个体对不同病理或生理变化的特异性反应[27-29],在液体活检中具有潜在的应用价值。近年来对外泌体深入研究发现,circRNA可借助外泌体进入血液循环。
1.3 外泌体
外泌体是直径为30~100 nm的微囊泡;在细胞内经多囊泡体外膜和细胞膜融合后释放到细胞外基质,外泌体存在于多种体液中,包括血液、尿液、唾液和母乳等,其内容物种类类似于母源细胞,含有组织特异性的生物标志物,除了蛋白质和脂类外,外泌体内还含有大量核酸,如DNA、mRNA、miRNA、lncRNA以及circRNA等,外层的脂质双分子层可保护核酸不被降解[30]。这些核酸经外泌体与靶细胞膜融合被递送到受体细胞,调控受体细胞的蛋白表达、信号通路和表观遗传[31]。
肿瘤circRNA主要通过包装成外泌体的形式分布于循环系统中,肿瘤细胞产生和释放大量的外泌体,即肿瘤来源的外泌体(tumor-derived exosome,TEX),TEX释放量明显高于正常细胞,可介导肿瘤细胞间通讯,将特定的蛋白或核酸转运到肿瘤的邻近组织或远处即将发生转移部位的受体细胞[32-33]。TEX在癌症患者的体液中广泛存在,含有的生物标志物可区别来源于正常细胞的外泌体,二者在血浆中的比例虽因人而异,但更多证据表明TEX占比较大,特别是恶性肿瘤晚期患者[33]。不同类型的肿瘤细胞释放的TEX具有不同的分子特征[32]。因此外泌体可用于临床无创或微创诊断;基于外泌体的诊断可以更高效地监测癌症的分子特征,且血液标本比病理活检更易重复采集[34]。
2 circRNA液体活检在胃癌早期诊断中的作用
circRNA的稳定性使其特异性诊断胃癌成为可能,利用circRNA液体活检技术早期诊断胃癌已成为当前的研究热点。有学者分别分离纯化了80例胃癌患者与健康者血浆外泌体中的circRNA,发现circNRIP1在胃癌患者血浆中表达水平显著升高[35]。Zhang的科研团队使用100对胃癌组织及其相应癌旁组织进行生物标志物研究发现,hsa_circ_0001811在胃癌组织和患者血浆中均低表达:ROC曲线下面积分别为0.658和0.747,两者结合后曲线下面积上升至0.824[36]。另有研究证明血清外泌体circCD2AP诊断胃癌敏感度和特异性分别为75.56%和88.89%[37]。提示不论是hsa_circ_0001811,还是circCD2AP,随着研究的深入,均有可能成为胃癌液体活检诊断的生物标志物。
一些特殊类型的胃炎与胃癌的发生关系密切,这些类型的胃炎可在特定阶段演进发展成胃癌,因此,从重度胃炎中鉴别出早期胃癌尤为重要。例如慢性萎缩性胃炎被认为是胃癌的独立危险因素,尽早诊断该类型胃炎对于早期防控胃癌具有实际作用。为寻找胃癌、胃炎的circRNA差别,有研究收集了120例胃癌患者、104例健康者以及70例胃炎患者的血浆,分析三组的circPTPN22表达水平,发现三组的circPTPN22表达水平胃癌>胃炎>健康,呈梯度关系,差异有统计学意义,该研究同时观察了肿瘤标志物情况,对胃癌、胃炎患者和健康者血浆中的circPTPN22、CEA、CA19-9进行单独和联合ROC曲线分析,在胃癌的诊断效率方面,circPTPN22的AUC值为0.857,敏感度为78%,特异性为84%,总准确度80%,阳性预测值84%,阴性预测值76%,均高于单独分析CEA和CA19-9的上述对应指标。若将circPTPN22与CEA联合分析,其AUC值为0.878,与CA19-9联合后的AUC值为0.866。在胃炎的诊断效率方面,circPTPN22联合CEA后AUC值为0.817,联合CA19-9后AUC值为0.833,三者联合AUC值为0.856,诊断效率虽略低于胃癌,但可以看出,不论是诊断胃癌还是高患癌风险胃炎,将circRNA与肿瘤标志物联合分析,诊断敏感度明显升高,可以弥补单一标志物的局限性,而且circPTPN22作为胃癌早诊生物标志物应用于液体活检具有潜在价值[38]。
胃液是胃内分泌物的总称,可无创收集,所以与大多数体液相比,胃液在疾病诊断、反映胃癌病情方面具有明显的优势[39-40]。有研究发现:hsa-circ-0014717在胃癌组织中的表达水平与肿瘤分期、远处转移、组织CEA和CA19-9的表达显著相关;而且,hsa-circ-0014717能稳定存在于人胃液中,存在形式和浓度均符合临床检测要求。在慢性萎缩性胃炎患者胃液中发现hsa-circ-0014717水平明显降低;基于此研究结果,胃液中的hsacirc-0014717有可能作为先于胃镜检查的广泛筛查慢性萎缩性胃炎液体活检生物标志物[22,41]。但是该研究仅在健康者与胃炎患者的胃液中检测了circRNA的表达差异,却未比较诸如血液等其他体液中的表达差异。Shao等的一项研究在41例健康志愿者以及39例早期胃癌患者血浆外泌体中检测发现,早期胃癌患者外泌体hsa_circ_0065149的水平明显低于健康对照组(P<0.001),并认为血浆外泌体hsa_circ_0065149可作为早期筛选胃癌的生物标志物,比传统的临床生物标志物具有更高的敏感度和特异性;该团队进一步在健康志愿者、胃溃疡患者、慢性萎缩性胃炎患者以及胃癌患者四组人群的胃液中检测hsa_circ_0065149的表达差异,遗憾的是,hsa_circ_0065149在四组人群的胃液中并无显著表达差异[42]。血浆外泌体与胃液中的检测结果不一致究竟是由于样本量的不足,还是不同疾病之间胃液circRNA表达差异与血浆外泌体circRNA差异不相一致?对于某些circRNA作为胃癌早期生物标志物时,用胃液作为血浆的替代液体活检有待进一步论证。
综上,circRNA作为胃癌液体活检的生物标志物比常规肿瘤标志物具有更高的敏感度与特异性,若与CEA等蛋白生物标志物联合检测可能提高诊断的准确性;利用circRNA液体活检技术可对胃癌进行早期筛查和诊断,值得临床推广。
3 circRNA液体活检在胃癌疗效评价中的作用
胃癌耐药是导致治疗低效、癌症扩散和转移的重要原因之一。Huang的研究团队发现:与顺铂治疗敏感的患者样本及细胞系相比,circAKT3在顺铂耐药者的胃癌组织和耐药细胞模型中表达均明显升高,并证明circAKT3是通过抑制miR-198的表达、上调PIK3R1、促使胃癌对顺铂产生耐药[43];血清外泌体circAKT3已被证实在肝癌患者中的表达明显高于正常对照组,其在胃癌患者体液中的表达变化值得进一步研究[44]。另有研究报道,circ_0032821在奥沙利铂(oxaliplatin,OXA)耐药的胃癌细胞内和细胞释放的外泌体中表达显著升高,增强胃癌细胞对OXA的抵抗能力,并促进胃癌增殖、迁移和侵袭[45]。针对circAKT3与circ_0032821的研究均阐述了circRNA参与胃癌产生耐药的机制;表明circAKT3和circ_0032821不仅可以作为耐药型胃癌患者的潜在治疗靶点,还可通过液体活检持续监测接受相应药物治疗患者的耐药状态、评估病情发展、指导临床用药[43-45]。
在治疗胃癌原发灶的同时,严密监测胃癌的转移状态至关重要。肝脏是胃癌转移的主要器官之一,胃癌肝转移患者的5年生存率仅为10%左右。血清外泌体circCD2AP不仅可以用于诊断胃癌,而且其与临床分期、肿瘤浸润深度、淋巴结和肝转移显著相关,circCD2AP在监测胃癌转移能力方面具有潜在的应用价值[37]。
Chen研究团队分别选取104例胃癌患者和健康者血浆样本,通过qRT-PCR检测发现胃癌患者血浆中hsa_circ_0000190表达与健康对照组相比明显下调,且其表达水平与CEA水平正相关[46]。也有研究表明,在36例胃癌患者血浆样本中发现hsa_circ_002059表达水平与TNM分期(P=0.042)、远处转移(P=0.036)、性别(P=0.002)、年龄(P=0.022)等多种胃癌患者临床及病理特征相关[47]。上述两项研究都表明了circRNA液体活检在胃癌治疗过程中监测转移及病情发展中的应用价值,但circRNA液体活检在精准治疗领域的研究仍有待进一步探索。
前文提及的circNRIP1不仅在胃癌患者血浆中表达水平显著升高,而且参与胃癌细胞间信号转导,并诱导上皮细胞间充质转化进而促进癌细胞转移,提示对胃癌靶向治疗circNRIP1的可能性[35]。值得关注的是,Liu的团队在体外成功合成了一种circRNA,命名为scRNA21,并包装成外泌体,使其在胃癌细胞中表达,再通过竞争性吸附miR-21促进胃癌细胞凋亡[48]。即利用circRNA的生物学特性,模仿外泌体的作用原理,将可能成为胃癌治疗的又一利器。
简言之,circRNA的液体活检技术可全程监测胃癌耐药,指导临床用药,并为胃癌靶向治疗的精准施策提供了新的可能性,潜在的临床价值将会受到密切关注。
4 circRNA液体活检在胃癌预后评价中的作用
circRNA与肿瘤负荷程度密切相关,大量研究表明在胃癌患者术前与术后的血液中circRNA表达水平差异显著,通过检测circRNA可以筛选有高复发风险的患者,也可以了解疾病进展和预后情况,利用circRNA液体活检技术评估胃癌预后具有重要的临床意义[26]。良好胃癌诊筛能力的circRNA极有可能同时具有预测胃癌预后能力。Zhang团队研究hsa_circ_0001811用于胃癌早诊的同时,分析42例胃癌患者术前和术后血浆样本与42例健康志愿者血浆样本,证明hsa_circ_0001811在术前术后表达差异存在显著统计学意义[36]。另有研究也发现hsa_circ_002059在36例胃癌患者术前与术后的血浆表达水平具有显著差异,ROC下面积为0.73,敏感度为0.721,特异性为0.683[47]。且hsa_circ_002059与肿瘤分级及远端转移相关,可作为胃癌预测预后标志物[47]。同样,Ma的研究团队通过分析20例初诊接受手术治疗的胃癌患者血浆circPTPN22表达水平,发现同一例患者术后血浆中circPTPN22表达水平显著降低,且生存曲线提示低表达组生存率优于高表达组;意味着circPTPN22用于液体活检可以有效跟踪胃癌术后预后情况[38]。
Xie等研究发现circSHKBP1在胃癌组织和血清中表达均升高,circSHKBP1通过海绵性吸附miR-582-3p促使HUR表达,增加VEGF mRNA的稳定性,促进癌症的恶性表型;此外,circSHKBP1直接与HSP90结合,阻碍STUB1与HSP90的相互作用,抑制HSP90的泛素化,导致胃癌快速进展,其高表达预示着胃癌患者TNM分期较晚以及血管侵犯严重,提示患者的预后不良[49]。所以,胃癌中某些circRNA表达异常导致高度恶性表型,能预测患者预后不良。Li等研究证明hsa_circ_0061276与hsa_circ_0001017在手术前后血浆中的表达水平可作为胃癌复发的独立监测指标;该团队将术前患者血浆中hsa_circ_0001017和hsa_circ_0061276的表达水平按中位数的大小分为低、高表达组,结果显示,hsa_circ_0001017低表达组患者的总生存时间(OS=60月)与高表达组(OS=84月)相比明显缩短,hsa_circ_0061276的水平与患者预后不良有关;进一步单因素和多因素Cox比例风险模型分析表明,血浆hsa_circ_0001017和hsa_circ_0061276可能作为胃癌患者OS的独立预后指标,且hsa_circ_0001017在胃癌不同分期的表达水平也可作为患者无病生存时间(diseasefree survival,DFS)的独立预后指标[50]。Peng等研究揭示hsa_circ_0010882在胃癌患者血浆中高表达且与预后不良相关;该研究通过Kaplan-Meier生存分析发现hsa_circ_0010882高表达与OS缩短密切相关,Cox回归模型显示hsa_circ_0010882可能是胃癌患者OS的独立不良预后因素,提示血浆hsa_circ_0010882高表达可作为胃癌患者的潜在预后预测因子[51]。
5 circRNA液体活检在胃癌诊疗中的应用
circRNA液体活检是一种革命性的胃癌检测方法,能够支持人类胃癌的诊断、预后和治疗指导。circRNA液体活检在胃癌诊疗中的应用,见表1。
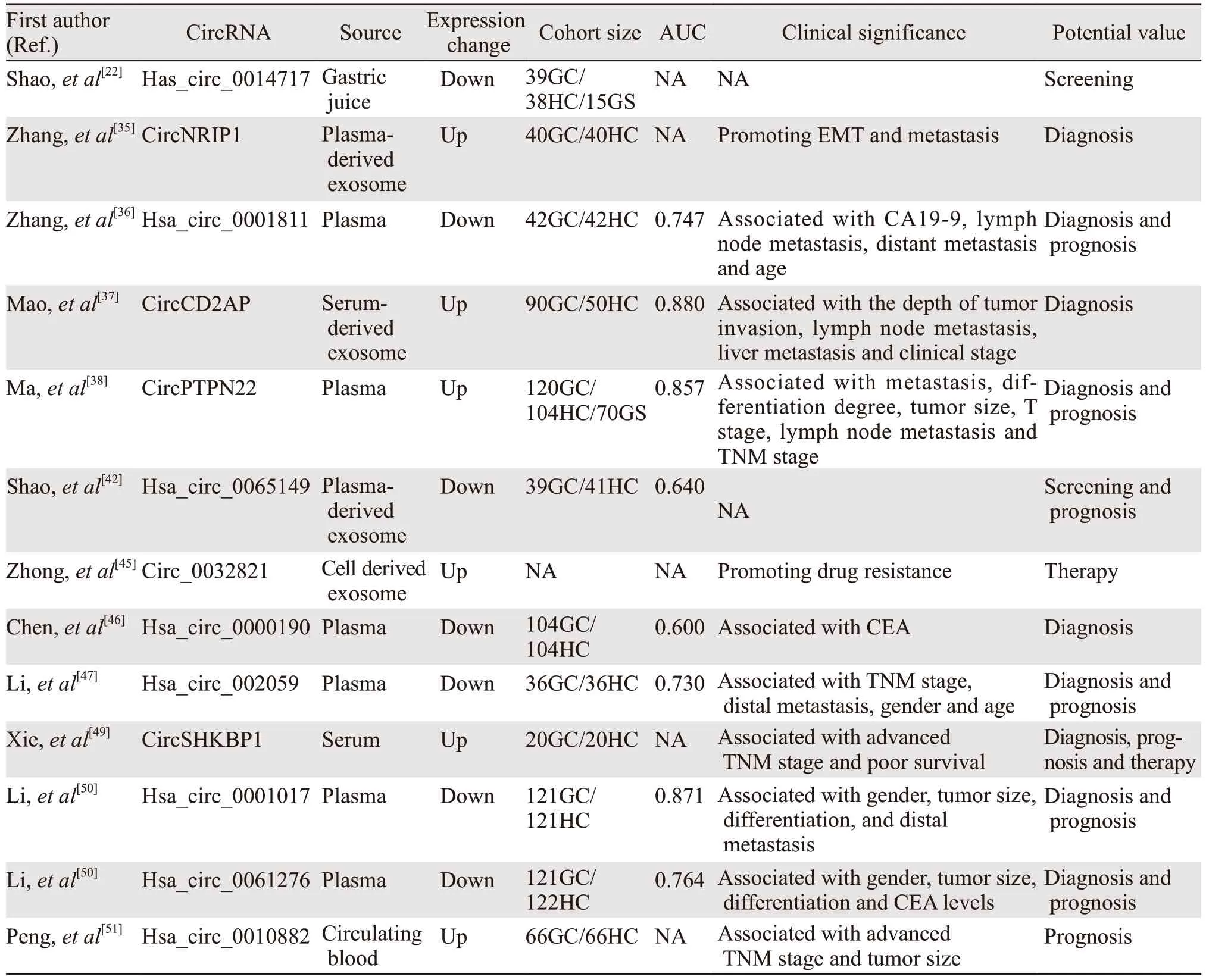
表1 circRNA液体活检在胃癌诊疗中的应用Table 1 Application of circRNA liquid biopsy in diagnosis and treatment of gastric cancer
6 小结与展望
以血液外泌体circRNA为指标的液体活检有助于胃癌的诊断、耐药监测、治疗评价以及预测预后[52];利用液体活检技术监测相关circRNA可以比影像学更早地预测胃癌复发,具有巨大的潜在临床价值[53]。
但其临床常规化仍面临着很多困难与挑战。首先,circRNA种类繁多,胃癌相关的circRNA在人类体液中的表达水平不尽相同,可能在其他癌症中也有表达,作为液体活检的生物标志物需要更庞大、更精细化的研究;其次,检测流程有待规范化,包括体液样本的取材、运送、存储以及检测方法;最后,还需要大数据和多中心的临床前瞻性研究来验证。相信在不久的将来,circRNA液体活检将会在胃癌的精准医疗中发挥重要作用。
