质谱及其联用技术在水中消毒副产物识别和分析中的应用
2021-12-07陈楚泽赵夏婷陈浩然龚婷婷鲜啟鸣
陈楚泽,赵夏婷,陈浩然,龚婷婷,鲜啟鸣
(南京大学环境学院,污染控制与资源化研究国家重点实验室,江苏 南京 210023)
自1974年美国学者首次在氯化消毒后的污水中发现消毒副产物(disinfection byproducts,DBPs)[1],水中DBPs的研究就在水科学和水安全领域得到了广泛的重视,国内外学者为此开展了大量的研究工作,主要关注DBPs的浓度水平、生成机理、毒性等方面的研究。质谱技术(mass spectrometry,MS)是重要的水质分析技术之一,在DBPs的研究中发挥着越来越重要的作用,现简要介绍了DBPs的生成、种类、毒性和检测方法,并重点对MS在水中DBPs识别和分析中的研究进展加以综述。
1 DBPs简介
健康的水环境对生态安全,人体健康至关重要。水环境是各类致病性病原体的传播媒介。天然未经消毒的地表水、地下水中通常含有各类致病菌,与人体接触后会导致许多疾病,如伤寒、霍乱、腹泻等,严重危害人体健康[1-3]。消毒剂能够杀灭水中的致病菌,并且保证水管网的水质安全[4-5],遏制天然水体或者污水排水的疾病传播,对保护人体健康和生态安全起到了极为重要的作用,消毒技术也被誉为是20世纪以来最伟大的公共健康安全成就之一。
常用的消毒方式有氯气、二氧化氯、氯胺、臭氧、紫外线消毒等[6-7],由于氯气消毒工艺简单,成本低廉并且对多种致病菌都有较好的杀灭效率,而且在水管网中具有一定的持久性等优点,因此是使用最为广泛的消毒剂[7-9]。但是在消毒的过程中,水环境中的天然有机物(natural organic matter,NOM)和人造有机物(如农药、药品、洗涤剂、抗生素等)会作为反应物的前体,与氯气等消毒剂发生化学反应生成DBPs[8-9],其中较为常见的是含氯消毒副产物(chlorinated disinfection byproducts,Cl-DBPs)。同时水体中的无机离子、温度、光照、pH值等环境条件,以及水处理的消毒工艺条件(如消毒剂的种类、剂量、接触时间等)也会显著影响DBPs的生成[10-13]。例如,当水体中含有溴离子(Br-)或者碘离子(I-),氯气可以将其氧化为次溴酸或者次碘酸,次溴酸和次碘酸可以进一步和水中的有机物发生化学反应生成含溴消毒副产物(brominated disinfection byproducts,Br-DBPs)或者含碘消毒副产物(iodinated disinfection byproducts,I-DBPs),这使得DBPs的种类扩大了,并且这些Br-DBPs和I-DBPs的毒性通常比同系的Cl-DBPs毒性更强[15-17]。流行病学的研究指出了长期暴露于氯化消毒后的饮用水的人群,罹患膀胱癌的风险增加以及与其他不利健康影响之间的相关关系[18-19]。DBPs作为饮用水中可吸附有机卤化物(absorbable organic halids, AOX)污染的重要部分,大多都属于亲脂性化合物,它们会经过口摄入进入人体,对人体造成慢性毒性副反应并存在三致风险[20]。
截至2020年,已经有超过700种DBPs被识别,其中既有分子量较小的三卤甲烷(trihalomethanes,THMs)、卤乙酸(haloacetic acids,HAAs),也有化学结构更复杂的芳香族卤代DBPs,如卤代酚类、卤代苯醌(halobenzoquinone, HBQs)等[21]。被研究最多的是THMs和HAAs。中国已经制定了饮用水中THMs、HAAs和亚氯酸盐等DBPs的限值标准[22]。美国环境保护局(Environmental Protection Agency, EPA)和世界卫生组织(World Health Organization, WHO)也对THMs、HAAs、亚氯酸盐、溴酸盐等制定了标准限值[23-24]。国内外对饮用水中部分DBPs的浓度限值见表1。
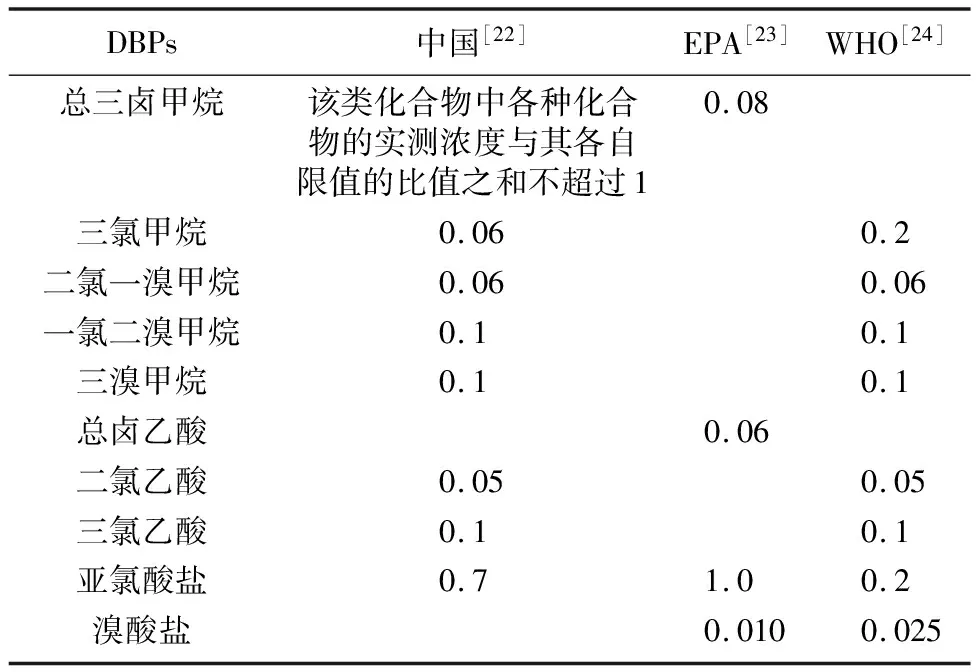
表1 中国、EPA、WHO对饮用水中部分DBPs的浓度限值 mg/L
目前仍有许多其他种类的DBPs尚未被列入到标准中,却可能具有更高的毒性。有研究指出了5类可能具有高毒性的DBPs,包括HBQs、卤代环戊烯酸、N-卤代胺、卤代乙腈(haloacetonitriles,HANs)和卤代乙酰胺(Haloacetamide,HacAms)等[26]。尽管THMs、HAAs等常见的DBPs在消毒后的水体中的浓度较高,但是水中的总有机碳仅有不到40%用于形成它们,并且它们对于毒性的整体贡献也很小,因此现在研究的重点也逐渐转向更多未知类别的DBPs。这些未知DBPs的浓度通常很低,但可能具有更高的生物毒性,并且随着消毒方式和反应前体的种类增多,可能会有更多的未知DBPs生成[10-11,26]。据估计,目前研究中已知的DBPs可能只占氯化消毒后水体中总有机卤素的30%~50%,而这其中,可以进行定量分析的DBPs不到20%,这些定量的DBPs远远不足以代表消毒后水体的总毒性[27-30]。因此,各类DBPs的识别和分析,是DBPs研究极为重要的一步,只有做好这一步,才可以更好地解释消毒后水体的总毒性,全面了解在不同条件下,水体消毒后DBPs的生成和降解情况,这对于水中DBPs的控制十分重要。
2 DBPs前处理及其检测方法
2.1 DBPs前处理方法
水中DBPs的浓度大多处于μg/L~ng/L,且种类多,因此基于质谱及其联用技术针对水中DBPs的分析方法都需要先对水样进行前处理,主要方法包括液液萃取(liquid liquid extraction, LLE)、固相萃取(solid phase extraction, SPE)、固相微萃取(solid phase microextraction, SPME)、气相萃取、衍生化技术、水样分级分离等。
LLE是最常用的DBPs前处理方法,利用DBPs在萃取溶剂和水相中的分配比不同而分离,常用的萃取溶剂是甲基叔丁基醚、正戊烷、正己烷、环己烷、乙酸乙酯等弱极性有机溶剂,LLE主要可以富集极性较弱的,挥发或者半挥发的DBPs,但是有机溶剂用量大。
SPE也是较为常用的DBPs前处理方法,它的原理是利用DBPs和基质分别与固定相填料的作用力不同而分离,然后用洗脱液或者热解吸方法脱附DBPs。SPE可选择的吸附剂种类很多,如C18柱、亲水-亲脂平衡型柱、阳离子交换柱、阴离子交换柱等,选择不同材质的吸附剂,可以针对水样中不同性质的DBPs进行富集。SPE的水样处理量大、富集效率高、有机溶剂用量少[5],但是成本较高。
SPME方法是指将一根纤维表面涂布上一层聚合物吸附剂作为萃取头,把萃取头伸进水样或者顶空进样等,可以对水样或者蒸汽中的DBPs同时进行采样、萃取、浓缩。并且SPME也可以针对不同性质的DBPs进行选择性富集。SPME使得前处理过程大为简化,无须使用有机溶剂,分析时间大大缩短,且较容易实现自动化[10],但该方法的成本较高,微萃取吸附剂也难以重复使用。
气相萃取适用于挥发性大、极性弱的DBPs,包括顶空法和吹扫捕集法。顶空法将样品置于密闭容器,气液平衡后从气相中吸取气体,适合于从液体或固体样品中萃取挥发性有机物,现在多与SPME联合使用。而吹扫捕集则是使用惰性气体组分连续通过样品,将其中的挥发性组分吹扫出来,再利用吸附剂或者冷阱捕集,然后进行脱附分析,吹扫捕集的成本较高,但是容易实现自动化[5]。
衍生化技术则主要针对极性较强、挥发性小的DBPs,如HAAs,有些DBPs的极性基团可能造成色谱峰的拖尾和变宽[6]。通过衍生化试剂降低其极性,使得它们更容易和水基质分离,并且提高MS检测的灵敏度。常用的衍生化试剂如硫酸甲醇、丙醇、2, 3, 4, 5, 6-五氟苯甲基羟基胺、2,4-二硝基苯肼等。
分级分离是指根据水中组分的极性、分子量、疏水性、挥发性等物理性质,对水样的各组分进行分离。常用的方法有树脂吸附分离法、超滤法等。水环境中高风险DBPs的识别可以采取效应导向分析方法(effect directed analysis,EDA),EDA首先需要对水样进行分级分离,使得水样中数以千计的物质分级分离成不同组分,再对各个组分富集后进行生物毒性测试,基于毒性测试的结果对高毒性组分开展化学分析。分级分离是EDA的首要步骤,采取合理的分级分离方法将有助于发现高毒性的组分,再通过靶向或者非靶向分析等发现高风险DBPs。Niu等[31]对中国于桥水库中的DBPs采取树脂吸附分离法进行分级分离,发现疏水性酸是THMs和HAAs的主要前驱物。
2.2 DBPs检测方法
MS可以进行多种有机物和无机物的定性定量分析,是当前水质分析的主要工具。现有对水中DBPs的分离检测主要利用色谱的高效分离能力和MS的定性能力[10,31]。MS的主要原理是让有机分子在电离室吸收能量后,分子丢失一个成键轨道或者非成键轨道中的电子,从而形成分子离子,具有高能量的分子离子再进一步按照各化合物自身特有的碎裂规律分裂成一系列碎片离子。MS的主要构成有进样系统、离子源、质量分析器、离子检测器、显示控制器以及真空系统,其中以离子源和质量分析器为最重要的部件。离子源的发展使得MS的检测范围不断扩大,应用条件更广。质量分析器影响质谱仪的分辨率。根据分辨率大小,可以将质谱仪划分为高分辨率质谱仪和低分辨率质谱仪。高分辨率质谱仪可以对离子的质量进行精确测定,能给出离子的元素组成,而低分辨率质谱仪只能测量到离子质量的整数部分。高分辨率质谱仪准确、可靠,但价格昂贵、操作复杂,对于鉴定未知结构的DBPs具有十分重要的作用。
在DBPs的研究领域,MS通常需要和色谱联合使用来识别和分析不同特性的DBPs,可以分为气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GC-MS)、液相色谱-质谱联用技术(liquid chromatography-mass spectrometry,LC-MS)、离子色谱-质谱联用技术(ion chromatography-mass spectrometry,IC-MS)[10,33]。MS可以作为色谱仪器的检测器,具有可靠、稳定、灵敏度高、适用范围广等优势,并且提供了强大的定性定量分析和结构鉴定的能力。近年来,MS逐渐由靶向分析往非靶向分析发展,现有高分辨率质谱仪主要包括飞行时间质谱(time of flight mass spectrometry,TOFMS)和三重四极杆质谱(triple quadrupole mass spectrometry,tqMS)等,超高分辨率质谱(ultraperformance mass spectrometry,UPMS)主要包括傅里叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance mass spectrometry,FT-ICR-MS)和轨道阱质谱(orbitrap mass spectrometry,orbitrap-MS)等。MS的分辨率不断提高,在复杂样品中也可以对大量DBPs进行分析,可以精确地测得待测分子的分子质量,以及碎片离子的分子质量、元素组成、卤素同位素的分布情况等[33-34],从而鉴定未知DBPs的结构。这些MS的使用在非靶向DBPs的识别和分析中起到了极为重要的作用。并且经由MS得到的数据,可以和不同的数据分析软件结合,对质谱图进行分析[10]。
3 质谱及其联用技术在水中DBPs识别和分析中的应用
3.1 GC-MS在水中DBPs识别和分析中的应用
GC-MS是针对挥发性、半挥发性、分子量较小并且具有热稳定性的DBPs分离检测的最主要工具。气相色谱(gas chromatography,GC)是利用气体作为流动相,载气载着待分离的组分通过色谱柱的固定相,使得各组分分离,然后分别检测,常用的色谱分离柱是毛细管色谱柱。在GC-MS技术中,MS是作为GC的检测器而发挥作用的,不仅为GC提供了丰富、可靠的定性参数,而且作为一种通用检测器,其灵敏度也是远远高于GC的氢离子火焰检测器、热导检测器等。GC-MS还具有操作简单、灵敏度高、产生丰富的碎片离子、具备标准质谱图数据库等优点[31]。在DBPs的研究中,常用GC-MS包括气相色谱-四极杆质谱(gas chromatography quadrupole mass spectrometry,GC-qMS),气相色谱-飞行时间质谱(gas chromatography time of flight mass spectrometry,GC-TOFMS)等。
不同的GC-MS会配置不同的离子源,针对DBPs分析主要有电子轰击离子源(electron impact ionization, EI)、化学离子源(chemical ionization, CI)、大气压化学离子源(atmospheric pressure chemical ionization,APCI)等。GC-MS最常用的是EI,它的原理是利用高能电子轰击样品分子,使得样品分子电离。EI最常使用的电子能量是70 eV,在这个能量下,电离效率高,离子碎片情况较为固定,并且还可以查阅相关的GC-EI-MS质谱谱图库,如NIST数据库和Wiley数据库等,可以快速与待测物质相匹配,对其进行鉴定。Chen等[35]利用GC-EI-MS,研究了不同的进样口温度下THMs的分解情况,当进样口温度过高时,会使得它们的质谱失真,从而导致质谱图与质谱数据库有偏差。针对沸点较高的HAAs类物质,不能直接通过GC-MS进行分析,却可以先对HAAs进行衍生化前处理,再通过GC-MS进行分析[36]。同时由于EI产生的电子能量较高,会使得待测物分子产生较多的碎片离子,也可能发现新型DBPs。有研究利用GC-EI-MS,配合NIST数据库首次鉴定了新的一类含氮的DBPs、2-氯苯基乙腈和3,4-二氯苯基乙腈,并且使用标准物质辅助定性定量分析[37]。也有许多研究采用GC-EI-MS建立对多类DBPs的分析方法。Daiber等[38]利用GC-EI-MS,配合NIST以及Wiley数据库,同时对27种产生于泳池水的DBPs进行定量分析,包括4种THMs、9种HAAs、4种HANs、1种卤代醛(haloaldehydes)、1种卤代硝基甲烷(halonitromethanes,HNMs)和4种HacAms。一些研究使用GC-EI-MS/MS建立了对8种N-亚硝胺(nitrosamines,NAs)的分析方法,采用串联MS可以进行选择离子扫描(selected ion monitor,SIM)和多重反应检测(multiple reaction monitoring,MRM)的检测模式,增强了方法的定性定量分析能力[39-41]。Carter等[41]利用GC-EI-MS,采用SIM模式,建立了同时针对9种HANs、9种HacAms和7种HNMs的靶向分析方法。
但是EI的电离能量强,会导致大部分的待测物分子形成碎片离子,而分子离子难以被检测到,CI则可以弥补这一缺点,它让高能电子首先轰击离子源内的反应气体如甲烷、异丁烷等,电离后的反应分子再与试样分子碰撞生成分子离子等,属于一种软电离的方式。试样分子经CI电离后更容易产生完整的分子离子,生成的质谱图也易于解释,有助于对其进行定量分析和结构鉴定。Jia等[42]利用GC-MS,采用电子捕获负化学电离源,建立了对人体血浆、尿液的生物样品中9种HAAs的定量分析方法。Charrois等[43]采用GC-CI-MS实现了对8种常见NAs的ng/L的检测水平,方法表现出较好的灵敏度和选择性,并且首次在饮用水中检测到了N-亚硝基吡咯烷和N-亚硝基吗啉。APCI是通过电离空气和溶剂的中性分子,产生H3O+等离子,这些离子和待测物的分子结合,使得待测物分子离子化。APCI也属于一种软电离方式,相比于CI源,APCI在大气压下工作,离子停留时间更长,电离更为充分,检测灵敏度更低。有研究表明,对人体血浆样品中的多氯联苯进行定量分析时,运用GC-APCI-MS建立的定量分析方法的检测限要低于GC-CI-MS[44]。
GC-MS可选择的质量分析器种类很多,当GC和高分辨率质量分析器相结合,就可以对大量的DBPs进行靶向或非靶向的分析[4,10],大大提高了分析的可靠性。常见的高分辨率质谱仪包括飞行时间质谱(TOFMS)和四极杆-飞行时间质谱(triquadrupole time of flight mass spectrometry,QTOFMS)等。Kimura等[45]利用GC-TOFMS建立了一种同时对6大类39种没有列入标准限值的DBPs的定量分析方法,包括HANs、HNMs、I-THMs、HacAms、卤代乙醛、卤代酮,同时TOFMS准确测定待测物分子量以及通过软件分析与数据库比对,发现了2类新型DBPs。Daiber等[38]利用GC-TOFMS,在高分辨率模式(25 000)和超高分辨率模式(50 000)下,识别消毒后泳池水中产生的不存在于NIST或者Wiley数据库的DBPs,从中筛选出含有Br或者Cl的分子,精确测定其分子离子或者碎片离子的分子质量,并推测其化学结构,鉴定了溴咪唑这一类新型DBPs。Nihemaiti等[46]采用了GC-QTOFMS的全扫描模式,研究了间苯二酚氯胺化后产生的新型含氮DBPs,基于高分辨MS检测到的精确分子质量,首次鉴定了几种新的含氮杂环DBPs。
3.2 LC-MS在水中DBPs的识别和分析中的应用
LC-MS的分析对象主要是极性的、分子质量较大、热稳定性较差的DBPs,这些DBPs通常不能直接通过GC-MS来进行分析[4,10],LC-MS的分析范围相比于GC-MS也更大一些,尤其是针对芳香族DBPs,它们常常含有羟基、醛基、羧基等。大部分被列入标准限值的DBPs都属于脂肪族DBPs,但是它们对毒性的贡献却较低,因此对于未知的芳香族DBPs的研究就十分重要[46]。LC是利用液体作为流动相,使得待测组分流经色谱柱进行分离,最常用的是反相色谱柱。在LC-MS中,MS充当LC的检测器,可以提高LC的定性能力,以及检测的灵敏度。在DBPs研究领域,常用的LC-MS有液相色谱-四极杆质谱(liquid chromatography quadrupole mass spectrometry,LC-qMS)和液相色谱-飞行时间质谱(liquid chromatography time of flight,LC-TOFMS)等。
LC-MS配置的离子源主要有电喷雾离子源(electrospray ionization,ESI)和APCI,最为常用的离子源就是ESI。ESI的原理在于将待测物溶液从毛细管喷射出来,从电场中获得电荷并且不断分裂,直到产生稳定的单电荷或者多电荷离子,ESI不仅离子化效率高,还具备多种离子化模式。现有的ESI可以安装在qMS、TOFMS等多种质谱仪中,在DBPs研究中的应用十分广泛。Hu等[26]使用HPLC-ESI-tqMS,对于模拟天然水体氯胺消毒后产生的3种HBQs进行定量测定,并且对影响HBQs的生成因素进行了探究。类似的,Zhao等[47]对9个污水处理厂出水氯化消毒后的水样,使用HPLC-ESI-tqMS,结合MRM检测方法,对其中8种HBQs进行了定量测定。针对一些不能直接通过GC-MS进行分析的NAs,如N-亚硝基二苯胺,LC-MS则可以对其进行分析。Qian等[48]利用固相萃取法与HPLC-ESI-MS/MS,同时对水中14种NAs进行定量分析。除了常用的ESI,APCI也是一种可用于DBPs分析的离子源,相较于ESI对于极性高的物质电离效果好,APCI对于中等或者弱极性的物质有更好的效果,可以认为是ESI的补充。Chu等[49]利用HPLC-APCI-tqMS建立了同时对13种HacAms的检测方法,APCI方法对于13种HacAms具有更高的选择性,更适用于中等极性的化合物,Chu等[50]利用类似的方法还研究了氯霉素等抗生素生成HacAms的产率。
近年来,前体离子扫描技术(precursor ion scan,PIS)也逐渐被用于DBPs的分析。PIS是通过碰撞诱导解离,选择性地检测特定的分子离子,从中筛选出含有Br或者Cl的离子,再用于进一步的测定。在复杂且未知的反应体系中,PIS可用于DBPs的非靶向分析。由于在实际水体中,NOM氯化消毒后产物种类很多,在常用的ESI下,全扫描的谱图在各个质荷比下都可能有离子存在,这对于鉴定是不利的。Zhang等[13]对食盐和自来水模拟氯化的过程中产生的I-DBPs进行了非靶向分析,使用HPLC-ESI-tqMS,并且采用了PIS扫描技术,设定PIS为127,可以高效鉴定出I-DBPs,并利用MRM、标准物质比对等进一步确定其化学结构。类似的研究还有使用HPLC-ESI-tqMS,设置PIS为126.9,鉴定了产生于氯化饮用水的17种I-DBPs[51]。Pan等[52]设置PIS为127,利用HPLC-ESI-tqMS,鉴定了19种新I-DBPs,并且比较了不同消毒条件下,新型I-DBPs的生成情况以及江苏省多地区I-DBPs的存在情况。Zhang等[53-54]利用HPLC-ESI-tqMS,针对模拟水体氯化消毒后产生的芳香族或者不饱和脂肪族Br-DBPs进行检测,设置前体离子扫描为79或81,辅助以MRM扫描,鉴定了54种Br-DBPs,并且新发现了6种新Br-DBPs。有研究针对不同浓度的Br-下,通过设置前体离子扫描为79或81,35或37,发现了4类11种新型的卤代芳香族DBPs,并进一步证实了这些物质是NOM消毒过程最终产生HAAs、THMs等产物的重要中间体[55]。
当HPLC和具有高分辨率的质量分析器结合,就可以精确测量分子离子与碎片离子的分子质量、元素组成、卤素同位素的分布情况等,对于推测未知DBPs的非靶向分析很有帮助。例如,有研究对酪氨酸和色氨酸在氯化过程中产生的未知DBPs进行分析,使用了HPLC-orbitrap-UPMS进行鉴定,精确测定了碎片离子的分子质量,鉴定了多达27种可能生成的DBPs分子,并且推测了反应路径[56]。低分辨率MS测得的分子质量可能有较多的组合,而高分辨率质谱仪精确测定后,则有助于确认物质的分子式,进一步推测其化学结构。Zheng等[57]利用LC-ESI-QTOFMS鉴定了22种双酚S的氯化产物,推测了反应路径,并且评估了双酚S氯化产物的内分泌干扰特性。基于QTOFMS可以精确测定分子质量以及氯同位素的分布,Huang等[58]利用高分辨率的QTOFMS鉴定了3种二肽化合物的6种主要的氯化产物,虽然TOFMS 的高分辨率和高灵敏度能够满足大多数物质的检测,但在痕量水样分析,尤其是当分析物浓度非常低时,QTOFMS可以克服这些局限性,相比于TOFMS,更适合用于未知DBPs的分析[31,59]。
3.3 IC-MS在水中DBPs的识别和分析中的应用

3.4 UPMS在水中DBPs的识别和分析中的应用
近年来,一些UPMS也逐渐应用于DBPs的分析中,尤其是针对未知、复杂的样品,UPMS可以精确地分离待测物以及测量待测物的分子量,同时也兼备高灵敏度。部分有利于非靶向分析的HRMS,如TOFMS、QTOFMS等尽管分辨率较高,但是灵敏度相对较低,对于水中的痕量污染物的定性定量分析能力往往较差,UPMS如FT-ICR-MS,或者orbitrap-MS则可以同时实现较高的灵敏度和分辨率[10,63]。
FT-ICR-MS发展自ICR-MS,它通过检测各种离子的回旋频率的方法来获得质谱信息,利用快速傅里叶变换将离子的频率信号转变为质谱信号。它同时具有高分辨率、检测限宽等优点,其中高分辨率是FT-ICR-MS最大的优势,它可以实现比其他MS更高的分辨率和质量准确度[64],分辨率可达1 000 000(质荷比为400处),而一般的TOFMS分辨率只可达60 000。但是FT-ICR-MS造价较昂贵,限制了它的广泛使用,并且相对较慢的数据采集速度也使得它和GC或者LC的联用较为困难[65]。Lavonen等[66]利用FT-ICR-MS表征氯化消毒以及氯胺消毒后水中产生的未知I-DBPs,检测到了近200种含碘产物分子,并且探究了氯胺消毒和氯气消毒的产物差异。Zhang等[67]利用FT-ICR-MS探究了在氯气消毒过程中,NOM的变化和相应的DBPs的生成,发现氧化性较低的NOM分子更倾向于和氯气发生反应,并且鉴定了659种一氯化物和348种二氯化物分子,这些新物质中只有1/7在过去曾被发现。类似的,Lavonen等[66]利用FT-ICR-MS,测定污水处理厂出水氯化消毒后产生的DBPs,发现了499种DBPs分子,并且发现不同的消毒条件,生成的DBPs分子会有较大差异。Zhang等[68]还利用FT-ICR-MS探究了水中NOM氯化后未知的Br-DBPs生成情况,鉴定了44种一溴化物分子和37种二溴化物分子,并且绝大多数都是过去未曾发现的分子。Xiang 等[69]利用FT-ICR-MS探究NOM经过高级氧化法前后的变化,发现了226种未知的DBPs分子以及反应产物的芳香性减弱的现象。Ruan等[71]利用FT-ICR-MS探究了紫外线/氯气高级氧化工艺下,NOM的转化与Cl-DBPs的形成,经过紫外线/氯处理后,共观察到833个含C、H、O、Cl原子的化合物,且以一氯化物为主要成分。
Orbitrap-MS又称为静电场轨道阱质谱。轨道阱是指使得离子围绕一个中心电极的轨道旋转而捕获离子的装置。轨道阱形状如同纺锤体,它由纺锤形中心内电极和左右2个外纺锤半电极组成,在轨道阱内产生特殊几何结构的静电场,使得离子同时进行围绕中心电极的圆周运动和沿着中心电极的垂直和水平震荡,离子的质荷比则可以通过轴向场的离子简谐运动频率而推得。Orbitrap-MS可以实现很高的质量分辨率和准确度,分辨率可达到150 000~240 000[64],并且成本相较于FT-ICR-MS要低,随着离子的质荷比变大,分辨率下降也更慢。Wendel等[71]利用orbitrap-MS研究了氯气、氯胺以及二氧化氯消毒后,含I的X射线造影剂碘帕醇等物质的降解情况,发现只有很小一部分底物转变成已知的小分子DBPs,而大部分底物都转变为大分子量的DBPs,并且精确测得了其分子量。Prasert等[72]利用orbitrap-MS研究了旱季和雨季的天然水体经过氯气或二氧化氯消毒后的产物特征,并且鉴定了超过百种新生成的Cl-DBPs。Noelia等[73]利用 orbitrap-MS鉴定了几种抗癌药物的氯化产物,测到了65种DBPs分子,尽管由于缺少标准物质,许多DBPs尚不能完全识别,但是这些分子的化学式以及碎片离子等可以扩充现有数据库。Taku等[74]经由污染物致突变性检测(Ames)实验发现经过氯化消毒后的水体会产生致突变产物,利用orbitrap-MS/MS与MRM分析,精确测定了新生成的DBPs分子量并对具有致突变性的产物的分子结构进行推测。
4 展望
至今,DBPs的研究已经取得了长足的进展,MS在DBPs的研究领域也发挥着越来越重要的作用。水环境中的各类天然或者人工合成有机物、无机离子等,在消毒过程中会生成DBPs,影响水质安全。现阶段,仍有许多种类的DBPs没有被识别和分析,已发现的DBPs的毒性贡献和总毒性之间还存在差距,并且随着新型消毒剂的开发,也会有更多新的DBPs生成。MS已经成为水质监测的主导技术之一,它强大的定性定量能力在DBPs的研究中将会发挥更重要的作用。在未来,更多的离子源(如CI,APCI等)的结合使用,有望拓展MS对DBPs的检测范围。此外,现有MS随着分辨率的增加,其占地、成本都显著提高,这对于DBPs的快速监测和实时监测都是不利的,在未来,便携式的小型质谱仪可能会成为科研工作者快速监测DBPs的工具。同时,MS技术依旧需要实现更高的分辨率和灵敏度,在复杂基质中对多种污染物的检测,发现更多新的DBPs,尤其毒性贡献大的DBPs[31],才能更有针对性地对其进行控制,降低消毒后水的总毒性,并且为标准制定提供合理依据,保护生态安全和人体健康。
