壮药大火草抑制非细菌性前列腺炎模型大鼠炎症反应
2021-12-06王文杰史宏张静韦玉娜陆良喜陆杰叶斌汪磊
王文杰,史宏,张静,韦玉娜,陆良喜,陆杰,叶斌,汪磊
(1. 广西中医药大学 基础医学院,南宁 530001;2. 广西中医药大学 赛恩斯新医药学院,南宁 530222)
前列腺炎是一种常见的尿路综合征,是继前列腺癌和良性前列腺增生之后男性的第3大常见泌尿系统疾病[1]。流行病学数据显示,前列腺炎占泌尿外科门诊数量的29%,而且由于其病因复杂,发病机制不明,导致临床上对前列腺炎的治疗效果欠佳[2]。大火草[Anemonetomentosa(Maxim.)Pei]属于毛茛科银莲花属,是云南民间常用草药之一,发现于广西壮族自治区,具有解热镇痛、抑炎抗菌、抗肿瘤等生物学活性,是临床上壮医常用的特色药之一[3-5]。相关基础实验及临床数据显示,大火草能较好地抑制前列腺炎,是临床上治疗前列腺炎的中药——前列饮中的主要成分之一[6-8]。为初步探讨壮药大火草对前列腺炎的治疗机制,本研究采用λ-角叉胶诱导SD大鼠非细菌性前列腺炎模型[9],采用不同剂量大火草治疗模型大鼠,观察其腺体组织的炎症反应程度及细胞因子水平,以期为大火草的临床应用提供更多的理论依据。
1 材料与方法
1.1 大火草煎剂的制备大火草由南宁市景昌中药饮片有限公司生产,于中医药壮瑶医药实验教学中心传统炮制实验室B901制备大火草煎剂。制备过程如下:将大火草置于煎煮容器中,先加入冷水没过药材浸泡30 min,再加入相当于药材量5~8倍的冷水煮沸30 min,过滤。于药渣中再加入5倍的冷水,煮沸30 min,过滤。收集2次过滤所得药液,2 775×g离心10 min,取上清液。采用旋转蒸发器将上清液浓缩至每毫升含生药量4.39 g,再将其配制成浓度为2.92 g/mL和1.46 g/mL的大火草煎剂。
1.2 模型的构建适应性饲养12只雄性SD大鼠,体质量220~250 g,SPF级。1周后,禁食8 h,期间自由饮水。模型组大鼠按照30 mg/kg剂量的戊巴比妥钠溶液腹腔注射麻醉;腹部剃毛并用医用酒精消毒,于腹部正中切开2~3 cm的切口,打开腹腔。用手术镊轻轻提起膀胱,暴露出附着于膀胱颈部的前列腺体;用1 mL注射器将0.1 mL 1% λ-角叉胶(购自上海阿拉丁生化科技股份有限公司)注射于大鼠前列腺背侧叶,轻柔归位前列腺体和膀胱,缝合肌肉组织及皮肤,待大鼠苏醒后继续饲养。对照组大鼠在相同部位注射等量生理盐水。分别于造模后24、48和72 h取大鼠前列腺组织切片,H-E染色观察组织病理学情况,评估模型构建是否成功。
1.3 实验的分组与处理将SD大鼠随机分成4组——对照组、模型组、大火草高浓度组和大火草低浓度组,每组3只。除对照组外,其他3组均按照上述模型构建方法操作,造模当天即开始各组大鼠的灌胃处理。对照组和模型组大鼠均进行4 mL/(kg·d)的生理盐水灌胃,大火草高浓度组和低浓度组分别用含生药2.92 g/mL和1.46 g/mL的大火草煎剂灌胃,4 mL/(kg·d),连续灌胃4周。药物干预结束后,戊巴比妥麻醉,腹主动脉采血,处死后收集大鼠前列腺体,称取质量并拍照,保存于4%多聚甲醛固定液中,用于后续实验。
1.4 H-E染色观察大鼠前列腺组织病理学情况将分离的大鼠前列腺组织保存于4%多聚甲醛固定液中,1~2 d后取出组织,将其切成大小为1.5 cm×1.5 cm×0.3 cm的组织块,放于包埋盒中浸蜡包埋。将包埋好的组织样本切成厚度为4~5 μm的切片,脱蜡后苏木精染色5 min,PBS漂洗后促蓝液返蓝,伊红染色3 min,PBS漂洗。梯度乙醇脱水,二甲苯透明,中性树脂封片,于显微镜下观察摄片。
1.5 ELISA检测大鼠血清中细胞因子的水平从采集的腹动脉血中分离得到血清,再根据ELISA试剂盒(购自武汉贝茵莱生物科技有限公司)说明书操作:将标准品按照规定的浓度梯度稀释,取50 μL不同浓度的标准品滴加于酶标板的标准品孔中。在酶标板上的待测样品孔中先加40 μL待测样本,再加入10 μL相应的抗体,混匀后每孔加入50 μL的酶标试剂,室温孵育30 min。洗涤液漂洗5次后,加入显色剂,混匀室温避光显色10 min,再加入50 μL终止液终止反应。酶标仪调零后,检测各孔光密度[D(450 nm)]值,根据标准品浓度及其D值绘制标准曲线,得到回归方程式,再根据待测样本的D值计算样本浓度。

2 结果
2.1 大鼠模型的鉴定λ-角叉胶注射后24、48和72 h,可观察到大鼠前列腺腺体发生肿大,且随着时间的延长,肿大越明显,腺体质地坚硬,与周围组织粘连。通过病理切片观察发现,与对照组比较,模型组大鼠腺体中的炎症细胞浸润现象严重,且呈一定的时间依赖性(图1)。以上观察提示,λ-角叉胶成功诱导了大鼠非细菌性前列腺炎模型。

注:A. 对照组;B. 模型组(24 h);C. 模型组(48 h);D. 模型组(72 h)。图1 H-E染色观察大鼠前列腺组织病理学状况(×200)
2.2 大火草对前列腺炎大鼠腺体表观特征的影响收集各组大鼠前列腺腺体,称取质量后,计算其与体质量的比值得到前列腺指数,并比较各组腺体大小,结果显示,各组间差异均无统计学意义(均P>0.05,图2、表1)。

注:A. 对照组;B. 模型组;C. 大火草高浓度组;D. 大火草低浓度组。图2 各组大鼠前列腺腺体大小比较
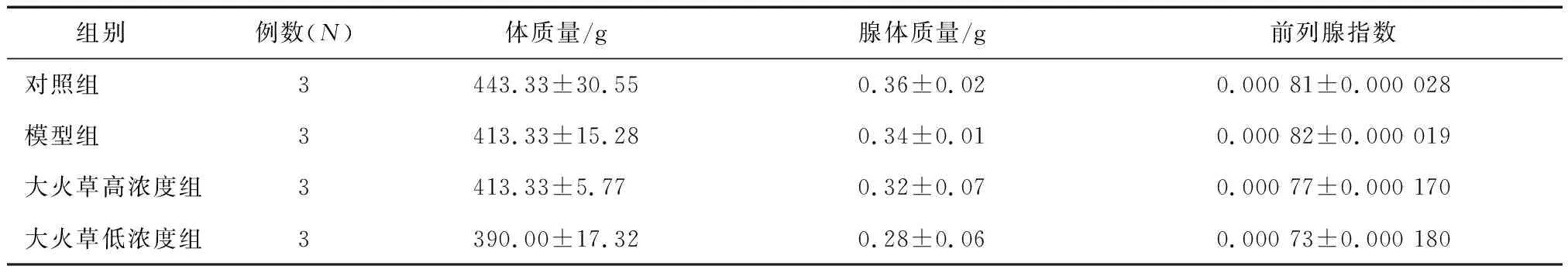
表1 各组大鼠体质量、腺体质量及前列腺指数比较
2.3 大火草对前列腺炎大鼠腺体组织病理学特征的影响与对照组比较,模型组和大火草低浓度组的前列腺组织切片中出现大量嗜酸性颗粒,炎性细胞浸润严重,而经高浓度的大火草煎剂治疗后大鼠的前列腺组织中炎性细胞数量明显减少(图3)。
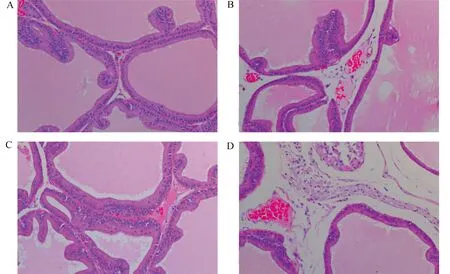
注:A. 对照组;B. 模型组;C. 大火草高浓度组;D. 大火草低浓度组。图3 H-E染色观察大火草对前列腺炎大鼠腺体组织病理学特征的影响(×200)
2.4 大火草对前列腺炎大鼠血清中细胞因子水平的影响与对照组比较,模型组大鼠血清中IL-2、IL-4、IL-8、TNF-α和IFN-γ水平均显著升高(均P<0.05),而IL-10水平显著降低(P<0.05)。与模型组比较,大火草高浓度组和低浓度组血清中IL-2、IL-4、IL-8、TNF-α和IFN-γ水平显著降低(均P<0.05),IL-10水平显著升高(P<0.05)。而且,高浓度组比低浓度组效果更显著(均P<0.05,表2)。

表2 各组大鼠血清中细胞因子水平比较
3 讨论
前列腺炎是泌尿男科常见疾病之一,其发病率为4%~25%,而慢性非细菌性前列腺炎为临床分型中最常见类型,占前列腺病例的90%~95%,患者有长期、反复的骨盆区不适、疼痛等临床特征,甚至伴随着排尿和性功能障碍等症状,严重影响患者的生活质量[10]。慢性非细菌性前列腺炎致病因素不明确,目前治疗该病的主要方法包括行为治疗、针灸、物理热疗、按摩、中西药物等[11]。中医药在治疗慢性前列腺炎方面积累了丰富的经验,而且疗效肯定,方法多样,具有独特的优势[12]。大火草具备清热祛湿、益气补肾、利尿通淋等功效,对其药理作用分析发现该药可发挥抗氧化、抑炎、抗肿瘤等作用,对前列腺炎治疗效果较好[13-14]。
本次研究采用λ-角叉胶诱导SD大鼠非细菌性前列腺炎模型,并用大火草煎剂灌胃治疗模型大鼠,治疗周期结束后,各组大鼠的前列腺指数无显著差异(均P>0.05)。相关文献报道,在大鼠前列腺左右侧叶各注射50 μL λ-角叉胶,术后7 d观察大鼠前列腺腺体,其解剖学观察及腺体指数均与假手术组存在明显差异[15]。因此,推测导致本研究结果的原因可能是4周的治疗周期里,模型组大鼠经过自我免疫修复,从而与其他组腺体的基本特征之间的差异减少。但对前列腺进行组织病理学观察,发现其腺体切片中炎性细胞浸润严重,而经过大火草治疗后(尤其是高浓度的大火草),组织浸润的炎性细胞数明显减少。
细胞因子在免疫炎症反应中发挥着重要的生物学作用,为前列腺炎的临床治疗提供了新思路,已发展为临床研究的热点,其中包括IL-2、IL-6、IL-8、IL-10、INF-γ及TNF-α等[16]。检测慢性前列腺炎患者血清中细胞因子水平,结果显示IL-2、IL-4、IL-6、IL-8和TNF-α水平显著高于健康对照组[17]。IFN-γ也是一种促炎性细胞因子,与TNF-α一样,在前列腺炎的中西医分型中存在显著差异[18]。IL-10是一类抑制性细胞因子,可抑制促炎细胞因子的产生,降低促炎因子TNF-α水平,提高IL-10水平,调节机体免疫反应,可影响前列腺病理形态变化,发挥治疗作用[19]。本研究结果显示,经大火草治疗后的慢性前列腺炎大鼠血清中IL-2、IL-4、IL-8、TNF-α和IFN-γ水平显著降低,IL-10水平显著升高,且使用高浓度大火草比低浓度效果更显著(均P<0.05)。
综合本研究结果,提示大火草治疗非细菌性前列腺炎效果显著,可显著减少促炎性细胞因子水平,抑制前列腺组织中的炎症反应,结合其在前列腺炎方面的临床疗效,用其治疗前列腺炎值得推广应用。
