敲除MSTN基因可上调骨骼肌胰岛素信号通路并减轻2型糖尿病小鼠胰岛素抵抗*
2021-12-06柳杨青汪艳芳
柳杨青, 汪艳芳
(河南省人民医院/郑州大学人民医院/河南大学人民医院 1编辑部,2内分泌科,河南郑州450003)
肌肉生长抑制素(myostatin,MSTN)是转化生长因子β 超家族成员之一,可显著抑制肌肉增生、肥大[1]。MSTN 除可负向调控骨骼肌质量外,在蛋白质、脂肪和糖代谢调节中也发挥重要作用。既往研究表明,2 型糖尿病(type 2 diabetes mellitus,T2DM)及胰岛素抵抗人群血清和骨骼肌中MSTN 水平升高[2];T2DM 小鼠骨骼肌 MSTN 表达增加,接受 MSTN抗体注射后,空腹和餐后血糖水平降低[3]。推测MSTN可影响机体对葡萄糖的摄取和利用,参与胰岛素抵抗的发生。但迄今为止MSTN 参与调节T2DM胰岛素抵抗的分子机制尚不明确。本研究以MSTN基因敲除小鼠为基础,采用高脂饮食联合小剂量链脲佐菌素注射构建T2DM 动物模型,探究MSTN基因对T2DM 小鼠胰岛素抵抗及骨骼肌胰岛素信号通路的影响,现报道如下。
材料和方法
1 材料
1.1 实验动物 采用CRISPR/Cas9 技术及高通量电转受精卵方式构建杂合型MSTN基因敲除(MSTN+/-)小鼠,通过繁育及PCR 鉴定获得纯合型MSTN基因敲除(MSTN-/-)小鼠 12 只,杂合型MSTN基因敲除(MSTN+/-)小鼠 12 只,野生型(wild type,WT)小鼠12只,品系C57BL/6N,6周龄,雄性,由赛业生物科技有限公司提供。小鼠饲养于河南大学医学院动物房[动物实验许可证号SYXK(豫)2016-0006],室内温度22~24 ℃,湿度40%~60%,保持昼夜12 h 节律,自由进食饮水,适应性饲养1 周。本研究遵循动物伦理和实验准则。
1.2 主要仪器与试剂 抓力测定仪(上海欣软);转棒式疲劳仪(安徽正华);血糖仪(江苏鱼跃);酶标仪(BioTeK);脱水机、包埋机和病理切片机(武汉俊杰);光学显微镜及成像系统(Nikon);匀浆仪(Bio-Spec);脱色摇床和电泳仪(北京六一)。链脲佐菌素(Sigma);胰岛素酶联免疫试剂盒(Millipore);兔抗小鼠胰岛素受体(insulin receptor,InsR)、葡萄糖转运体4(glucose transporter 4,GLUT4)、胰岛素受体底物1(insulin receptor substrate 1,IRS1)和蛋白激酶 B(protein kinase B,Akt)抗体(武汉云克隆);兔抗小鼠磷脂酰肌醇 3 激酶(phosphatidylinositol 3 kinase,PI3K)抗体(武汉博奥森);兔抗小鼠p-IRS1、p-PI3K、p-Akt、糖原合成酶激酶 3β(glycogen synthetase kinase 3β,GSK3β)和p-GSK3β抗体(上海生工)。
2 方法
2.1 动物模型的建立与评价 将12 只WT 小鼠、12只MSTN+/-小鼠、12 只纯合型MSTN-/-小鼠各随机分为 2 组,每组 6 只,分别为:WT 组、MSTN+/-组、MSTN-/-组、WT+DM 组、MSTN+/-+DM 组和MSTN-/-+DM 组,前3 组给予普通饮食6 周,后3 组给予高脂饮食及链脲佐菌素腹腔注射6 周诱导T2DM 模型。WT+DM 组、MSTN+/-+DM 组和MSTN-/-+DM 组小鼠给予高脂饮食喂养6 周后,腹腔注射2%链脲佐菌素(35 mg/kg),72 h 后禁食6 h,检测空腹血糖(fasting plasma glucose,FPG)≥16.7 mmol/L 即可认为造模成功。18 只小鼠均造模成功。另外3 组小鼠腹腔注射等剂量柠檬酸缓冲液作为对照。普通饮食:总热量为3.85 kcal/g,糖类、脂肪、蛋白质分别占70%、10%、20%;高脂饮食:总热量为5.24 kcal/g,糖类、脂肪、蛋白质分别占20%、60%、20%。
2.2 体重、体长和腹围的测定 造模前及造模成功后,用电子秤测定小鼠体重,卷尺测定小鼠体长和腹围。
2.3 抓力和转棒力竭时间的测定 造模后测定小鼠抓力:将小鼠放置在抓力测定仪的抓具上,踩下脚踏开关,均匀用力向后拉小鼠,直至四肢均脱离抓具,软件自动记录抓力峰值。造模后测定小鼠转棒力竭时间:将小鼠放置在直径为3 cm 的转棒式疲劳仪的旋转杆上,转速设定为20 r/min,每次同时测定5只小鼠,每个隔室中1 只。小鼠按与转棒旋转方向相反的方式奔跑,当进入疲劳状态时即从转棒上跌落。记录小鼠从转棒开始旋转至掉落的时间,最大测定时间为10 min,每次休息20 min。同1 只小鼠连续测试抓力和力竭时间各3次,计算平均值。
2.4 胰岛素抵抗程度的评估 造模后小鼠禁食6 h,取尾静脉血,用血糖仪测定FPG,用ELISA 试剂盒测定空腹血清胰岛素(fasting serum insulin,FIns)并计算胰岛素敏感指数(insulin sensitivity index,ISI)=ln[1(/FPG×FIns)],稳态模型胰岛素抵抗指数(homeostasis model assessment-insulin resistance index,HOMA-IR)=(FPG×FIns)/22.5,严格按试剂盒说明书进行操作。葡萄糖耐量实验(glucose tolerance test,GTT)和胰岛素耐量实验(insulin tolerance test,ITT):小鼠分别以2 g/kg葡萄糖灌胃或5 mL/kg胰岛素腹腔注射后,于 15、30、60 和 120 min 测取尾静脉血测血糖,记录血糖变化曲线并计算曲线下面积[AUC=(15×G0+30×G15+45×G30+90×G60+60×G120)/2],其中 G0、G15、G30、G60 和 G120 表示空腹及各时点血糖。
2.5 动物处死与取材 以上实验完成后处死小鼠,迅速解剖出右下肢腓肠肌及腹股沟、附睾、肠系膜白色脂肪组织,吸取表面血液及体液,用电子秤称湿重,计算腓肠肌比重=右下肢腓肠肌质量/体重,白色脂肪比重=白色脂肪总质量/体重。称重后将腓肠肌一半保存于液氮中,另一半保存于甲醛固定液中。
2.6 腓肠肌HE 染色 将甲醛固定好的腓肠肌用乙醇和二甲苯脱水后制成蜡块并切片。依次进行脱蜡、苏木素染色、脱水、伊红染色、脱水、透明、封片。光学显微镜下采集图像,ImageJ 软件分析腓肠肌形态及细胞横截面积。
2.7 骨骼肌胰岛素信号通路相关蛋白水平的测定 取腓肠肌组织50 mg置于匀浆器,加入蛋白裂解液,反复多次匀浆以确保完全裂解。将匀浆液转移至离心管中,12 000 r/min离心10 min后留取上清液。BCA 法测蛋白浓度。进行SDS-PAGE,加入样品,电压60 V,电泳至溴酚蓝到达底部时停止电泳。加入含有甲醇的转移缓冲液,电压60 V 转膜2 h,湿转法将蛋白转移至 PVDF 膜。TBST 洗膜 10 min × 3 次。5%脱脂奶粉溶液封闭PVDF 膜1 h。加入TBST 稀释Ⅰ抗,4 ℃孵育过夜,TBST 洗膜 10 min × 3 次。加入TBST 稀释Ⅱ抗,室温下孵育1 h,TBST 洗膜10 min ×3 次。ECL A、B 液等量混匀后加至 PVDF 膜,暗匣曝光,依次显影、定影。晾干,扫描胶片。以β-actin 为内参照,采用ImageJ软件分析目标条带的吸光度值。
3 统计学处理
采用SPSS 22.0软件进行统计分析,数据均经正态性检验,正态分布的计量资料以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,以P<0.05 为差异有统计学意义。
结 果
1 造模后小鼠体质量、体长、腹围和体成分的比较
造模前各组小鼠体重、体长和腹围的差异无统计学显著性(P>0.05),见表1。造模后:WT+DM 组小鼠体重、腹围和腓肠肌比重小于WT 组,白色脂肪比重大于WT 组(P<0.05);MSTN-/-组小鼠体重大于WT 组(P<0.05),体长、腹围、腓肠肌比重大于WT组、MSTN+/-组(P<0.05),白色脂肪比重与 WT 组、MSTN+/-组比较差异无统计学显著性(P>0.05);MSTN-/-+DM 组体重、体长、腹围和腓肠肌比重大于WT+DM 组 ,白色 脂肪比 重 小于 WT+DM 组(P<0.05),见表1、2。

表1 造模前后小鼠体重、体长和腹围的比较Table 1. BM,BL and AC of mice before and after modeling(Mean±SD. n=6)
2 造模后小鼠抓力和转棒力竭时间的比较
DM 模型后,小鼠的抓力和转棒力竭时间均小于相应的正常饮食小鼠(P<0.05);WT+DM组的抓力和转棒力竭时间小于WT 组(P<0.05);MSTN-/-组抓力大于WT 组(P<0.05),MSTN-/-+DM 组抓力大于WT+DM组(P<0.05)。见表3。
3 造模后小鼠胰岛素抵抗程度的比较
WT+DM 组 FPG、HOMA-IR、GTT-AUC 和 ITTAUC 高于 WT 组,FIns 和 ISI 低于 WT 组(P<0.05);MSTN-/-组 GTT-AUC 低 于 WT 组 、MSTN+/-组(P<0.05),ITT-AUC 高于 WT 组和MSTN+/-组(P<0.05),FPG、FIns、ISI 和 HOMA-IR 与 WT 组和MSTN+/-组比较差异无统计学显著性(P>0.05);MSTN-/-+DM 组ISI 高于 WT+DM 组(P<0.05),HOMA-IR、GTT-AUC和ITT-AUC低于WT+DM组(P<0.05),见图1、表3。

表3 造模后小鼠抓力、转棒力竭时间和胰岛素抵抗程度的比较Table 3. Gripping force,rotating time and insulin resistance of mice after modeling(Mean±SD. n=6)
4 造模后小鼠腓肠肌细胞形态的变化及横截面积的比较
WT 组肌细胞排列规则,细胞完整,无萎缩、水肿、坏死,WT+DM 组肌细胞排列松散,肌纤维萎缩,边缘角化,细胞横截面积明显小于WT 组(P<0.05)。WT 组、MSTN+/-组和MSTN-/-组小鼠腓肠肌细胞体积逐渐增大,MSTN-/-组肌细胞排列紧密,边缘圆润,细胞间隙明显缩小,细胞横截面积明显大于WT 组(P<0.05)。MSTN-/-+DM 组腓肠肌细胞横截面积明显大于 WT+DM 组(P<0.05),形 态 接 近 WT 组 ,见图2、3。

表2 造模后小鼠体成分的比较Table 2. Body mass composition of the mice after modeling(Mean±SD. n=6)

Figure 1. GTT(A)and ITT(B)of the mice after modeling. Mean±SD. n=6.*P<0.05 vs WT group;#P<0.05 vs MSTN+/- group;&P<0.05 vs MSTN-/-group;+P<0.05 vs WT+DM group;△P<0.05 vs MSTN+/-+DM group.图1 造模后小鼠GTT及ITT

Figure 2. HE staining of gastrocnemius tissue in the mice(scale bar=100 μm).图2 造模后小鼠腓肠肌HE染色
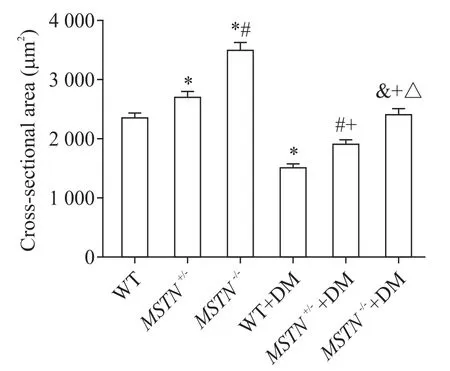
Figure 3. Cross-sectional area of gastrocnemius fibers in the mice after modeling. Mean±SD. n=6.*P<0.05 vs WT group;#P<0.05 vs MSTN+/- group;&P<0.05 vs MSTN-/- group;+P<0.05 vs WT+DM group;△P<0.05 vs MSTN+/-+DM group.图3 造模后小鼠腓肠肌细胞横截面积的比较
5 造模后小鼠骨骼肌胰岛素信号通路相关蛋白水平的比较
WT+DM 组 InsR 和 GLUT4 蛋 白 水 平 及 IRS1、PI3K、Akt 和 GSK3β 磷酸化比例低于 WT 组(P<0.05);MSTN-/-组 GLUT4 蛋白水平及 PI3K、Akt 和GSK3β 磷酸化比例高于 WT 组(P<0.05);MSTN-/-+DM 组的 InsR 和 GLUT4 蛋白水平及 IRS1、PI3K、Akt和GSK3β 的磷酸化比例高于WT+DM 组(P<0.05),见图4。
讨 论
研究发现,MSTN基因敲除小鼠肌肉质量增加,脂肪质量减少,可抵抗高脂饮食诱导的肥胖[4-6]。本研究结果显示,造模前MSTN-/-组小鼠体重、体长、腹围略大于WT 组,但差异无统计学显著性,可能与小鼠周龄较小,MSTN基因敲除后变化不明显有关;造模后MSTN-/-组小鼠较WT 组体重、体长和腹围明显增大,腓肠肌比重及肌细胞横截面积明显增加,表明MSTN可负向调节骨骼肌质量和体积,抑制肌肉肥大。白色脂肪堆积是T2DM 的显著特征之一,与代谢综合征、胰岛素抵抗关系密切[7]。本研究结果显示,WT+DM 组小鼠腓肠肌比重明显减小,白色脂肪比重明显增多,而MSTN-/-+DM 组较WT+DM 组有明显改善,表明抑制MSTN表达可在一定程度上拮抗T2DM 引起的肌量减少,白色脂肪堆积,改善体成分分布。
研究显示,MSTN基因敲除可增强小鼠的骨骼肌力量,缩短跑台运动及游泳疲劳时间[8-9]。本研究采用抓力和转棒力竭时间评价小鼠肌力及抗疲劳能力,结果显示,MSTN-/-组小鼠抓力较野生型显著增强,表明MSTN负向调控肌量的同时,也对肌力产生负性影响。MSTN-/-+DM 组小鼠抓力较WT+DM 组显著提高,甚至接近WT 组水平,提示抑制MSTN表达可拮抗T2DM 引起的肌力减弱。而MSTN基因敲除小鼠转棒力竭时间却无明显变化,因此尚不能确定MSTN对抗疲劳能力的影响。
目前普遍认为胰岛素抵抗是糖尿病、肥胖、脂代谢异常等疾病的共同发病基础。胰岛素-胰岛素受体-胰岛素受体底物-磷脂酰肌醇3 激酶-蛋白激酶B-葡萄糖转运体4/糖原合成酶激酶3β 信号通路是胰岛素介导葡萄糖摄取和转运的重要途径,通路中任一分子异常均可能影响骨骼肌对葡萄糖的转运和利用,引起糖耐量受损和胰岛素抵抗[10-12]。既往研究[2-3,13]发现,MSTN 可能影响机体对葡萄糖的摄取利用,参与胰岛素抵抗的发生;抑制MSTN 表达可促进高脂饮食喂养肥胖小鼠葡萄糖代谢。本研究结果显示,纯合型小鼠较杂合型及野生型小鼠糖耐量明显改善,胰岛素敏感性增强,骨骼肌胰岛素信号通路各蛋白表达水平及磷酸化比例增加,表明MSTN基因表达缺失可上调胰岛素信号通路,促进葡萄糖转运及糖原合成,增强血糖调控能力,改善胰岛素抵抗,拮抗T2DM对糖代谢的负性影响。本研究腓肠肌HE染色结果显示,MSTN-/-组、MSTN-/-+DM 组小鼠腓肠肌纤维明显增粗,推测骨骼肌形态特性改变致其细胞膜InsR 和GLUT4 等受体增多,胰岛素信号通路传导增强,葡萄糖转运和糖原合成加快,导致胰岛素敏感性增强,胰岛素抵抗减轻。
肌少症是与增龄有关的以进行性肌量减少和(或)肌强度下降或肌肉功能减退为特征的疾病。中年男性和女性血清MSTN水平均高于年轻组,肌肉质量与血清MSTN水平呈负相关[14-15],握力水平较高的老年男性血清MSTN水平较低[16],而握力是反映肌肉力量的重要指标,提示MSTN与肌少症有关。T2DM 患者往往早期就可出现肌肉质量减少和肌肉功能减退,可能与代谢异常、炎症通路激活、激素变化等多种机制有关。横断面调查显示,北京地区60岁以上T2DM 患者肌少症患病率为8.5%[17]。T2DM合并肌少症人群中同时存在胰岛素抵抗与肌量减少、肌力减弱,而骨骼肌是摄取利用葡萄糖的主要靶器官,因此肌少症可对全身葡萄糖代谢产生巨大影响。本研究结果显示,T2DM 小鼠较野生型小鼠肌肉质量明显减少,肌力明显减弱,胰岛素敏感性降低,胰岛素抵抗增加,而抑制MSTN表达可在一定程度上减轻T2DM 对肌量、肌力、糖调节能力的负性影响。目前对于T2DM 合并肌少症这一疾病还缺乏有效的治疗手段,而本研究通过动物实验证实,抑制MSTN的表达不仅可有效提高肌量和肌力,还可通过上调胰岛素信号通路在一定程度上改善机体的胰岛素抵抗,为T2DM合并肌少症的治疗提供新思路。
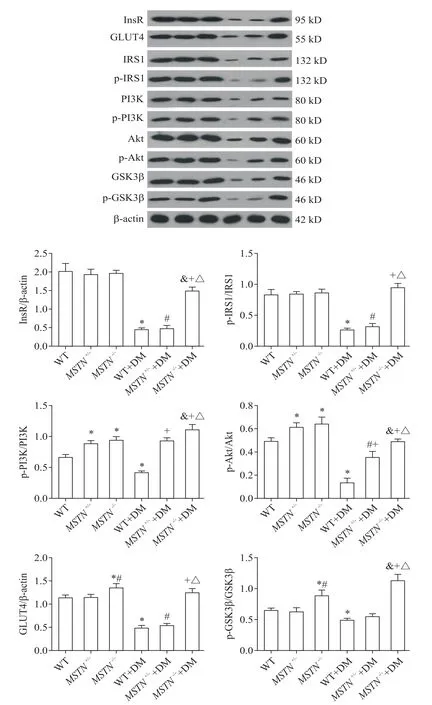
Figure 4. Protein expression on insulin signaling pathway in skeletal muscle of the mice after modeling. Mean±SD. n=6.*P<0.05 vs WT group;#P<0.05 vs MSTN+/- group;&P<0.05 vs MSTN-/- group;+P<0.05 vs WT+DM group;△P<0.05 vs MSTN+/-+DM group.图4 造模后小鼠骨骼肌胰岛素信号通路相关蛋白水平的比较
本研究结果提示,抑制MSTN 表达可引起肌量、肌力增加以及肌细胞肥大,上调胰岛素信号通路,减轻胰岛素抵抗;可在一定程度上拮抗T2DM 对肌量、肌力及胰岛素信号通路的负性影响,改善糖耐量及胰岛素抵抗。但本研究为动物实验,样本量较小,结论有一定局限性,MSTN基因参与T2DM 胰岛素抵抗的机制需进一步深入研究。
