病毒致癌过程中的线粒体糖酵解代谢重编程机制研究进展
2021-12-04陈圆圆林忠宁林育纯
兰 尤,陈圆圆,2,林忠宁,林育纯,
(1.厦门大学公共卫生学院分子疫苗学和分子诊断学国家重点实验室,福建 厦门 361102;2.中国疾病预防控制中心环境与健康相关产品安全所,北京 100021)
癌症的发生是一个多因素、多基因参与的多阶段过程。国际癌症研究机构估计2020年全球有1 930万癌症新发病例和1 000万死亡病例,严重威胁全球人群健康。病毒感染是诱发特定肿瘤致癌过程的重要外源因素,如乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)与肝细胞 癌(hepatocellular carcinoma,HCC);EB病 毒(Epstein-Barr virus,EBV)与鼻咽癌(nasopharyngeal carcinoma,NPC);人乳头瘤病毒(human papilloma virus,HPV)与宫颈癌等的发生发展密切相关。部分具有致癌作用的病毒感染宿主细胞,介导病毒自身基因组转录和编码特定病毒蛋白表达,作为诱导致癌作用的蛋白(简称病毒致癌蛋白),促进宿主细胞恶性转化。代谢重编程在诱导细胞恶性转化过程中起关键调节作用,以应对细胞存活和增殖的能量需求,是肿瘤细胞特征标志之一。线粒体是许多病毒靶向的关键细胞器,可经由线粒体质量控制(mitochondrial quality control,MQC),即线粒体形态、数量和功能的多维调控机制,参与细胞内多种信号通路和能量代谢稳态的调节。病毒致癌蛋白可通过影响MQC相关分子机器或线粒体DNA等,调控线粒体功能和改变宿主代谢模式。本文综述了HBV、HCV、EBV、HPV等病毒的致癌蛋白,诱导糖酵解代谢重编程的线粒体相关调控机制,以及靶向病毒感染和代谢重编程的干预作用,为病毒致癌蛋白诱导宿主细胞恶性转化和致癌作用的预防控制提供理论依据。
1 线粒体相关的糖酵解代谢重编程
在诱导恶性转化的细胞中,线粒体转变正常生理状态时的氧化磷酸化(oxidative phosphorylation,OXPHOS)能量代谢模式,发生代谢重编程,表现为在氧气充足的情况下,肿瘤细胞仍糖酵解旺盛,消耗大量的葡萄糖,即有氧糖酵解。
细胞糖酵解代谢重编程的发生,与MQC稳态介导线粒体功能调节有关,其中线粒体生物发生、线粒体动力学和线粒体自噬等是主要的调控机制。首先,线粒体生物发生是指线粒体前体生长和分化形成新线粒体的过程,主要受过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptorγcoactivator-1α,PGC-1α)调控。例如在受体相互作用蛋白1缺失的肺癌A549和H460细胞中,PGC-1α表达降低,可加速糖酵解代谢,引起细胞DNA损伤和细胞增殖抑制。其次,线粒体动力学是指线粒体分裂和融合的动态过程。例如饥饿状态下的肝癌HLE细胞中,线粒体动力相关蛋白1(dynamin-related protein 1,Drp1)丝氨酸637位点磷酸化(p-Drp1)激活,可经由代谢模式向OXPHOS转变,以维持肿瘤细胞生长。此外,线粒体自噬是将受损的线粒体特异性靶向自噬溶酶体,以维持线粒体功能和细胞稳态的降解过程。例如小鼠胚胎发育期间,视网膜神经节细胞经由缺氧诱导Bcl-2/腺病毒E1B相互作用样蛋白3(bcl-2 interacting protein 3 like,BNIP3L)依赖性线粒体自噬,使线粒体数量减少和促进细胞糖酵解代谢。因此,MQC在细胞糖酵解代谢重编程调控中起重要作用。
经由糖酵解代谢重编程,可为肿瘤细胞提供ATP和生物大分子合成所需的原料,而且,代谢终产物乳酸释放到胞外,形成局部酸性微环境,有助于肿瘤细胞的免疫逃逸和耐药。许多病毒及其致癌蛋白,可通过调控MQC和线粒体功能,经由糖酵解代谢重编程,参与诱导宿主细胞代谢模式的转变,介导致癌过程和细胞转归结局。同时,靶向MQC和糖酵解代谢重编程调控通路,也可提供潜在的干预靶点(图1)。
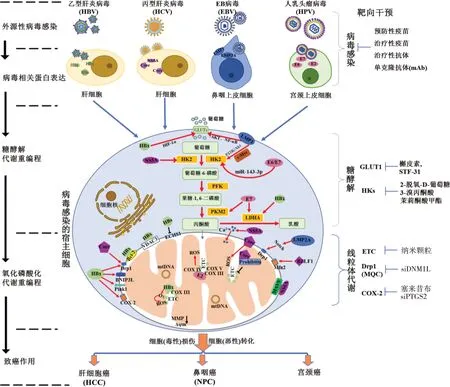
图1 常见病毒致癌蛋白对宿主细胞致癌过程中线粒体代谢的影响及靶向干预
2 常见病毒致癌蛋白经线粒体相关调控机制诱导的细胞糖酵解代谢重编程
2.1 HBV相关致癌蛋白
HBV是HCC发生发展的重要环境暴露因素。首先,HBV的X蛋白(HBV X protein,HBx)持续表达,可使肝细胞代谢稳态和增殖失调,是HBV致肝癌作用的关键蛋白。HBx可与人肝癌HepG2细胞线粒体外膜上电压依赖性阴离子通道3(voltage dependent anion channel 3,VDAC3)和Bcl-2结合定位于线粒体,导致线粒体膜电位(mitochondrial membrane potential,MMP)降低和线粒体DNA氧化损伤,降低细胞OXPHOS和胞内ATP含量,诱导细胞发生代谢重编程;HBx还可通过上调缺氧诱导因子-1α(hypoxia-inducible factor 1 alpha,HIF-1α)的转录活性,诱导糖酵解相关酶类如葡萄糖转运蛋白(glucose transporters,GLUTs)和乳酸脱氢酶A(lactate dehydrogenase A,LDHA)表达,介导肿瘤细胞代谢重编程。其次,HBV的S蛋白(HBV S protein,HBs)也参与诱导宿主细胞糖酵解代谢重编程过程;HBs经由与HepG2细胞中烯脂酰辅酶A水解酶(enoyl-CoA hydratase,ECHS1)相互作用,影响其线粒体定位和线粒体功能调节;敲低ECHS1后,可经由活化AMP依赖性蛋白激酶(AMP-activated protein kinase,AMPK)和损伤细胞代谢,诱导肝癌细胞自噬。因此,提示HBx和/或HBs可作为HBV相关致癌蛋白,经由MQC通路参与线粒体代谢重编程相关致肝癌作用的调控。
2.2 HCV相关致癌蛋白
HCV在世界人口的感染率约为3%,其长度为9.6 kb的基因组编码多种蛋白,包括结构蛋白Core、E1和E2,以及非结构蛋白NS3、NS4A和NS5A等。其中,HCV的Core蛋白能特异性抑制线粒体COX I活性,使线粒体适应缺氧代谢;Core蛋白和NS5A可促进细胞中内质网Ca释放和通过增加线粒体Ca摄取,调节线粒体通透性转换和降低MMP;HepG2细胞中异位表达的Core蛋白,经由与抗增殖蛋白Prohibitin相互作用,损伤线粒体电子传递链(electron transport chain,ETC)、干扰COX I和II的组装和活性;NS3/4A能裂解线粒体抗病毒信号蛋白(mitochondrial antiviral signaling,MAVS),进而影响线粒体功能;在肝癌Huh7.5和Huh9.13细胞中,NS5A蛋白能直接与己糖激酶2(hexokinase 2,HK2)相互作用,增加其酶活性和促进糖酵解过程。因此,提示HCV的Core蛋白和NS5A等相关蛋白对宿主细胞代谢途径的调节,促进细胞增殖和锚着非依赖生长能力,在HCV感染诱导肝细胞恶性转化过程发挥重要作用。
2.3 EBV相关致癌蛋白
EBV感染与多种上皮性肿瘤的发生发展,特别是与我国华南地区人群NPC高发和主要死因直接相关。潜伏膜蛋白1(latent membrane protein 1,LMP1)是EBV编码的癌基因,其可通过活化核因子κB(nuclear factor kappa-B,NF-κB)、磷酸肌醇3-激酶(PI3K)/蛋白激酶B(AKT)和c-MYC等细胞内信号转导通路,上调GLUT1和HK2的表达,促进细胞糖酵解代谢过程和调控肿瘤细胞存活、增殖、分化、转化及凋亡。LMP1可以诱导糖酵解关键限速酶HK2的表达,增强化疗耐药性,提示抑制HK2表达能诱导NPC细胞凋亡。LMP1通过阻滞RNA聚合酶Ⅱ的表达,进而抑制同源盒基因C8的表达,调节糖酵解(HK2、GLUT1)和TCA相关基因(酮戊二酸脱氢酶)的表达,抑制NPC细胞生长。LMP1也能依赖于哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)和NF-κB信号的激活,上调NPC细胞中的Glut1转录、增强有氧糖酵解;且在EBV阴性鼻咽癌NPC-TW01细胞中,外源性高表达LMP1使MMP降低、损伤OXPHOS功能、上调丙酮酸脱氢酶激酶1和丙酮酸激酶2等酶活性,促进有氧糖酵解过程。此外,LMP2A是另一个EBV编码的癌基因,可经由激活mTORC1信号,进而促进EBV感染的NPC细胞中的葡萄糖代谢增强;在EBV阴性胃癌和乳腺癌细胞系中,LMP2A异位表达能刺激Notch信号通路,上调Drp1引起线粒体分裂增加,伴随着迁移和上皮-间质转化增加。
2.4 HPV相关致癌蛋白
宫颈癌发生主要由HPV的感染引起。HPV E2蛋白高表达的人宫颈鳞癌C33a细胞中,经由补体1q结合蛋白C表达增加,诱导线粒体活性氧(reactive oxygen species,ROS)增加和线粒体功能障碍,调节细胞代谢和诱导细胞凋亡。HPV E6/E7蛋白过表达的宫颈癌HeLa细胞中,通过上调MYC和抑制miR-143-3p的表达,上调HK2表达。小鼠胚胎成纤维NIH 3T3细胞系中,HPV-16 E7蛋白经由与M2型丙酮酸激酶(pyruvate kinase isozyme type M2,PKM2)结合形成四聚体,增加糖酵解通量,促进葡萄糖转化为乳酸盐,以满足对核苷酸前体的需求和降低氧需求。人表皮HaCaT细胞中,高风险性HPV-18 E2蛋白过表达,通过与呼吸链相关蛋白(COX III、IV和V)相互作用,诱导线粒体ROS产生、稳定HIF-1α的表达和促进糖酵解代谢过程,使线粒体向核周聚集和嵴结构的丧失。此外,研究表明,HPV相关致癌蛋白E2、E7等通过诱导细胞代谢重编程,与宿主细胞恶性转化有关。E6和E7蛋白可通过蛋白酶体降解途径和蛋白相互作用、抑制和降解p53和p-RB的表达等促进致癌进程。
3 病毒致癌蛋白相关致癌过程的靶向干预
上述不同的病毒致癌蛋白诱导宿主细胞的致癌过程,涉及病毒感染、糖酵解和线粒体代谢等环节;因此,可以靶向这些环节采取选择性干预,阻断致癌作用。
3.1 靶向病毒感染的干预
病毒感染诱发的各类疾病是一个严重的公共卫生问题,目前最有效的预防方式为疫苗接种,包括已有相关疫苗,如乙肝疫苗、宫颈癌疫苗等预防性疫苗用于人群,可靶向预防病毒感染和阻断相关病毒蛋白的潜在致癌作用。而且,对HPV分型和病毒蛋白种类多等特征,已有应用结构疫苗学方法成功设计的第三代宫颈癌疫苗,以7种HPV嵌合疫苗分子预防20种型别的HPV感染,保护率达99%,具有对HPV相关宫颈癌预防覆盖范围广、安全性高等优势,解决疫苗预防HPV感染诱发致癌的跨型保护问题。
治疗性疫苗和治疗性抗体在靶向控制病毒感染及其诱发致癌过程中的作用日益被关注。已发现能持久抑制HBsAg的乙肝治疗性抗体E6F6,被国际评述为“是一个独特的慢乙肝治疗单抗”;并利用E6F6识别的表位和新型载体,发展了一种新型的B细胞表位嵌合型类病毒颗粒乙肝治疗性疫苗;进一步地,筛查到靶向抗HBx抗体(anti-HBx)和构建重组质粒(pTT5-9D11)在细胞内表达可溶性抗体,发现靶向干预肝癌Huh7细胞中HBx的表达,可经由糖酵解代谢重编程调控BNIP3L表达和线粒体转位,及其与微管相关蛋白1轻链3β (microtubule associated protein 1 light chain 3 beta,LC3B)相互作用介导的线粒体自噬,降低肝细胞癌干性表型及其诱导性转归。为靶向病毒蛋白特异性单克隆抗体(monoclonal antibody,mAb)在病毒感染诱导致癌过程的预防控制提供新的干预策略。
3.2 靶向糖酵解通路的干预
细胞对葡萄糖的摄入需要借助细胞膜上的GLUTs;在肝癌HepG2和Huh7细胞中,槲皮素通过竞争性抑制GLUT1对葡萄糖的转运,抑制细胞葡萄糖代谢并诱导细胞凋亡。HKs是催化葡萄糖转化为葡萄糖-6-磷酸的关键限速酶,研究发现,2-脱氧-D-葡萄糖(2-Deoxy-D-glucose,2-DG)、3-溴丙酮酸(3-bromopyruvic acid,3-BP)和茉莉酮酸甲酯都能抑制HKs的活性。其中,2-DG是抑制糖酵解的葡萄糖类似物,可竞争性抑制HKs,降低糖酵解速率,经由抑制受体相互作用蛋白(receptor interacting protein,RIP)和细胞半胱天冬酶8(FLICE)样抑制蛋白[cellular caspase 8(FLICE)-like inhibitory protein,c-FLIP]表达,导致肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)诱导的肝癌HepG2和Hep3B细胞凋亡。我们的研究发现GLUT1抑制剂STF-31和2-DG靶向干预,经由调节肝癌Huh7和MHCC-97H细胞中HBx表达诱导的糖酵解代谢重编程,参与介导线粒体自噬依赖性肝细胞癌干性。提示糖酵解通路可作为致癌作用干预和癌症治疗的代谢靶标,在靶向抗肿瘤作用研究中具有潜在的意义。
3.3 靶向线粒体代谢的干预
目前干预线粒体代谢过程主要集中在电子传递链复合物、线粒体关键代谢酶和MQC相关蛋白上。采用新型生物材料,如超顺磁氧化铁纳米颗粒(superparamagnetic iron oxide nanoparticles,SPIO-NPs),发现可特异性靶向线粒体信号通路和ETC,揭示其诱导肝癌细胞凋亡敏感性的分子机制。研究发现,HBx表达联合黄曲霉毒素B1(aflatoxin B1,AFB1)暴露可增加肝细胞线粒体环氧合酶2(cyclooxygenase 2,COX-2)定位分布,促进RIP3-MLKL坏死小体在线粒体的共分布,经由Drp1介导线粒体分裂和动态紊乱,引发代谢功能失调和细胞中脂滴(lipid droplets,LDs)蓄积导致肝脏脂肪变性;靶向Drp1的基因干预(siDNM1L)等可调控HBx表达肝癌细胞坏死性凋亡介导的细胞转归。因此,线粒体代谢相关的细胞器通讯及其介导的调节性细胞死亡(regulatory cell death,RCD)信号调控机制在病毒蛋白致癌和靶向抗肿瘤中的作用备受关注。
4 小结与展望
病毒致癌过程中恶性转化细胞和肿瘤细胞中的代谢模式和调控已逐渐被阐明;目前研究表明,宿主细胞中不同病毒蛋白的表达,可经由MQC介导线粒体关键代谢通路信号转导和功能的调控机制,引发细胞发生代谢重编程,参与宿主细胞恶性转化和致癌作用的进程。
新近研究也揭开了该领域待深入探明的新方向。首先,靶向胞内蛋白的mAb表达,阻断病毒蛋白的功能,以及依托高度特异性人源化mAb的结合物,标记细胞和调节信号传导途径以抑制细胞增殖或诱导细胞死亡,使mAb成为干预病毒感染相关致癌作用和延缓病毒相关肿瘤(如HCC、NPC等)进展的一种新手段。其次,癌干细胞(cancer stem cells,CSCs)被认为是肿瘤细胞的一个亚群,具有自我更新和多向分化潜能,其与病毒致癌蛋白的关联性备受关注。基于CSCs具有代谢重编程的高度可塑性及其随微环境的可变性,我们开展了病毒致癌蛋白相关的肝癌干细胞(LSCS)和鼻咽癌干细胞中MQC和代谢重编程新通路调控和靶向干预的研究,为阐明不同代谢模式在CSCs干性表型维持的潜在机制、和探究靶向CSCs的清除提供新的方向。第三,蛋白磷酸酶2A(protein phosphatase 2A,PP2A)不同亚基靶向MQC相关蛋白的翻译后修饰(post-translational modification,PTM)和功能调控,我们发现HBx等可经由PP2A调控肝细胞中相关蛋白(如p53,Drp1,COX-2等)去磷酸化、介导线粒体-内质网关联性细胞器间通讯和RCD细胞转归,为外源物(包括病毒蛋白等)致癌作用中MQC-代谢重编程-RCD级联信号轴靶分子的PTM调控机制和靶向干预提供新依据。总之,新的研究不断为靶向病毒感染及其致癌蛋白表达、细胞代谢调节和恶性转化微环境等不同层面的药理学或基因干预,提供多路径的有效靶点和新的多模式预防控制策略。
