药源性帕金森综合征临床分析
2021-12-02连立飞
闵 喆 薛 峥 连立飞
华中科技大学同济医学院附属同济医院,湖北 武汉 430030
药源性帕金森综合征(drug-induced Parkinsonism,DIP)是使用可能导致纹状体内多巴胺递质含量减少或多巴胺受体阻滞的药物后出现的运动障碍、震颤、自主神经功能紊乱等一系列帕金森临床表现的综合征[1-3]。作为一种医源性疾病,尽管很多合理用药也可能出现DIP,但不适当的超适应征用药、超剂量或超疗程用药更可能导致一些本可避免的发病。研究显示近年来原发性帕金森病(Parkinson’s disease,PD)的发病率逐渐下降,而DIP 的发病率反而增加[4],可能与人口老龄化、社会环境以及不断开发和应用的新药有关。目前在部分发达国家,DIP可能已成为第二常见的帕金森综合征病因[5-7]。中国的DIP发病率目前尚缺乏大规模调查统计数据,还可能存在对其认识不足和重视不够导致被低估的情况[8-10]。由于临床上DIP的症状和体征与PD 有一定的相似性,且一些DIP 患者可合并便秘、情绪障碍等非运动症状,给鉴别诊断带来一定困难,还有些DIP 患者症状较轻,容易造成漏诊或误诊[9]。虽然大多数患者的症状是可逆的,但仍有少部分患者症状可能长时间持续不缓解[11-12],既影响患者的生活质量,又造成了不必要的经济负担,因此应该引起更多重视。本文回顾性分析DIP患者的临床表现、影像学特点、治疗和预后,旨在提高DIP 的诊断及时率和准确率,同时利于改进相关可能致病药物的用药策略。
1 资料与方法
1.1 一般资料回顾性收集华中科技大学同济医学院附属同济医院2018-06—2021-01在PD 专病门诊就诊和住院部住院的DIP 患者,所有患者均符合DIP 临床诊断标准[13]。最终纳入21 例,年龄(59.5±16.1)岁,女16 例,男5例。应用药物包括钙离子通道阻滞剂(氟桂利嗪7 例)、抗焦虑抑郁药物和抗精神病类药物(氟哌噻吨3例,氟哌啶醇2例,奥氮平1例,利培酮1 例)、降压药(含利血平的复方制剂3例)、胃肠动力药(甲氧氯普胺1 例)及部分其他药物(曲美他嗪1 例,丙戊酸钠1 例,胺碘酮1例)。抗抑郁或精神病类药物的均未超过规定的最大服用剂量,但氟桂利嗪相关的DIP患者较多存在服药过量或疗程过长的情况。患者从开始用药至产生帕金森综合征症状时间14 d~2 a。
1.2 病史与检查详细询问病史,尤其用药史,包括用药时间、剂量、用药后出现症状的时间,以及有无家族史和其他可解释病情的全身性疾病。行全面系统的神经科查体和影像学检查(头部MRI 或CT),部分患者完成了经颅超声检查(transcranial sonography,TCS)和多巴胺转运体正电子发射断层成像(dopamine transporter-PET,DAT-PET)。运用简易智能精神状态检查量表(mini-mental state examination,MMSE)评估患者认知功能,汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)和汉密顿抑郁量表(Hamilton depression scale,HAMD)评估患者焦虑和抑郁情况。对于患者的发病年龄、起病形式、帕金森综合征的临床表现、合并其他锥体外系表现和神经科的查体情况等进行综合分析。
1.3 治疗方法所有患者均逐步停用潜在引起DIP的药物,精神障碍患者及明显焦虑抑郁者调整换用其他低风险抗精神病及抗焦虑抑郁药物。部分症状较重的患者给予左旋多巴制剂、金刚烷胺或抗胆碱能药物对症治疗,部分合并静坐不能的患者,加用苯二氮类药物。
2 结果
2.1 临床表现及检查结果纳入21例患者均有不同程度的行动迟缓、肌强直和(或)震颤等帕金森综合征表现,但多数患者双侧肢体同时起病,仅2例以单侧肢体起病,与原发性PD较难鉴别,但其经颅超声检查未见PD 患者常见的黑质异常回声灶。其中1 例“左侧肢体僵硬、行动迟缓”起病的患者,因病程较长且对左旋多巴表现出一定的反应性,与原发性PD 较难鉴别,进一步完善DAT-PET 成像(图1~2),结果提示双侧尾状核及壳核多巴胺转运体(DAT)功能正常,从而排除PD 诊断。另有3例患者发病早期动作性震颤症状突出而行动迟缓不明显,需与特发性震颤相鉴别,但停用相关药物后症状明显缓解。
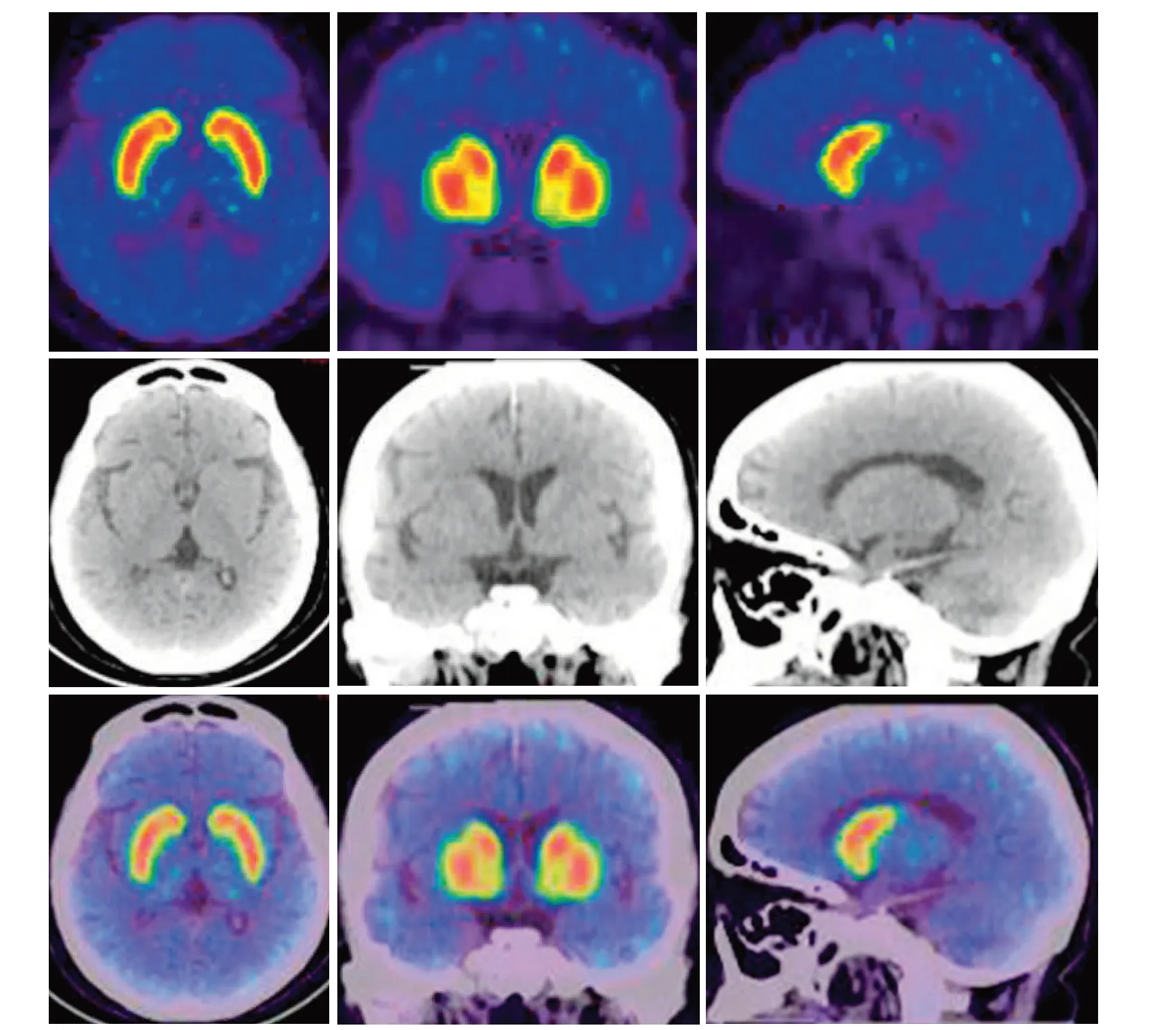
图1 1例服用盐酸氟桂利嗪后出现单侧肢体起病的帕金森综合征患者的DAT-PET图像,其双侧尾状核及壳核多巴胺转运体功能正常Figure 1 A DAT-PET image of a patient with Parkinson’s syndrome who developed unilateral limb-onset after taking flunarizine hydrochloride,the bilateral caudate nucleus and putamen dopamine transporter function were normal
21 例患者均完成头部影像学检查,其中18 例完成头部MRI 检查,3 例完成头部CT 检查。所有患者均排除颅内占位性病变及相关继发性PD可能。16例(76.2%)影像学提示存在不同程度的缺血/梗死灶。由于老年女性患者超声骨窗不佳比例较高,仅9 例(42.9%)患者完成中脑黑质经颅超声检查,但结果均为阴性。2例患者因症状不典型,为进一步鉴别诊断完善DAT-PET检查,结果均为阴性。
所有患者均完成精神认知相关评估,MMSE 提示合并认知功能减退者11 例(52.4%)。HAMA和HAMD提示15例(71.4%)患者合并焦虑,17例(81.0%)患者合并抑郁。
2.2 治疗与预后经综合治疗后,19 例(90.5%)患者的帕金森样症状明显缓解,停用相关致病药物后症状缓解时间最短5 d,最长9个月。2例(9.5%)患者停药后至今随访时间已超过1 a 症状仍持续存在,仍需继续跟踪随访。

图2 1例临床诊断为原发性帕金森病患者的DAT-PET图像,可见双侧壳核中后部多巴胺转运体功能重度减低,双侧尾状核头及壳核前部DAT功能轻-中度减低Figure 2 The DAT-PET image of a patient with a clinical diagnosis of primary Parkinson’s disease showed that the function of the dopamine transporter in the posterior part of the bilateral putamen was severely reduced,and the DAT function of the head of the bilateral caudate nucleus and the front of the putamen was light-moderate reduction
3 讨论
DIP是最常见的药源性运动障碍,其确切患病率不明,有研究估计为0.09%~1.7%,略低于PD[14-15],症状常发生在服药后数周至数月内,主要表现为运动迟缓、肌强直和/或震颤,临床上很难与PD 区分。以下一些临床特点可能有助于DIP 的诊断和鉴别:(1)明确的用药史,本组患者均在用药后出现DIP。(2)起病相对较快,文献报道超过50%的DIP患者在给药1 个月出现症状,90%在给药3 个月出现症状[2]。本研究纳入患者也多数在3 个月内出现症状,与既往报道相符,联合用药的患者可能更快出现症状,而PD 多缓慢起病而逐渐进展。(3)与PD 单侧起病、症状多不对称不同的是DIP患者多为双侧起病,部分患者一侧症状较重,也与以往文献报道相似[2]。但本研究中少数患者单侧起病,与PD 较难鉴别。(4)多数患者对左旋多巴治疗不敏感。(5)既往报道认为DIP 患者不出现震颤或震颤较轻[1-2]。本组患者的表现主要为运动迟缓、肌强直,但仍有近一半的患者出现姿势性或动作性震颤,与PD的静止性震颤不同。(6)部分患者同时合并其他锥体外系表现,如迟发性运动障碍、静坐不能或肌张力障碍。(7)多数DIP 在停药或者调整用药后症状缓解,而PD 则不可逆且逐渐进展。(8)与PD 相比,DIP 的非运动症状相对较少[16-17]。
任何干扰多巴胺传输的药物都可能引起DIP。常见机制[5,18]:(1)多巴胺D2受体阻滞剂对纹状体中多巴胺D2 受体的结构或功能阻断,从而改变基底节-丘脑皮质运动环路的传出通路;(2)多巴胺功能改变也可见于使用丁苯那嗪和利血平等药物后,这些药物可干扰2型囊泡单胺转运体(vesicular monoamine transporter type 2,VMAT2),从而抑制多巴胺储存到突触前囊泡内。丙戊酸也可导致DIP,其机制尚未明确,有研究认为与药物导致氧化应激和线粒体呼吸链功能障碍有关,也可能与γ-氨基丁酸诱导的基底节区多巴胺转运抑制有关[8]。DIP 的发病率随年龄增长而增加,可能是由于多巴胺能神经元数量和多巴胺传输功能随年龄增长而下降,使相关药物更易诱发DIP[19-20]。另外,本研究中女性患者的比例明显高于男性,其中有多例为治疗头痛或头晕而过量(>10 mg/d)或长期(>6 个月)服用氟桂利嗪致病的老年女性患者,还有少数合并焦虑抑郁的患者同时使用了氟桂利嗪和氟哌噻吨等抗抑郁抗精神病类药物,从而加大了诱发DIP 的风险。氟桂利嗪致病机制可能与多巴胺D2 受体阻滞作用及线粒体损伤有关[21]。盐酸氟桂利嗪药物说明书已有明确建议:65岁以上患者推荐起始剂量为5 mg/d,起效后若需维持治疗应减量间断服用,总疗程不应超过6个月。但近年来临床上氟桂利嗪致DIP病例仍不少见,这一方面与部分患者依从性不佳,自行加量或延长使用期限有关,另一方面也与部分临床医生对相关药物适应征及不良反应认识不够有关。同时,本研究纳入的DIP患者中有76%影像学提示存在不同程度的缺血/梗死灶,既往文献也认为脑卒中是DIP尤其是氟桂利嗪所致DIP 的危险因素[8]。另外,本研究纳入的DIP 患者中,合并认知功能减退者占52.4%,同时71.4%患者合并焦虑,81.0%患者合并抑郁,比例均高于健康人群,由于样本量较小,且为回顾性研究,尚不能明确这些患者在发病前就存在认知心理方面问题,还是用药导致DIP 后的并发症[22],今后还需进一步研究。总之,对于老年患者,特别是女性患者,尤其合并卒中病史或头颅影像学提示有多发缺血/梗死灶者,使用可能诱发DIP 的药物需更为谨慎。
多数患者DIP 症状在停用致病药物后可缓解,及时识别对预后至关重要。但也有文献报道,DIP 在停用致病药物后初期缓解,但在数月至数年后复发并进展[2]。还有少数DIP患者在停药后不仅没有改善,反而继续恶化[1]。其中部分患者可能本来处于PD 临床前期,而相关药物加速了PD 症状表现,此类患者的诊断可能应从DIP修正为PD[23]。对于临床难于鉴别的患者,中脑经颅超声检查(transcranial sonography,TCS)[24]和 多 巴 胺 转 运 体(dopamine transporter,DAT)成像[25-27]有助于两者鉴别,DIP患者上述两项检查结果一般为阴性,而PD 患者则为阳性。但由于DIP 患者中老年女性患者的比例较高,而此类患者颅骨声窗不佳的情况较多,限制了中脑经颅超声的应用。而多巴胺转运体(DAT)尽管不受骨窗影响,但由于目前费用高昂,仅在少部分鉴别困难且经济情况较好的患者中应用。而值得注意的是,少数DIP患者停药后症状持续很长时间不缓解,还有一些患者症状缓解一段时间后再次出现PD症状[28],具体机制不明,推测DIP可能增加患PD 风险[29-30],今后还需更深入研究阐明相关机制,另一方面说明部分DIP患者可能预后不佳,更应重视预防。
治疗DIP 的方法首先是停止使用致病药物,但由于部分慢性疾病(如精神心理疾病)患者需长期应用相关药物而不能停药,则应尽量选用锥体外系副作用较少的药物。某些情况下,对患者影响较小的轻度DIP不一定需要治疗,特别是当继续使用相关药物对维持患者基础病情稳定较为重要且无可替代时。而遇到调药较困难的情况,如必须使用抗精神病药物治疗的重度精神疾病患者,若同时出现较严重DIP,可能需要神经科、精神科医师和药剂师的多学科合作,治疗方案包括停用致病药物、降低致病药物剂量或改用低风险抗精神病药。若患者症状较重或无法完全停用致病药物时,可考虑加用对症药物治疗,但目前尚缺乏特效对症治疗,若症状以行动迟缓为主可首先试用左旋多巴制剂及多巴胺受体激动剂,金刚烷胺对僵直及肌张力障碍可能有效,而抗胆碱能药物对震颤疗效较好,苯二类药物对迟发性运动障碍和静坐不能有效[31],另外也有电休克治疗可用于难治性DIP患者的案例[33],应根据具体情况选择适合患者的个体化治疗方案。
由于种种原因,DIP 易漏诊误诊,临床上许多药物都可能干扰多巴胺传输通路而致病,而部分患者症状可能较轻,因此其实际发病率可能被低估。随着人口老龄化的到来和更多新药的应用,其发病率有可能继续升高,给患者带来本可避免的痛苦,同时造成更多经济负担和医疗资源消耗。临床医生和药师应高度警惕DIP这一医源性疾病,严格把握相关药物的适应症及禁忌证,使用合理的治疗剂量,控制用药疗程并加强用药期间监测,出现相关症状及时停药或调整治疗方案,上述措施对DIP的预防、识别和诊治至关重要。
