非侵入性神经调控对脑损伤后意识障碍的疗效观察
2021-12-02冯海霞李亚斌许东升王红霞杨佳丽曹志刚
李 姣 冯海霞△ 李亚斌 许东升 王红霞 杨佳丽 曹志刚 刘 忠
1)甘肃省康复中心医院,甘肃 兰州 730000 2)同济大学医学院,上海 200092
随着社会经济的快速发展,近年来脑损伤的发病率呈逐年上升趋势,虽然脑损伤后的病死率在目前高质量的医疗条件下不断降低,但仍有40%~50%的患者存在严重的功能障碍,15%~20%的脑损伤患者合并意识障碍[1]。影响患者预后的决定因素是昏迷时间的长短,长时间意识障碍可导致严重的相关并发症,促醒和功能康复是目前神经康复重要的目标[2],如不能有效解决这种现状,将会带来一系列难以承受的社会问题[3]。寻求一种简便、安全且有效的促醒治疗措施,加速脑损伤后意识障碍患者促醒进程,避免患者进入永久植物状态,是目前神经重症康复领域值得关注的问题[4-5]。药物、穴位针刺、高压氧舱等是目前临床上常规使用的促醒手段,但这些常规的促醒方法不是存在相关不良反应,就是具有一定的局限性,限制了脑损伤后意识障碍患者的康复治疗进程,而非侵入性神经调控技术则是近年来出现的新型促醒方法[6]。经颅直流电刺激(transcranial direct current stimulation,tDCS)[7-10]具有中枢神经调控的能力,不仅能通过直流微电流调节脑内兴奋性神经递质而增强相关脑网络的功能重组,还能提高刺激区域微循环及脑皮层的兴奋性,近年来在脑损伤后所致的运动、言语认知、吞咽障碍及情绪调节方面取得一定的疗效,而且在意识障碍方面也有相关报道。正中神经电刺激(median nerve electrical stimulation,MNES)[11-14]通过外周神经调控的方法使特异性感觉神经上行传导通路激活对侧大脑感觉皮层,诱导大脑神经元可塑性改变,具有促进大脑广泛觉醒的潜在能力。虽然上述两种方法均有促醒潜能,在临床上有所使用,但对促醒的价值尚处于研究阶段,且均为小样本量研究,未见将两者同时联合进行促醒治疗的研究,脑损伤后意识障碍的机制目前尚不完全清楚,导致意识障碍的机制也多样化。本研究通过中枢联合外周的非侵入性神经调控技术,自下而上协同自上而下对皮质神经网络协同增强的调控,以促进脑损伤后意识障碍患者意识水平的恢复,在临床初探的基础上,通过临床昏迷量表及神经电生理评估方法,揭示意识障碍患者促醒的神经调控网络机制。
1 资料与方法
1.1 病例资料及分组
1.1.1 入选标准:①由颅脑损伤造成的意识障碍;②左侧前额叶脑区经头颅影像学(CT 或MRI)检查提示未完全损伤;③首次发病,发病时间要求≤3 个月,年龄18~65 岁,病情平稳;④要求患者家属充分知情,并签署知情同意书;⑤临床试验之前未接受过正中神经电刺激及经颅直流电刺激之类的治疗方案。
1.1.2 排除标准:①严重的脑积水、脑萎缩及脑干损伤;②贴片部位皮肤存在过敏、溃烂或炎症;③有心脏起搏器、脑脊液腹腔引流泵等电子医疗装置植入物;④持续性癫痫、严重心律失常;⑤转科、转院、家属中途终止治疗、死亡等因素造成自动脱落。
1.1.3 患者一般资料:采用随机数字表法,将甘肃省康复中心医院神经康复科2019-10—2021-06收治的102例脑损伤后意识障碍患者分为3组各34例。A组为常规治疗+阳极tDCS刺激组,B 组为常规治疗+MNES 组,C 组为常规治疗+阳极tDCS 刺激组+MNES 组。A 组男19 例,女15 例,年龄(40.85±15.92)岁,病程(44.17±23.36)d;B 组男16 例,女18 例,年龄(39.33±16.74)岁,病程(42.23±26.15)d;C组男17 例,女17 例,年龄(41.57±14.23)岁,病程(45.04±22.67)d。3组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
1.2.1 3组治疗方法:3组患者均给予药物、穴位针刺及高压氧舱治疗等常规促醒的治疗措施,A 组在常规促醒治疗的基础上应用阳极tDCS治疗;B组在常规促醒治疗的基础上应用MNES 治疗;C 组在常规促醒治疗的基础上同时应用阳极tDCS联合MNES治疗。
1.2.2 tDCS 治疗[15]:应用智能直流微电流刺激仪(武汉-亿迈),电极片大小为3.5 cm×5 cm,阳极置于国际脑电图定位Cz点向前5 cm、向左7 cm 的左前额叶背外侧区(dorsolateral prefrontal cortex,DLPFC),阴极置于对侧肩部;2.5 mA 的刺激强度,电流密度0.14 mA/cm2。20 min/次,1次/d,6 d/周,治疗8周。
1.2.3 MNES治疗[16]:应用正中神经电刺激仪(江西-诺诚),调整刺激参数为60 Hz、250 μs的方波刺激模式,刺激右侧腕部正中神经,右拇指轻度缩动作为刺激的参考强度。20 min/次,1次/d,6d/周,治疗8周。
1.3 疗效判定由两名熟悉神经电生理的中级职称以上医师对3组患者进行治疗前、治疗后4 周及治疗后8 周体感诱发电位检查;由两名中级职称以上康复治疗师对3组患者进行治疗前、治疗后4 周及治疗后8 周昏迷量表评分。评估当天患者无镇静及麻醉类药物使用情况。
1.3.1 体感诱发电位[17]:应用诱发电位仪(丹麦-Keypoint),方波刺激,强度4~10 mA,叠加150~200次,记录分析N20潜伏期、波幅。
1.3.2 格拉斯哥昏迷量表评分法(Glasgow coma scale,GCS)[18]:最低分3 分,最高分15分,分别以光线、声音及疼痛刺激评估患者的睁眼、言语及运动功能,意识水平与分值高低呈正相关。
1.3.3 昏迷恢复量表(the coma recovery scale-revised,CRS-R)[19]:较GCS量表增加了唤醒反应、交流能力及听觉水平等方面的评估内容,最低分为0分,最高分为23分,分值高低与意识水平呈正相关。
1.4 统计学分析统计学分析使用SPSS 22.0 软件,计量资料以均数±标准差(±s)表示,组内比较用配对样本t检验,组间比较用独立样本t检验。显著性水平取α=0.05。
2 结果
2.1 体感诱发电位变化情况3组患者治疗4周及8 周后N20 波幅及潜伏期组内变化及组间比较见表1。
表1 3组治疗前后N20潜伏期及波幅比较 (±s)Table 1 Comparison of N20 incubation period and amplitude before and after treatment in three groups (±s)
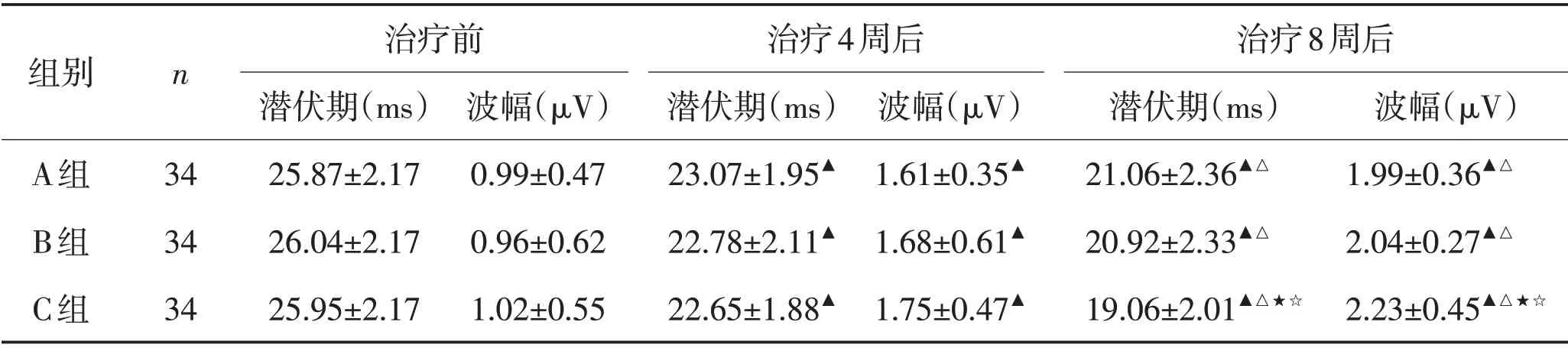
表1 3组治疗前后N20潜伏期及波幅比较 (±s)Table 1 Comparison of N20 incubation period and amplitude before and after treatment in three groups (±s)
注:3组治疗4周后潜伏期及波幅比较,F=4.851、6.539,P=0.024,0.012;3组治疗8周后潜伏期及波幅比较,F=8.621、9.247,P=0.001,0.000;与治疗前比较,▲P<0.05;8 周治疗后与治疗4 周时比较,△P<0.05;8 周治疗后与A比较,★P<0.01;8周治疗后与B组比较,☆P<0.01
组别n A组B组C组治疗前潜伏期(ms)25.87±2.17 26.04±2.17 25.95±2.17 34 34 34波幅(μV)0.99±0.47 0.96±0.62 1.02±0.55治疗4周后潜伏期(ms)23.07±1.95▲22.78±2.11▲22.65±1.88▲波幅(μV)1.61±0.35▲1.68±0.61▲1.75±0.47▲治疗8周后潜伏期(ms)21.06±2.36▲△20.92±2.33▲△19.06±2.01▲△★☆波幅(μV)1.99±0.36▲△2.04±0.27▲△2.23±0.45▲△★☆
2.2 昏迷量表分值变化情况3组患者治疗4周及8周后GCS、CRS-R分值结果组内变化及组间比较见表2。
表2 3组治疗前后GCS、CRS-R评定比较 (分,±s)Table 2 Comparison of GCS and CRS-R scores before and after treatment in the three groups (scores,±s)
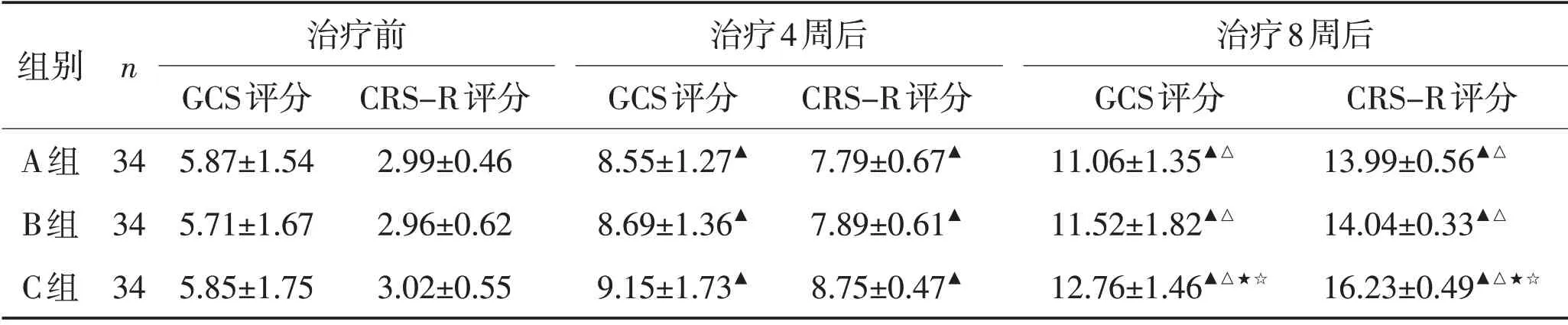
表2 3组治疗前后GCS、CRS-R评定比较 (分,±s)Table 2 Comparison of GCS and CRS-R scores before and after treatment in the three groups (scores,±s)
注:3组治疗4周后GCS及CRS-R评分比较,F=4.452、3.607,P=0.031,0.026;3组治疗8周后GCS及CRS-R评分比较,F=7.471、8.516,P=0.015,0.001;与治疗前比较,▲P<0.05;8 周治疗后与治疗4 周时比较,△P<0.05;8周治疗后与A比较,★P<0.05;8周治疗后与B组比较,☆P<0.05
组别n A组B组C组治疗前GCS评分5.87±1.54 5.71±1.67 5.85±1.75 34 34 34 CRS-R评分2.99±0.46 2.96±0.62 3.02±0.55治疗4周后GCS评分8.55±1.27▲8.69±1.36▲9.15±1.73▲CRS-R评分7.79±0.67▲7.89±0.61▲8.75±0.47▲治疗8周后GCS评分11.06±1.35▲△11.52±1.82▲△12.76±1.46▲△★☆CRS-R评分13.99±0.56▲△14.04±0.33▲△16.23±0.49▲△★☆
3 讨论
意识障碍是脑损伤后严重的功能障碍之一,是国际医学界一直没有完全解决的医学难题[20]。根据2020 版颅脑损伤诊治指南[21],很多新的治疗方案已经有效降低了颅脑损伤患者的病死率,但颅脑损伤后伴意识障碍的患者数量仍居高不下,意识障碍的促醒治疗到目前为止仍缺乏规范有效的诊疗方法和指南。
本研究显示,3组患者N20潜伏期、波幅变化及GCS、CRS-R评分均较治疗前均显著提高(P<0.05),说明脑损伤后意识障碍患者采用常规促醒治疗及联合神经调控技术,患者意识水平可出现不同程度的改善,可能与颅脑损伤后通过外周联合中枢特异性及非特异性感觉输入和神经调控技术可有效加强神经细胞突触-突触、突触-树突、树突-树突之间广泛联系有关。治疗8周结束后C组N20波幅及潜伏期变化显著优于其他2 组(P<0.01),且GCS、CRS-R评分显著高于其余2组(P<0.05),提示随着患者病程的延长,在常规治疗基础上应用自上而下联合自下而上的神经调控技术促醒疗效更为显著,对患者意识水平的改善具有持续效应,这可能与通过MNSE兴奋上行激活系统的同时给予左侧DLPFC区域阳极tDCS增强皮层电位活动有关。在意识障碍患者中体感诱发电位N20 潜伏期缩短及波幅的重新出现或增高,一定程度上提示特异性感觉传入通路、间脑及端脑的上行通路建立,体感诱发电位作为重要的电生理学指标,其相关指标改善能对意识障碍患者的特异性感觉传导通路恢复起到较好的预测作用[22-23]。格拉斯哥昏迷量表能够初步判断患者的昏迷程度,是目前应用最为广泛的昏迷评定量表,对于意识障碍患者进行全面的意识评定及不同的意识状态的区分,CRS-R在其中发挥更为重要的作用。临床上对于意识障碍分型的初步筛查评定均是通过GCS、CRS-R 判断,但通过量表的判断评估存在一定的缺陷,如对一些伴运动、感觉损害及临床上气管切开等患者,此方法会影响评估的准确性[24-25],故本研究在脑损伤患者意识障碍的精准评定系统上结合神经电生理学评定指标,能够更加客观反映患者意识改变情况。
tDCS通过调节神经细胞膜上的金属离子通道而引起膜电位改变,能调节脑内N-甲基-D-天冬氨酸受体,且被刺激脑区血流速度增快,相应皮层兴奋性增高,对神经突触活动产生长时程增强和长时程抑制作用[26-27]。RUI等[28]应用阳极tDCS 对15 例无反应觉醒综合征患者和20例最低意识状态患者采用了持久的高强度电流刺激方案,治疗2周后患者的意识水平均较治疗前好转。KAMIN等[29]通过对脑卒中后左侧DLPFC 区域行阳极tDCS 后,行fMRI 评估脑静态网络连接发现,相应的脑网络功能连接增强。FENG等[30]最大使用10 mA强度的阳极tDCS 未发现对人体产生不良影响。MNES 使用特定的低频电刺激患者右侧正中神经,通过感觉神经上行传导通路可激活对侧大脑感觉皮层诱导大脑神经元可塑性改变,具有促进大脑广泛觉醒的潜在功能。XIANG等[31]采用正中神经电刺激意识障碍患者右侧正中神经,通过电刺激治疗的患者,其意识障碍的水平提高且转变为植物状态的比例也有所降低。国内外相关研究[32-33]发现,通过右侧正中神经电刺激可以调控神经抑制性及兴奋性递质水平,改善大脑局部血流量、神经营养因子等与意识障碍患者促醒有关的因素。对于意识障碍患者的促醒治疗将“自上而下”的tDCS 治疗与“自下而上”的MNES 治疗联合起来,不仅可以增加脑损伤区域的神经组织修复能力,还可能通过激活皮质-皮质下、皮质-皮质的神经网络活动,调节与促醒有关脑区的正向功能,达到促醒的目的。两者结合还可使神经递质分泌受影响,前额叶皮质和下丘脑组织的兴奋性神经肽增多,有效改善意识障碍患者的行为水平,提高意识障碍患者促醒率。
在世界范围内一些长期随访研究发现,神经调控在提高患者意识水平及昏迷促醒中意义重大,但随着神经调控技术相关研究的指数性上升,其在临床促醒治疗中的应用需要不断的更新改进,因此,对于意识障碍患者的促醒治疗需要全方位多学科协同,对于意识障碍的治疗无论从评定还是康复做到精准化、体系化。本研究采用“自下而上”的MNST结合“自上而下”的tDCS 应用于临床意识障碍患者的促醒治疗,结果显示经联合治疗后意识障碍患者的疗效明显优于单独使用其中一种治疗方案,但本研究缺乏对患者出院后疗效的进一步随访,两种刺激方案联合后的持续效应有待进一步证实。
