螺旋断层放疗在胸中下段食管癌治疗中对心脏功能保护的研究
2021-12-02樊春波王晶何亚男席道军李建锋孙卯李丛郭启帅靳富
樊春波,王晶,何亚男,席道军,李建锋,孙卯,李丛,郭启帅,靳富
重庆大学附属肿瘤医院/重庆市肿瘤研究所/重庆市肿瘤医院放射治疗中心,重庆 400030
前言
食管癌是最常见的消化道肿瘤之一,其发病率、死亡率在中国分别排名第6位和第4位[1-2],而放射治疗一直是食管癌的主要治疗方式之一[3-4]。随着放疗技术的提升,固定野调强放射治疗(IMRT)、容积旋转调强放射治疗(VMAT)都得到了快速的发展[5]。但是,VMAT技术在降低治疗时间的同时显著增加了危及器官低剂量区照射体积,导致二次致癌的风险[6]。因此,IMRT技术成为当前在临床中使用较为广泛的技术。
螺旋断层放射治疗(TOMO)是一种全新的调强治疗模式,将计算机断层扫描(CT)与直线加速器融为一体,可在兆伏级CT 引导下360°聚焦断层照射。在多种肿瘤的治疗中,TOMO 技术展现出较IMRT 更好的靶区剂量分布及适形度[7-9]。考虑到胸中下段食管癌患者在接受放疗时心脏极易受到放射损伤,同时肺部也会受到一定剂量的照射,可能引起心肺联合反应,严重影响患者的治疗后生存率[10],而TOMO在提高靶区剂量分布的同时在危及器官的保护上也有一定的优势[11-15]。因此,本研究针对胸中下段食管癌患者,分别制定IMRT 和TOMO 计划,比较两种放疗方式心脏的剂量分布以及放疗前后心肌酶谱改变,探讨TOMO对心脏的保护作用。
1 资料与方法
1.1 临床资料
搜集我院2016年8月1日至2018年12月12日收治的37 例胸中下段食管鳞癌患者。其中,II 期17例,III期20例;男23例,女14例;平均年龄(68.3±5.6)岁。所有患者均为首次放疗,X线片显示肿瘤长度为1.5~6.3 cm,KPS 评分均大于70 分,无既往肿瘤病史,无淋巴及转移,所有患者均已签署知情同意书,并经我院伦理委员会批准。
1.2 方法
1.2.1 扫描定位患者均采用常规放疗体位,胸部热塑膜固定,使用激光定位灯体表标记肿瘤中心并作铅点标识,然后使用Philips 公司生产的Brilliance 大孔径螺旋CT,进行3 mm 层厚增强扫描,扫描范围包括两侧全肺及上腹部,最后扫描完成后的CT 图像同时传输至两个治疗计划系统进行三维重建。
1.2.2 靶区勾画由放疗科和影像科医生共同在重建后的影像上勾画出大体肿瘤区(GTV)、临床靶区(CTV)、计划靶区(PTV),危及器官包括心脏、肺、脊髓,心脏需分别勾画左右心房及心室。GTV 以CT 图像为基础,参考内镜、内镜超声、造影剂造影,勾画出可见肿瘤病灶及局部增大淋巴结;CTV 为GTV 上下各扩3 cm、前后左右外放0.5 cm;PTV 为CTV 前后左右均匀外放0.5 cm[16]。
1.2.3 治疗计划由两名固定物理师进行计划设计,其中IMRT采用RaySearch Laboratories AB进行IMRT计划设计,该计划采用等中心共面7野step-and-shot IMRT技术,同时7 野中每个野包括10 个子野;TOMO 采用Accuray螺旋断层放疗系统(TOMO HDTMVersion 2.0.5)进行TOMO 计划设计,该计划每个螺旋包括51 个射束[17]。两种放疗计划处方剂量为60 Gy,每次2 Gy,每周5次。本研究为回顾性分析,实际治疗中3例患者采用IMRT,34例患者采用TOMO。
1.2.4 剂量参数比较本研究纳入的剂量参数包括:PTV、心脏、脊髓的最大剂量Dmax,心脏接受≥20、30、40、50、60 Gy 的体积占比V20、V30、V40、V50、V60,以及PTV 的适形度指数(CI)和均匀性指数(HI)。其中,脊髓和肺受量需在正常组织器官安全剂量内。
1.2.5 心肌酶谱测定放射性心脏损伤(RIHD)与心脏受照体积和剂量有关,当受照剂量>40 Gy 时,发生率逐渐增加,每增加1 Gy 就可能使放疗相关性心脏事件危险度增加4%,其最早表现为血清酶谱升高[18]。因此分别于TOMO 开始前一周及放射治疗结束后1 周采集患者静脉血,分别测量谷草转氨酶(AST)、谷丙转氨酶(ALT)、磷酸酶(CK)、α-羟丁酸脱氢酶(A-HBD)、血清乳酸脱氢酶(LDH)。
1.3 统计学方法
采用SPSS 13.0软件对数据进行统计学分析。符合正态分布的计量资料用均数±标准差表示,采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两种放疗方式PTV剂量参数比较
TOMO 和IMRT 计划中PTV 的Dmax分别为(65.17±0.91)Gy、(66.40±1.03)Gy,差异有统计学意义(P<0.05);Dmean分别为(62.76±0.64)Gy、(62.87±0.55)Gy,差异无统计学意义(P>0.05);TOMO 的CI值高于IMRT,差异具有统计学意义(0.80±0.06vs0.75±0.08,P<0.05);TOMO 的HI 值与IMRT 相比,差异无统计学意义(0.12±0.04vs0.13±0.03,P>0.05)。
2.2 两种放疗方式心脏剂量线比较
如表1所示,TOMO 组心脏V20、V30、V40、V50、V60均明显低于IMRT组,差异有统计学意义(P<0.001),同时TOMO 组心脏接受的Dmax和Dmean明显低于IMRT组,差异有统计学意义(P<0.05)。
表1 两种放疗方式心脏剂量线比较(± s)Tab.1 Comparison of dosimetric parameters of the heart between two radiotherapy strategies (Mean±SD)
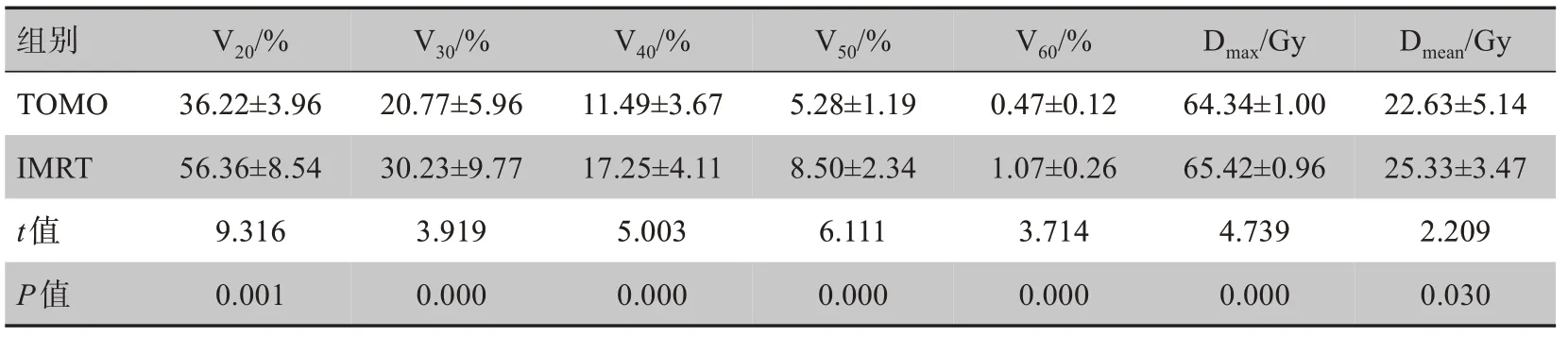
表1 两种放疗方式心脏剂量线比较(± s)Tab.1 Comparison of dosimetric parameters of the heart between two radiotherapy strategies (Mean±SD)
组别V20/%V30/%V40/%V50/%V60/%Dmax/Gy Dmean/Gy TOMO IMRT t值P值36.22±3.96 56.36±8.54 9.316 0.001 20.77±5.96 30.23±9.77 3.919 0.000 11.49±3.67 17.25±4.11 5.003 0.000 5.28±1.19 8.50±2.34 6.111 0.000 0.47±0.12 1.07±0.26 3.714 0.000 64.34±1.00 65.42±0.96 4.739 0.000 22.63±5.14 25.33±3.47 2.209 0.030
2.3 两种放疗方式心脏亚单位剂量比较
如表2所示,在TOMO 和IMRT 计划的心脏亚结构中,仅左心房Dmax差异有统计学意义(P<0.05),其余亚结构剂量分布差异无统计学意义(P>0.05)。
表2 两种放疗方式心脏亚单位剂量比较(Gy,± s)Tab.2 Comparison of dosimetric parameters of heart subunits between two radiotherapy strategies (Gy,Mean±SD)

表2 两种放疗方式心脏亚单位剂量比较(Gy,± s)Tab.2 Comparison of dosimetric parameters of heart subunits between two radiotherapy strategies (Gy,Mean±SD)
左心房左心室右心房右心室组别Dmax Dmean Dmax Dmean Dmax Dmean Dmax Dmean TOMO IMRT t值P值63.91±0.98 65.18±0.99 5.546 0.000 44.05±9.89 45.85±9.91 0.782 0.437 47.79±13.51 52.14±14.78 1.194 0.236 16.32±6.69 16.28±5.01 0.020 0.984 50.35±12.65 53.56±9.66 1.227 0.224 24.46±7.98 23.20±5.61 0.525 0.601 43.25±9.26 47.99±10.33 1.658 0.102 19.46±4.85 17.11±3.31 1.245 0.217
2.4 TOMO前后心肌酶谱变化
如表3所示,TOMO 后心肌酶谱有一定程度升高,但放疗前后心肌酶谱改变差异无统计学意义(P>0.05)。
表3 TOMO前后心肌酶谱变化趋势(U/L,± s)Tab.3 Changes of myocardial enzymogram before and after TOMO(U/L,Mean±SD)
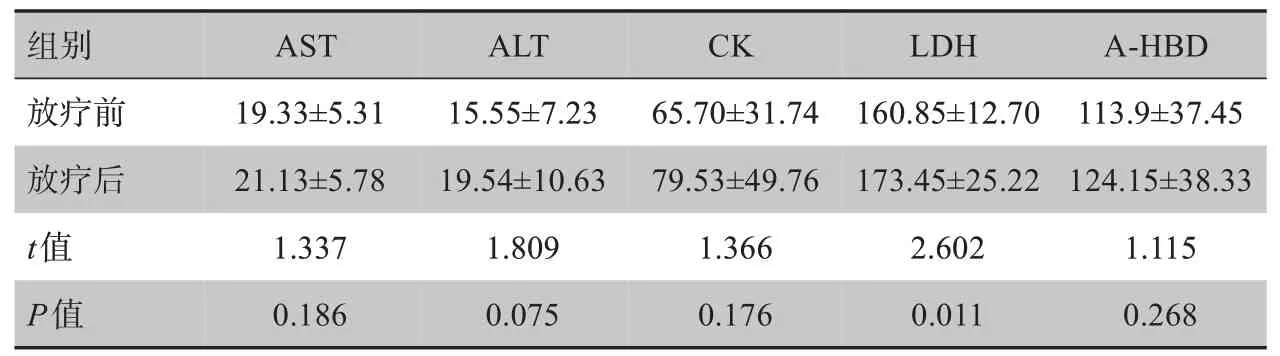
表3 TOMO前后心肌酶谱变化趋势(U/L,± s)Tab.3 Changes of myocardial enzymogram before and after TOMO(U/L,Mean±SD)
组别AST ALT CK LDH A-HBD放疗前放疗后t值P值19.33±5.31 21.13±5.78 1.337 0.186 15.55±7.23 19.54±10.63 1.809 0.075 65.70±31.74 79.53±49.76 1.366 0.176 160.85±12.70 173.45±25.22 2.602 0.011 113.9±37.45 124.15±38.33 1.115 0.268
3 讨论
放射治疗是治疗食管癌最普遍的方式,也是最重要的手段之一,目前IMRT 是临床上使用最普遍的放疗方式。此方法在提高放射治疗效果的同时还能保护肿瘤周围正常组织[19],然而放疗导致的不良反应却始终难以得到有效控制。其中放射性心损伤是目前胸段食管癌放疗最严重的不良反应之一,同时也是造成患者生存率低下的主要原因[20]。目前,对于中晚期胸中下段食管癌患者,同步放化疗是最普遍的治疗方式,然而由于食管近心肺的解剖特点,放疗的治疗方式不可避免会造成心肺受到较高的照射剂量。文献[21]显示食管癌患者中有明显放射性心肌损伤的高达10.8%,并且大部分发生在治疗后2年内,严重影响生存质量。放射性心损伤是食管癌患者不可忽视的不良反应,同时其发生率也往往被低估,有文献显示心肌损伤在食管癌放疗早期就已经发生[22-23]。因此胸段食管癌患者放化疗过程中对心脏的保护尤为重要。
本研究通过对37 例胸中下段食管癌患者分别制定TOMO计划和IMRT计划,比较两种放疗方式在患者心肺中的剂量分布,探讨TOMO 在胸中下段食管癌患者治疗中对心脏的保护作用。研究显示,相比IMRT,TOMO 对于PTV 的最大剂量明显更低,同时TOMO 计划的CI 值(0.80±0.06)相比IMRT 计划(0.75±0.08)更加接近于1,表明TOMO 计划具有更好的靶区适形度。心肌放射性通常取决于心脏受到的较高剂量的射线照射体积,本研究TOMO 的心脏受到的较高剂量的体积(V20~V60)明显低于IMRT,差异具有显著性,同时TOMO 计划中心脏受到的最大剂量和平均剂量也明显低于IMRT,表明TOMO 计划相比IMRT 计划对心脏具有更低的毒性。同时本研究对TOMO 前后心肌酶谱的变化进行分析,发现ALT、AST、LDH、A-HBD、CK 均有所升高,但差异无统计学意义,表明TOMO 可以有效降低心肌损伤。上述数据表明相比IMRT 计划,TOMO 计划能够在保证靶区剂量的同时,显著降低心脏的损伤。
综上所述,TOMO 在胸中下段食管癌患者的治疗中,具有良好的靶区适形度以及剂量分布均匀性,能够对肿瘤病灶有更加准确均匀的照射,同时显著降低心脏的剂量分布以及放射性心肌损伤,对心脏具有良好的保护作用。
