新冠病毒的自白
2021-12-01周浩王皞鹏杨海涛
周浩 王皞鹏 杨海涛
要问“客”从何处来
首先,请允许我进行自我介绍。我是冠状病毒家族中新晋的一员,人类把我叫作新型冠状病毒(SARSCoV-2),而由我引起的肺炎则被叫作新型冠状病毒肺炎(corona virus disease 2019, COVID-19)。蝙蝠往往是我们冠状病毒家族温暖的归宿,我和很多的亲戚朋友们都长期居住在蝙蝠的体内并不断进化。而且时不时地,我们还可以到不同的动物体内串串门,“运气好”的话最终还可以传染到人类体内。老前辈非典病毒(SARS病毒)就是通过果子狸最终传染人类的,我的远方亲戚MERS病毒也是找骆驼做的中间商。今年我也追寻着前辈们的脚步,找到了一些秘密“掮客”作为中转,最后进入了人类社会。
2019年年末,我一来到密集的人类社会就发现,这里的环境可太好了!每天都有来来往往的人群,这为我的传播提供了人数基础,而寒冷的天气与避光的场地则让我能够存活得更久。我的主要传播方式是飞沫传播,这种传播方式迅速而不易被察觉,许多病毒界的名流,比如流感病毒就是靠这一招走遍天下的。当我随着咳嗽或喷嚏的飞沫来到空气中,它们会包裹着我在空气中游荡。有时候运气好就能直接找到下一个感染者,但就算落在一些金属或者玻璃的表面,我也能存活大概一周的时间,其间偶尔就会有“有缘人”找上门,碰了我之后再揉揉眼睛或鼻子,这种间接的接触传播也是我能在短时间感染这么多人的一大利器。
我的生活史
免疫系统保护人类的第一道防线由皮肤和黏膜组成。虽然皮肤几乎完全覆盖了人类身体表面,但幸运的是,人们暴露在空气中的嘴唇、眼皮、口腔和鼻腔上都有着大量的黏膜细胞。作为冠状病毒,当我接触到黏膜细胞时,我囊膜外衣上的S 蛋白(spike glycoprotein,刺突糖蛋白)就能与细胞表面的血管紧张素转化酶2结合、识别并带我进入细胞内部。每个被感染的细胞都能产生成千上万个新的病毒颗粒,这种数量优势使我能够快速攻占人体的多个器官和组织。其实人体的肺部和心脏等器官都有血管紧张素转化酶2的表达,但往往在我刚想进一步攻城略地的时候,人类的免疫细胞就发现端倪并抄家伙来了。
其实真要说起来,我的目的从来都不是要杀死人类,毕竟杀死了宿主还怎么增殖传播呢?反倒是人体那些巨噬细胞、中性粒细胞、自然杀伤细胞、T细胞等免疫细胞见了我就像发了疯似的,它们分泌出许多细胞因子一顿狂轰滥炸不分敌我。年轻的宿主身体素质比较好还能扛过去,而许多年老的宿主抵不过呼吸系统衰竭、心衰或肾衰,很快便生命垂危。
要说我对人类有什么危害,顶多是因为我会损伤肺泡中的Ⅱ型肺泡细胞,这种细胞对人类呼吸系统挺重要的。它平日里会分泌一些脂质和蛋白质来扩大肺泡面积,当这种细胞被攻击,肺泡会因为水分子的表面张力而缩小,氧气、二氧化碳等气体交换的效率也会显著下降,以至于不足以维持人类的日常生活。所以肺部的肌肉就会不断扩张,试图把肺泡拉大,但这样肺泡与肌肉间就会出现一些气压很低的区域,进而导致炎症区域积水像拔火罐一样被吸进去,呼吸反而变得更加困难[1]。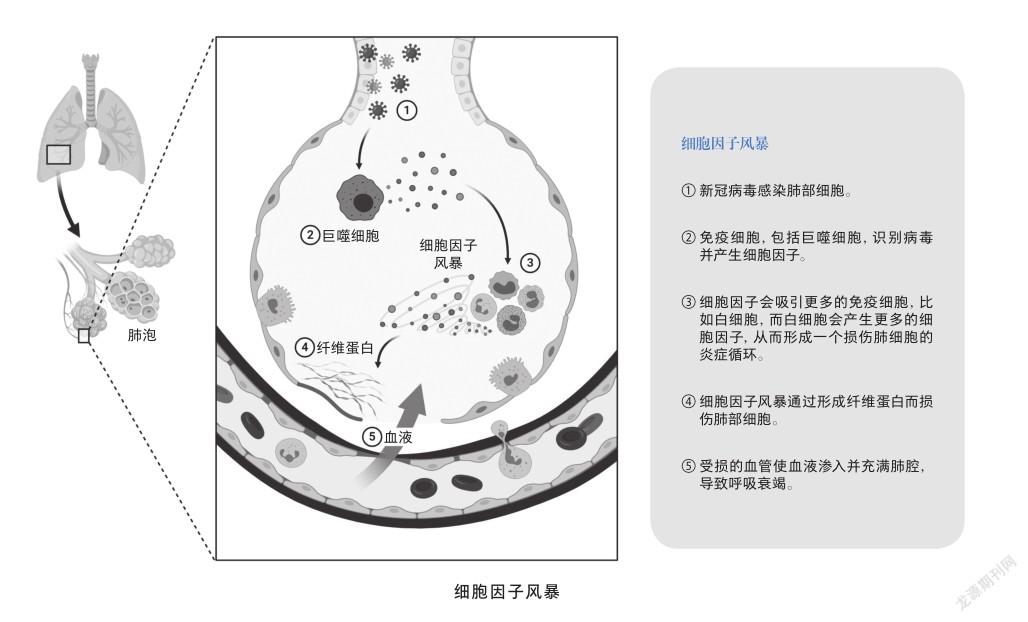
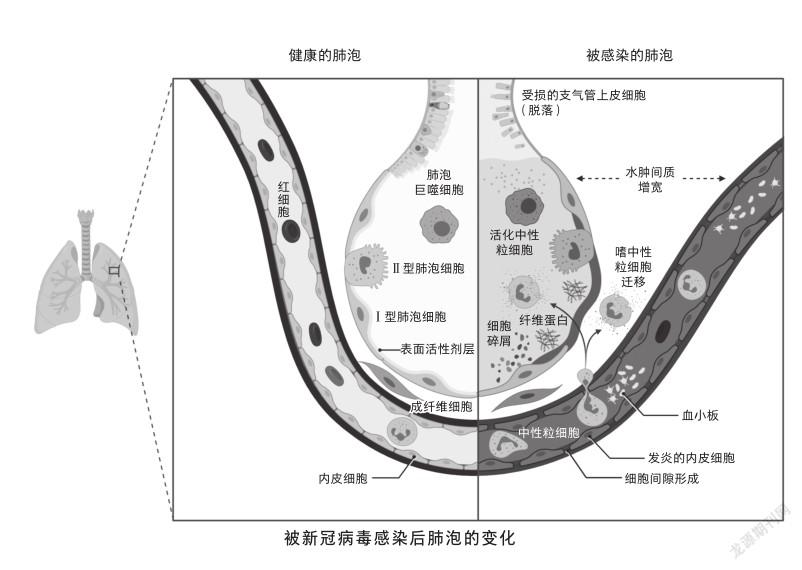
虽然到最后我可能会导致宿主产生炎症疾病,甚至死亡,但是这并不能明显削弱我的传染能力。因为在宿主还没有发展为重症之前,我就可以通过飞沫传播的途径在人群中四处传播开了,只要不断循环感染到传染的这一流程,很快全世界都将见识到我的威力。
我的弱点
冠状病毒家族有着悠久的历史,而能够从其中脱颖而出并在人类社会卷起轩然大波的我更将“名垂青史”。但即便强大如我,除了不耐高温和紫外线之外,还有一些弱点似乎被人类发现了。
蛋白質是生命活动的主要承担者,这点对我也不例外。但与人类或者说大多数生物不同,作为RNA生物,我的蛋白表达可以直接用自身携带的RNA作为模板,偷偷利用宿主的翻译机器生产我的蛋白质,而不需要从DNA转录成RNA,但这也使得我在繁殖后代时必须要表达人类宿主所没有的一种RNA聚合酶来复制RNA。我把与生命活动相关的非结构蛋白编码基因放在基因组(RNA)的前2/3区域,而把组成我蛋白质外壳的结构蛋白编码基因放在后1/3区域,毕竟重要的蛋白要先表达,不然基因都复制不了,更别说繁殖后代了。
在我进入黏膜细胞后,第一件事就是先翻译出两条非结构蛋白,多聚蛋白pp1a和pp1ab,多聚蛋白就像一串珍珠一样,行使不同功能的蛋白质(珍珠)互相连接在一起。其中的两颗“珍珠”——木瓜蛋白酶和主蛋白酶能通过自剪切,将自己从多聚蛋白pp1a和pp1ab中切割并释放出来。随后,这两种蛋白酶就可以将多聚蛋白pp1a和pp1ab上剩下的珍珠相互切开,最终释放出包括两种酶在内的16颗“珍珠”,即16种非结构蛋白。这些非结构蛋白,如RNA依赖的RNA聚合酶、解旋酶等进而组装成复制酶复合物,完成基因组的复制和转录。在这个过程中,木瓜蛋白酶有3个酶切位点,而主蛋白酶有11个酶切位点[2]。
令我畏惧的是,人类已经发现了针对我的药物研制方向——把主蛋白酶和RNA聚合酶作为药物靶点。因为这些蛋白在我基因组的复制、转录过程中发挥着关键的调节作用,同时在人体内并不存在与之相似的蛋白质。因此,针对这两种酶设计的抑制剂药物在干扰我正常繁殖的同时,对人体的副作用也很小。
人类的对策
这次疫情暴发,人类的处理方式比起18年前也变得更加成熟。从拿到携带着我的肺炎样品到确定病毒全基因组只花了几天的工夫,他们还迅速分离出了病毒毒株。面对传染病,人类采取的最有效方式就是制造疫苗,而比较常用的有减毒活疫苗和灭活疫苗。减毒活疫苗就是在体外对我进行一代又一代的培养,由于我们病毒的基因组不稳定,在这种传代的过程中,会逐渐积累突变,最终可能就会在这个过程中产生对人体造成危害较低的后代。人们将这些后代注射到自己体内,既不会给人体造成严重疾病,又可以让免疫系统认识并记住我们,从而起到预防作用。灭活疫苗就更“粗暴”了,不管三七二十一直接把我们灭活(杀死)了,使得我们在注射入人体后对免疫系统的刺激也就更弱了。
但我和兄弟姐妹们也有对付疫苗的办法,比如我们会经常通过突变基因组来改头换面,这样疫苗的免疫作用就没法识别我们;另外疫苗可能对我们直系亲属有效,但是对我的远方亲戚几乎不起作用。但如果人类针对我们一大家族的共同弱点设计出广谱药物,那就不光是我自己,连我们整个冠状病毒大家庭都会受到沉重打击。为了研发针对我们家族的药物,人类学会了探究我们的弱点。他们知道我们冠状病毒的弱点往往在自身的蛋白质(比如关键酶)上,但由于蛋白质实在太小,超出了光学显微镜能观察的范围,所以人类现在利用X-ray衍射晶体学成像、NMR核磁共振成像和Cryo-EM冷冻电子显微镜成像等技术来“窥探”蛋白质的三维空间结构。
其中冷冻电子显微镜成像技术获得了2017年的诺贝尔化学奖。这种方法是在低温条件下利用电子显微镜对蛋白质进行拍照,这样就可以获得蛋白质在各个方向上的照片,之后通过精巧的重构计算,人类就能“看清”蛋白质的三维结构了。
历史最悠久的是X-ray单晶衍射技术。蛋白质和氯化钠等小分子一样,在溶液过饱和的时候就有机会从液相中析出,并且在适宜的外部条件下,析出的蛋白质会和氯化钠一样,产生一个个晶莹剔透的晶体。之后,用X射线照射晶体,晶体会对X射线产生衍射作用,如果用探测器收集这些衍射出来的射线就可以得到一幅衍射图像。这个图像中的衍射点位置与强度包含了晶体中蛋白质三维结构的信息。通过计算机进行计算,人类就可以破解衍射图像的信息,最终获得蛋白质的三维结构。虽然X射线晶体学已经非常成熟可靠,但是它需要实验人员合成出适宜的蛋白质晶体,进而找到蛋白质结晶所需要的特殊条件,而这个过程需要研究人员不懈的努力,当然,运气也很重要。
特效药的研制
前面已经谈到,主蛋白酶是我的一个弱点。但是研究人员如何设计和发现针对主蛋白酶的抑制剂呢?如果把我的主蛋白酶比作一把锁,那么人类通过解析蛋白质结构就能了解这把锁的精确构造。而设计抑制剂就像是给这把锁配“钥匙”,当了解这把锁的构造以后,就有可能配出一把特殊的钥匙(即靶向性化合物)。如果这个化合物能够特异性地结合到我的主蛋白酶上并使其失活,就有可能发现针对我的特效药。
人类现在设计药物时主要有3种策略:从头设计、计算机虚拟筛选和高通量实验筛选。从头设计主要是基于结构进行全新的小分子设计和开发;计算机虚拟筛选是通过将已知结构的蛋白与药物进行分子对接(将不同的小分子与主蛋白酶这把锁进行匹配),以评估其是否能结合药物靶点;高通量筛选则是建立一套快速筛选方法,在短时间内对大量药物进行筛选。如果将高通量实验筛选和老药新用相结合,往往会迅速产生有前景的成果。这里的“老药”是指已上市的药物或正在进行临床试验的药物,而“新用”是指发现其新适应证并将其用于疾病治疗。由于不确定新研发药物的各种理化性质,如是否有毒、是否有副作用等,因此需要经过药动学与药代学研究、临床试验等十分复杂且耗时的过程才能最终上市,这需要大量的资金与时间,但如果把“老药”用于新的疾病,由于已经比较明确这些药物的药理学性质、副作用等相关信息,就可以跨过很多新药研发所必需的步骤,在较短时间内开展临床试验。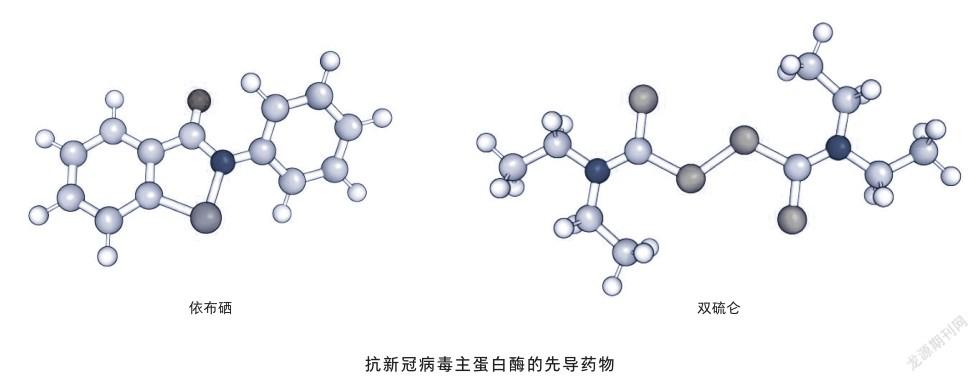
本次疫情中,科学家就结合了这两种筛选方法对10 000多种老药、临床药物以及天然活性产物进行筛选,发现了数种对主蛋白酶和新型冠状病毒有显著抑制作用的先导药物,包括依布硒、双硫仑等,其中依布硒和双硫仑已分别在美国、英国等获批开展临床试验。
如果说计算机虚拟筛选与高通量筛选是“大海捞针”,那从头设计一款药物更像“女娲造人”一样具有创造性。想要从头设计药物首先要在分子层面上对目标蛋白的构造和功能有充分的认识。人类很幸运,他们通过结构解析洞悉了我的主蛋白酶活性位点信息:由第145位的半胱氨酸(Cys)和第41位的组氨酸(His41)组成的催化二体(Cys-His)。其中组氨酸作为质子受体,而半胱氨酸则负责对底物的肽键进行亲核攻击。如果设计出的化合物能模拟蛋白酶的底物,但是在酶催化过程中锁定中间体,就会破坏酶进一步水解的活性,进而产生强烈的抑制效果[2]。同時,主蛋白酶的活性位点附近还有许多氨基酸残基会被药物用来锁定底物结合口袋,在设计药物时人类会根据这些残基设计和优化小分子药物结构,最终获得理想的药物分子。比如迈克尔受体抑制剂N3就是人类利用这种策略设计的抑制剂,而且人类已经解析出了它与主蛋白酶的复合体结构。在这种策略的引导下,恐怕不久后人类就能找到对付我的新办法了[3]。
我可能会卷土重来
在中国,人们通过核酸检测、扫健康码等方式进行精准防疫,一旦发现被我感染的个体,就会被送到医院隔离和诊治。所以当初疫情暴发仅短短几个月的时间,中国的感染人数便完全控制下来,而现在疫苗也开始推广,当全世界都普及接种有效疫苗的时候,我可就无处藏身了。但人类你们也别高兴得太早,一是我有强大的突变能力和适应宿主的能力,所以我会通过自身的变种来逃避疫苗和药物的攻击;二是我在自然界还有很多其他兄弟姐妹,它们一直潜伏在其他动物宿主体内。只要条件成熟,它们也能跨过物种间的屏障,乘虚而入。谁又知道,在未来某个寒冷的季节,我们会不会与人类再次相遇呢?
[1]Ziegler C, Allon S J, Nyquist S K, et al. SARS-CoV-2 receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is enriched in specific cell subsets across tissues. Cell, 2020, 181(5): 1016-1035.
[2]Yang H, Xie W, Xue X, et al. Design of wide-spectrum inhibitors targeting coronavirus main proteases. Plos Biology, 2005, 3(10): 1742-1752.
[3]Yang, H T, Jin Z M, Du X Y, et al. "Structure of Mpro from SARSCoV-2 and discovery of its inhibitors." Nature, 2020, 582(7811): 289–293.
关键词:新冠肺炎病毒 广谱药物 疫苗 结构主要蛋白酶 ■
