药用植物鲨烯环氧酶基因研究进展△
2021-12-01李彤李剑超王晨曲雪洁戚文涛刘长利
李彤,李剑超,王晨,曲雪洁,戚文涛,刘长利
首都医科大学 中医药学院,北京 100069
鲨烯环氧酶(squalene epoxidase,SE 或SQE)属于单加氧酶,又称鲨烯单加氧酶,广泛存在于人参、雷公藤等多种药用植物中。SE 催化角鲨烯发生环氧化反应生成2,3-氧化鲨烯,2,3-氧化鲨烯经过羟基化、糖基化、环化作用等修饰后得到三萜及植物甾醇,生物合成过程见图1。SE 被认为是三萜皂苷、甾体皂苷等中药活性成分生物合成途径中重要的调控酶。近年来,次生代谢物质的生物合成途径已有较为深入的研究,其中的关键酶基因受到广泛关注,多种植物的SE基因被成功克隆挖掘,并进行功能研究[1]。本文对药用植物鲨烯环氧酶基因的克隆提取材料、生物信息学分析、组织特异性、茉莉酸甲酯(MeJA)诱导调控、亚细胞定位、基因功能分析几方面予以综述,为药用植物中鲨烯环氧酶基因的相关研究提供参考。
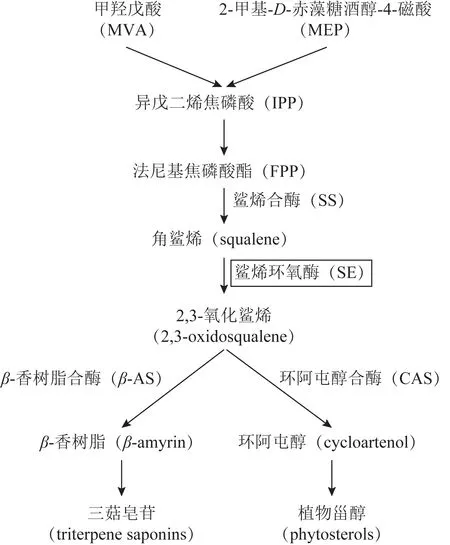
图1 三萜皂苷与植物甾醇在植物体内的生物合成途径
1 SE基因克隆提取材料与生物信息学分析
1.1 SE基因克隆提取材料
基因克隆的结果受提取材料影响。同一植物不同的组织器官,因其化学成分和含量的不同,克隆的难易与质量也会存在差异。通常,药用部位是基因克隆首选的采样部位。相关研究分别从滇重楼根、绞股蓝叶片、罗汉果果实、桑黄、牛樟芝等菌类的菌丝克隆获得相应的SE基因[2-7]。
另外,离体培养的植物细胞和器官同样是理想的提取材料。Han等[8]从人参叶片中克隆获得2条SE基因的全长cDNA 序列;祝传书等[9]从雷公藤发状根中克隆得到TwSE1、TwSE2;Liu 等[10]从雷公藤悬浮细胞中克隆得TwSQE6和TwSQE7;尤鹏升等[11]从刺五加叶片中克隆获得刺五加SE 基因;Gao 等[12]从北柴胡毛状根中克隆获得BcSE1。这些部位作为采样部位,与叶片、根组织等相比,易于提取和纯化核糖核酸(RNA)。
1.2 SE基因生物信息学分析
生物体内,SE 常多于1 条[13],如拟南芥中已经克隆得到6条SE基因。SE氨基酸序列结构和理化性质有一定程度的差异与相似点,多具有跨膜结构域及功能结合域。编码约500 个氨基酸,跨膜结构域数目0~6 个,具有黄素腺嘌呤二核苷酸(FAD)结合位点,多为碱性疏水蛋白[14]。表1是部分已报道的药用植物SE基因克隆结果。

表1 药用植物SE基因的生物信息学数据
N 端差异普遍存在于同一物种不同的SE 基因中。PgSE1与PgSE2具有83%同源性,N 端有很大的差异,前60 个氨基酸的同源性仅为23%[8]。龙月红等[23]克隆获得的2 条刺五加SE 基因cDNA,两者间同源性高,N 端特异性较高。N 端差异可能是造成SE不同功能的原因之一。
2 SE基因组织特异性与MeJA诱导调控
SE 基因组织特异性主要分为2 种,即根中表达水平最高或叶片表达水平最高。综合分析SE的组织表达特异性发现:人参[8]、北柴胡[12]、刺五加[23]、白桦[15]、蓝莓[16]、盾叶薯蓣[17]、紫花苜蓿[18]的SE 基因在叶中表达量显著高于根和茎;滇重楼[2]、雷公藤[10]、枸骨[19]、金铁锁[20]、远志[21]、总序天冬[24]的SE基因在根中表达量显著高于叶和茎;黄芪[25]和银杏[26]的SE在茎中具有高表达量,橡胶草[22]的SE在乳胶中具有高表达量。SE 组织特异性可能与植物内部分泌组织在各个器官中的分布有关。人参在叶片中有丰富的树脂道,可能是人参叶片SE表达量较高的原因。另外,对不同年份人参根中SE基因表达量分析发现[27],1~5 年生的人参中,5 年生人参根中表达水平最高,说明SE基因随药用植物生长年份累积表达水平提高。多数组织特异性分析仅选择某一确切生长阶段植物研究。然而,在植物不同生长时期分析各植物组织器官的SE表达量、皂苷含量,可以更清晰地阐明SE对皂苷合成、植物生长的影响,后续研究应予以关注。
MeJA是与损伤相关的植物激素和信号分子,可以激发植物防御基因表达。经MeJA 处理后,SE 基因表达普遍出现不同程度的提高。MeJA 处理人参后,PgSQE1在根中的表达增强,但PgSQE2在根中的表达降低[8]。MeJA 处理北柴胡不定根后,BcSE1与β-香树脂合成酶基因(β-AS)的表达量一起上调,而环阿屯醇合酶基因(CAS)表达几乎没有变化[12]。β-AS与三萜类物质合成相关,CAS与甾醇合成相关[28],提示BcSE1可能是催化北柴胡三萜皂苷生物合成的关键酶。利用MeJA 处理刺五加后[23],SE1的表达水平提升显著高于SE2。茉莉酸甲酯诱导后基因表达量提高可以为基因功能提供参考,但不足以确定某条SE的表达对皂苷生物合成的调控功能,SE基因在皂苷生物合成中的具体功能和参与的次生代谢途径还需进一步分析。
3 SE基因的亚细胞定位
在过往研究中,鲨烯环氧酶被认为是一种膜结合蛋白,多定位在内质网膜(ER)上。部分文献报道,SE 定位于非ER 上。研究者构建紫花苜蓿MsSQE瞬时表达载体,在洋葱表皮细胞中表达,融合蛋白只在细胞膜上有微弱的荧光[18]。研究者将橡胶草的TkSQE1与蓝色荧光蛋白Cerulean 分别在N 端及C 端融合[22],观察到C 端TkSQE1 融合蛋白(TkSQE1-Cerulean)定位于ER,N 端TkSQE1 融合蛋白(Cerulean-TkSQE1)未观察到定位。同样地,构建瞬时表达载体,并在洋葱内皮细胞中表达,三七SE主要位于在细胞膜及其周围[29]。SE定位情况与软件预测结果不同,可能是事实如此,也可能是实验方案所限。基因的连接方式,即选择N 端或C 端与荧光蛋白基因融合,很有可能影响蛋白的状态。研究表明,SE 高简并性的N 端编码序列可能影响蛋白质的半衰期;C 端被认为与蛋白跨膜有关[30]。西葫芦SE 研究中,eGFP 与CpSE1 进行N 端融合时,检测不到eGFP-CpSE1 在ER 的荧光,与橡胶草N 端融合蛋白Cerulean-TkSQE1一样未观察到定位;而C端融合蛋白(CpSE1-eGFP)检测到明显的ER 定位[31],在N 端的荧光蛋白基因融合可能干扰了蛋白质的表达。亚细胞定位实验中基因融合位置影响定位结果,实验应将其考虑在内,以明确实验中无荧光定位、荧光定位过于微弱的原因。
4 SE基因功能分析
4.1 SE对皂苷合成的影响
SE 的转录水平影响皂苷的合成。植物SE 对皂苷合成影响的研究中,常构建基因干扰载体或过表达载体等,并进行遗传转化,得到转基因株系,从而对皂苷含量进行分析。
灵芝中SE 过表达可增加灵芝酸的合成,含量是野生型的2 倍[32]。刘天巍等[33]构建人参SE 基因RNA干扰(RNAi)载体,农杆菌介导转化人参愈伤组织,转化的人参愈伤组织中Rg1、Rc、Re单体皂苷含量都大幅下降。Han 等[8]构建PgSQE1-RNAi 的人参植株,转基因组人参皂苷积累明显减少,证明PgSQE1作用于人参皂苷生物合成。刘天巍与Han的研究均证明了SE 对人参皂苷生物合成具有调控作用。康俊梅等[18]在对紫花苜蓿的功能研究中,构建过表达MsSQE1转基因植株,过表达MsSQE1苜蓿与对照植株相比MsSQE1表达水平上调,总皂苷含量也显著增加。在西葫芦研究中用农杆菌侵染法,获得CpSE2转基因毛状根,过表达CpSE2的毛状根与对照组相比,葫芦素E 增加了1.7 倍,提示CpSE2过表达可增加三萜合成[31]。SE 遗传转化研究日益增多,对解析SE功能、皂苷生物合成途径是非常有必要的。
4.2 SE对甾醇合成的影响
甾醇是植物体中不可缺且广泛存在的一类物质,合成过程复杂。SE 普遍存在于植物中,催化甾醇的前体——环氧化鲨烯合成。莱茵绿藻的研究中,使用不同溶度的特比萘芬(1 种SE 抑制剂)处理绿藻细胞,甾醇及叶绿素含量显著降低,特比萘芬剂量增大至150 mg·L-1,细胞漂白褪色,说明SE 在此种藻类甾体合成和细胞存活不可缺少;然而敲除莱茵绿藻CrSQE后,转基因株系的甾醇含量没有显著降低[34]。在橡胶草研究中,研究者构建TkSQE1-RNAi转基因植株,角鲨烯水平增加了27 倍,但2,3-氧化角鲨烯、甾醇和五环三萜的含量均未显著降低[22]。有报道指出,酵母内SE表达存在反馈机制,当终产物耗尽时,SE 将再被合成[35]。亦有报道指出,1 种硅藻Phaeodactylum tricornutum缺乏SE 基因,其甾醇生物合成途径嵌合了真菌与植物的甾体合成途径[36]。残留的SE 活性或基因调控可能使甾醇水平不受SE基因表达影响,也可能存在未知途径进行催化反应,SE对甾醇合成的影响仍需要深入探究。
4.3 SE与其他酶之间的相互作用
SE 催化角鲨烯氧化过程受其他酶的影响。细胞色素P450 氧化还原酶(CPR)是1 种还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)依赖的细胞色素P450 还原酶,有提供电子的作用,参与多种氧化还原反应。在对盾叶薯蓣研究中,研究者以角鲨烯为底物,进行体外酶促实验,色谱图中出现2,3-氧化鲨烯的峰;当反应物中无盾叶薯蓣细胞色素P450 氧化还原酶(DzCPR)或无CPR 蛋白时,即使增加角鲨烯,均无2,3-氧化鲨烯合成[17]。SE和CPR都直接且共同参与了2,3-氧化角鲨烯的催化反应,为SE功能研究展开了新视角,提示次生代谢产物合成中的电子转移反应值得关注。
5 讨论
基因表达是动态过程,存在着皂苷的转移和植物不同生长阶段带来的变化。有学者提出,内质网负责植物油腺细胞中萜类化合物的运输和(或)合成[37]。组织特异性分析中,SE 在叶片中常表现较高的转录水平,表明可能叶片是合成2,3-氧化角鲨烯的主要器官。有报道指出,根茎是皂苷积累的主要器官[38]。可以推测皂苷及其前体主要在叶片中合成,并转移到根茎中储存。而在橡胶草的SE组织特异性表达研究中,12 周和16 周龄植物中出现SE 表达高峰;短角蒲公英研究中也呈现在16 周多种酶基因表达高峰这一情况[39]。可能是由于胶质细胞的快速生长或根体积的快速扩张所致,这一时期植物快速生长对膜固醇的需求增加,SE基因表达量也会增加。
SE 表达与三萜合成之间呈正相关关系。另外,SE 与植物生长也有密切联系,如SE 促进种子萌发[24],沉默SE 将影响根的伸长及生长[40]。随着基因克隆技术日渐成熟,克隆基因的难度降低。确定基因是否对三萜的生物合成具有调控作用,进行三萜皂苷合成中SE的功能分析,常用基因沉默技术筛选出与三萜合成相关的基因。然而植物中SE为多基因家族,SE 基因催化作用存在多样性。为提高三萜皂苷合成量,沉默非目标产物合成途径上的基因可能对植株的正常生长造成影响,造成根系发育不良等情况,研究应予以关注。
随着科技的发展和人类认识的进步,各个学科领域之间交融互进,分子生物学应用也越来越广泛。深入了解次生代谢物质生物合成的各个步骤,解析有效成分次生代谢途径,对缓解药用植物资源紧张,促进药用植物经济的发展有重要作用。本文概述药用植物SE 基因的研究进展,为其他药用植物SE 基因的克隆与表达分析研究提供参考。
