清血消脂方对小鼠银屑病合并脂代谢紊乱模型的干预作用
2021-11-30张蕾李萍刘卫红林燕解欣然
张蕾,李萍,刘卫红,林燕,解欣然
(首都医科大学附属北京中医医院北京市中医研究所,北京 100010)
针对银屑病的治疗不再局限于皮肤,而需考虑系统性治疗。其中,银屑病合并脂代谢紊乱最为普遍,主要表现为总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)和低密度脂蛋白(low-density lipoprotein,LDL)水平升高,高密度脂蛋白(high-density lipoprotein,HDL)组分降低[1];皮损处也表现为脂类代谢异常[2]。脂代谢紊乱是代谢综合征、糖尿病、动脉粥样硬化等心血管疾病发生、发展的基础,影响疾病的发展和预后。清血消脂方是北京中医医院名老中医黄丽娟教授用于治疗高脂血症和动脉粥样硬化的有效中药复方,实验研究表明能够降低高脂血症动物模型的脂代谢紊乱,抑制小鼠的代谢性炎症反应[3]。临床研究也表明清血消脂方能改善患者脂代谢紊乱[4-5]。笔者采用咪喹莫特诱导载脂蛋白E(apolipoprotein E,ApoE)敲除小鼠模拟高脂状态基础上的银屑病,进行银屑病合并脂代谢紊乱的病理机制和药物研究[6]。本文尝试将清血消脂方作用于咪喹莫特诱导ApoE-/-小鼠模型,观察其对银屑病合并脂代谢紊乱的影响,为临床治疗银屑病合并症提供新的思路。
1 材料与方法
1.1实验动物 雄性ApoE-/-小鼠24只,28周龄;雄性C57BL/6J小鼠8只,28周龄。小鼠均购自北京华阜康生物技术股份有限公司,实验动物生产许可证号:SCXK(京)2014-0004。饲养条件为:室温18~22 ℃,相对湿度50%~60%,昼夜12 h交替照明。动物实验处理均严格遵守美国国立卫生研究院颁布的《实验动物饲养管理和使用手册》(NIH Publication No.85-23,1996),并遵循动物福利原则及首都医科大学附属北京中医医院实验动物伦理委员会的要求。
1.2药物和试剂 清血消脂方(虎杖15 g、大黄10 g、蒲黄10 g、姜黄10 g、泽泻15 g、萆薢10 g、茵陈15 g、白术12 g、石菖蒲10 g、红花5 g),以上中药饮片由首都医科大学附属北京中医医院药学部提供,制备为水煎液。实验剂量根据临床等效剂量换算为生药计量22.4 g·kg-1,按10 mL·kg-1灌胃[7]。阿托伐他汀钙片(辉瑞制药有限公司,批号:DE7888);用0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC)溶液配制,按10 mg·kg-1灌胃;咪喹莫特乳膏(四川明欣药业有限责任公司,批号:18080439);戊巴比妥钠(美国Sigma公司,批号:018K0754);苏木精-伊红(HE)染色试剂盒(德国Leica公司,批号:120216);增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)兔单克隆抗体(美国Cell Signaling Technology公司,批号:REV08/16/16);Involucrin兔多克隆抗体、凝素样氧化低密度脂蛋白受体-1(lectin like oxLDL receptor-1,LOX-1)兔多克隆抗体(美国Abcam公司,批号分别为GRB7751-24,GR225261-17);FITC anti-mouse CD4,APC anti-mouse IFN-γ,PE anti-mouse IL-17A,Cell Stimulation Cocktail等(美国Affymetrix eBioscience公司,批号分别为2037887,193640,2023658,200547);Mouse/Rat Soluble Protein Master Buffer Kit、IL-17A、IL-17F、IL-6、IL-12/IL-23p40(美国Becton,Dickinson公司,批号:93746);Dupint NEN TSA-Indirect Tyramide Signal Amplification Kit (美国Dupint公司,批号:1798654);TRIzol试剂(美国Invitrogen公司,批号:235005);PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR®Premix Ex TaqTMⅡ (Tli RNaseH Plus)、DL2000 DNA Marker[宝生物工程(大连)有限公司,批号分别为AK4102、AK5504、A2301A];引物由美国Invitrogen公司合成。
1.3主要仪器 3-18K型低温高速离心机(德国希格玛实验室离心机公司);ASP6025全自动真空组织脱水机、EG1150H石蜡包埋机、RM2255全自动轮转切片机、全自动染色机及Aperio CS2台式玻片扫描仪(德国Leica公司);Cobas C601全自动生化分析仪(瑞士罗氏公司);FACSVerse流式细胞仪(美国Becton,Dickinson and Company公司);LSM780激光共聚焦显微镜(德国Zeiss公司);ABI 7500荧光定量PCR仪(美国应用生物系统公司);Multiskan Spectrum全波长酶联免疫测定仪(美国赛默飞世尔科技公司)等。
1.4动物模型的建立及实验分组 小鼠适应1周后开始进行实验。实验分为4组:正常对照组(C57BL/6J小鼠)、模型对照组(ApoE-/-小鼠)、清血消脂方组(ApoE-/-小鼠)和阿托伐他汀钙组(ApoE-/-小鼠),每组8只。清血消脂方组(22.4 g·kg-1)和阿托伐他汀钙组(10 mg·kg-1),按10 mL·kg-1灌胃给药。3周后,全部小鼠用戊巴比妥钠腹腔注射麻醉(80 mg·kg-1),背部去毛后单笼饲养。次日给予全部ApoE-/-小鼠均匀涂抹5%咪喹莫特乳膏62.5 mg,同时给予相应药物;正常对照组C57BL/6J小鼠涂抹等量凡士林,正常对照组和模型组灌胃等量纯水,连续5 d。
1.5检测指标和方法
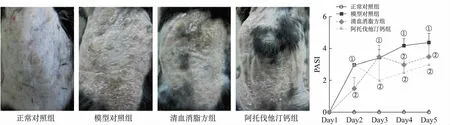
1.5.1小鼠银屑病样皮损面积和疾病严重程度(psoriasis area and severity index,PASI)评分 每天观察小鼠皮损情况,并采用数码照相,依据PASI评分标准,给予小鼠皮损处红斑、鳞屑及浸润程度(0:无;1:轻度;2:中度;3:重度;4:极重度)打分,将三者积分相加得到总积分,取平均值后绘制趋势线,观察各组小鼠皮损的变化情况。
1.5.2小鼠皮损组织病理学变化 将小鼠用戊巴比妥钠注射处死后,剪取皮损处皮肤,每组3只,浸没于10%甲醛溶液中,固定48 h;常规脱水、包埋、切片、HE染色,用中性树胶封片。Leica玻片扫描仪扫描并获取图像(20倍),每个标本选视野4个,采用 Image-Pro Plus 6.0图像分析系统测量表皮厚度。
1.5.3小鼠皮损Involucrin、PCNA和LOX-1的表达 选取皮肤组织蜡块,每组3只,切片,使用Dupont NEN TSA-Indirect Tyramide Signal Amplification Kit,具体操作按说明书进行[8]。依次脱蜡、封闭、一抗孵育,抗体稀释浓度:外皮蛋白(Involucrin)1:1500、PCNA 1:2500、LOX-1 1:1500,4 ℃孵育过夜;HRP标记的猪抗兔IgG 室温孵育30min;Biotinyl Tyramide室温孵育10 min;Treptavidin fluorescence 37 ℃孵育10 min;防淬灭封片剂封片。Zeiss激光共聚焦显微镜下(20倍物镜)摄像,波长分别为405,490,647,550 nm,原位合并图像。
1.5.4小鼠血脂水平 将小鼠麻醉后眼球取血,每组8只,1123×g,离心10 min,取血清,-80℃冰箱保存。全自动生化分析仪检测TC、TG、LDL、HDL水平,具体操作按试剂盒说明书进行。
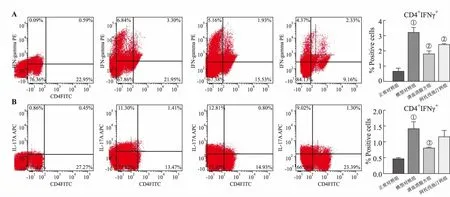
1.5.5小鼠脾脏Th1/Th17细胞计数 选取小鼠脾脏,每组4只,制备为单细胞悬液,加细胞混合刺激剂(PMA+Iionomysin+BFA),37 ℃、5%二氧化碳(CO2)培养箱孵育4 h;加入CD4-FITC抗体,室温避光反应20 min;固定后加破膜剂,加干扰素-γ(interferon-γ,IFN-γ)和 IL-17A抗体,室温避光反应30 min;清洗后加PBS重悬混匀进行流式细胞分析。
1.5.6小鼠血清中炎症细胞因子水平 采用流式微珠阵列(cytometric bead array,CBA)法检测小鼠血清中IL-17A、IL-17F、IL-12/IL-23p40和IL-6含量,每组6只,具体操作按试剂说明书进行,使用FCAP Array software进行数据分析。
1.5.7小鼠皮损中炎症细胞因子基因表达 采用realtime PCR法检测小鼠皮损中炎症细胞因子IL-17A、IL-17F、IL-23和IL-6的mRNA表达。TRIzol法提取小鼠皮肤总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser进行cDNA反转录。PCR反应扩增程序为:前处理95 ℃ 30 s,(扩增95 ℃,5 s,退火60 ℃,40 s)×45个循环,每个样本重复3次。结果以β-actin为内参基因,采用2-△△Ct法进行数据的相对定量分析。引物序列见表1。
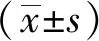
2 结果
2.1小鼠皮损和PASI评分 咪喹莫特外涂于小鼠背部皮肤5 d后,模型对照组小鼠背部皮损增厚、浸润显著,大量斑块状鳞屑,皮色红。清血消脂方组小鼠皮损红斑和鳞屑明显减少,浸润减轻。模型对照组小鼠PASI评分随天数持续增高,清血消脂方组第3天开始明显降低(图1)。

表1 引物序列
2.2小鼠皮损病理形态和表皮厚度 显微镜下观察可见正常对照组小鼠皮肤结构完整,表皮层薄,仅1~2层。模型对照组小鼠表皮层明显增厚,出现角化不全和角化过度,真皮炎症细胞浸润。清血消脂方组小鼠表皮层结构较平整,角化不全明显减轻,表皮厚度减少(图2)。采用图像分析软件测量小鼠表皮厚度,与正常对照组比较,模型对照组小鼠表皮层明显增厚(P<0.05);与模型对照组比较,清血消脂方组小鼠皮肤组织表皮厚度明显降低(P<0.05)(图3)。
2.3小鼠表皮增殖、分化和脂质堆积指标 采用免疫荧光染色法观察小鼠Involucrin、PCNA和LOX-1的表达。正常对照组小鼠表皮层薄,Involucrin(红色)和PCNA(绿色)表达不明显,LOX-1(绿色)少量表达;模型对照组表皮层明显增厚,Involucrin表达显著,基底层PCNA表达数量显著增多,表皮和真皮层均可见LOX-1阳性表达。清血消脂方组小鼠Involucrin表达略有减少,PCNA和LOX-1表达明显降低(图4)。
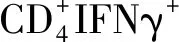
2.5小鼠血脂水平 与正常对照组比较,模型对照组小鼠TC、TG、HDL和LDL明显高于正常对照组(P<0.05)。清血消脂方可显著降低TG,升高HDL和LDL水平,其作用趋势与阿托伐他汀钙相一致,见表2。
①与正常对照组比较,t=8.837 8~21.213 4,P<0.05;②与模型对照组比较,t=0.196 5~8.018 0,P<0.05。

图2 4组小鼠皮肤组织病理变化(HE,×200)
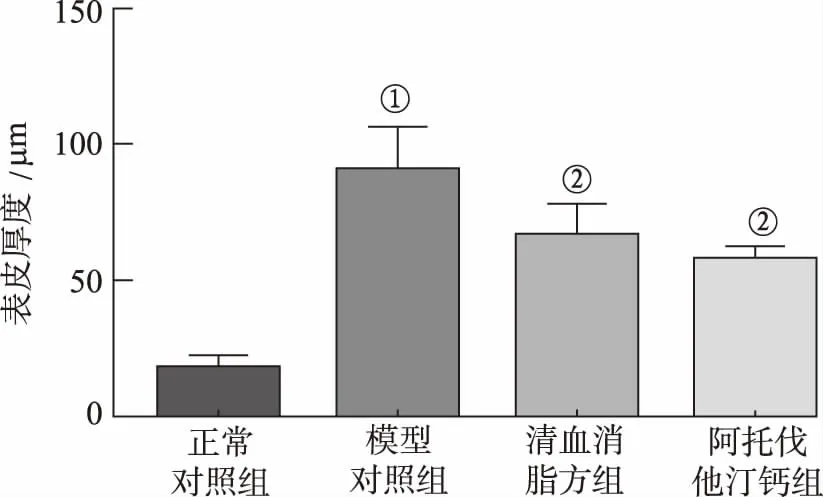
①与正常对照组比较,t=21.136 9,P<0.05;②与模型对照组比较,t=5.266 5,6.050 4,P<0.05。
2.6小鼠血清炎症因子水平 与正常对照组比较,模型对照组小鼠血清中IL-17A、IL-17F、IL-12/IL-23p40和IL-6显著升高(P<0.05)。清血消脂方对IL-17F有一定的抑制作用(P<0.05),见表3。
2.7小鼠皮损炎症因子基因表达 与正常对照组比较,模型对照组小鼠血清中IL-17A、IL-17F、IL-23和IL-6 mRNA表达显著升高(P<0.05)。清血消脂方可抑制炎症因子IL-17A、IL-23和IL-6基因表达(P<0.05),见表4。
3 讨论
“异病同治”是中医辨证论治理论中的基本治则,即不同的疾病在其发展过程中出现相同的病机可采用同一方法治疗。近年来,基于“湿邪内生”“从湿论治”提出银屑病具有“内湿外燥,燥湿互化”的病机特点[9]。“湿”邪贯穿于疾病的始终,燥湿、血瘀、热毒三者互结是银屑病的基本病机。脂代谢紊乱属于“痰浊”范畴,“痰瘀互结”、“中满内热”是脂代谢紊乱的主要病机[10-12]。银屑病和脂代谢紊乱的病机中都包含“(痰)湿”这一病机,(痰)湿、热毒、瘀血既是疾病产生的病理产物,又是致病因素。病邪蕴积体内,痹阻血脉,为痰饮,为血瘀,甚则胸痹;溢于皮之络脉,则为白疕。由此,从中医学角度阐释银屑病和脂代谢紊乱具有相同的病机,并在同一机体中同时出现,可采用“异病同治”的治则。
清血消脂方中虎杖利湿散瘀,大黄通腑降浊、活血祛瘀,使浊气下行清气上升,为君药。蒲黄、姜黄行气活血,助虎杖、大黄活血之力,消其苦寒之弊,茵陈、泽泻、萆薢利湿浊、化痰饮,为臣药。佐以白术、石菖蒲化湿和胃,开窍醒脾。红花为使药,引诸药之力祛除血脉之瘀滞。诸药合用,活血消瘀,祛湿化浊,通腑泄热。清血消脂方临床等效剂量可降低ApoE-/-小鼠体内血脂水平,抑制小鼠血清及脂肪细胞炎症因子IL-6、MIP-1和MCP-1α表达水平,并通过调控核转录因子(nuclear transcription factor,NF)-κB和过氧化物酶体增殖剂激活受体(peroxisome proliferators-activated receptors,PPAR)-γ受体,抑制炎症反应[5]。清血消脂方可抑制ApoE-/-小鼠肝脏和巨噬细胞源泡沫细胞内清道夫受体CD36(cluster of differentiation 36,CD36)、清道夫受体A(scavenger receptor A,SR-A) mRNA和蛋白的表达,减少巨噬细胞内胆固醇的摄入,抑制泡沫细胞的形成[13];清血消脂方能够干预ApoE-/-小鼠动脉粥样硬化模型的糖脂类代谢[14]。
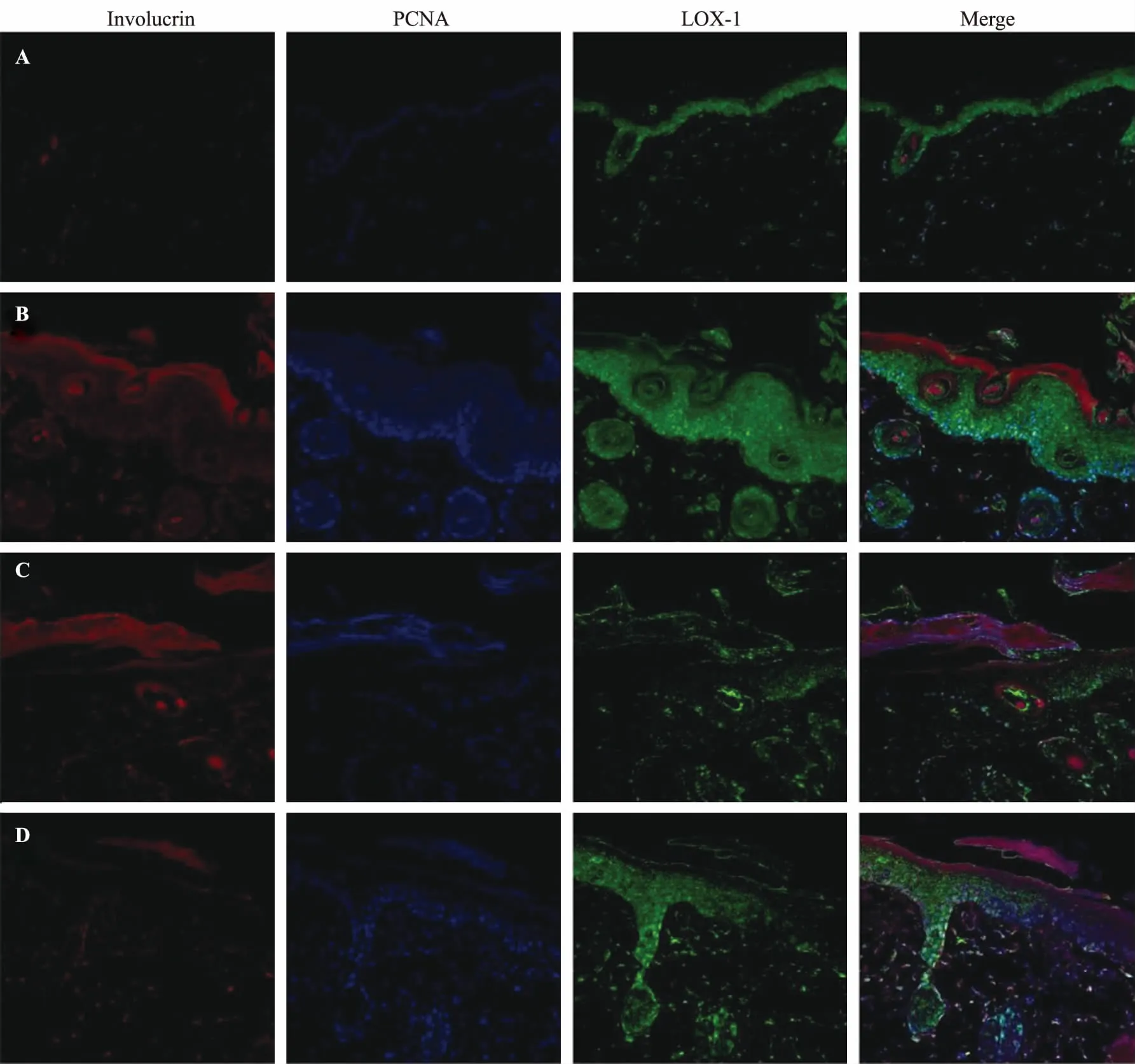
A.正常对照组;B.模型对照组;C.清血消脂方组;D.阿托伐他汀钙组。
清血消脂方可显著改善咪喹莫特诱导ApoE-/-小鼠银屑病样皮损,鳞屑和红斑减少、浸润减轻,表皮厚度变薄,并抑制表皮基底层细胞增殖(PCNA)、角化不全(Involucrin),减少表皮脂质堆积(LOX-1),降低PASI评分。PCNA是真核细胞DNA合成所需的核蛋白,在G1期逐渐增加,S期达到高峰,G2/M期减少,可反映细胞的增殖活性[15]。模型组小鼠角化不全明显升高,而清血消脂方对其有明显降低作用。LOX-1是血管内皮细胞oxLDL的主要受体,模型组小鼠皮损中表现出脂质聚积,与银屑病患者皮损存在脂质代谢异常的报道一致[1]。清血消脂方能够明显抑制LOX-1表达,减少皮肤的脂质堆积。清血消脂方降低TG水平、升高HDL组分,与阿托伐他汀钙作用结果一致。TG水平主要受饮食影响,所以普通饲料饲养的复合模型小鼠TG升高不明显,但在连续4周灌服中药后,观察到清血消脂方对降低TG的作用。应用脂质检测技术证明,降低银屑病患者HDL胆固醇外排能力(cholesterol efflux capacity,CEC) 有利于调节血脂水平[16]。因此,清血消脂方降低TG、升高HDL可抑制脂代谢紊乱向动脉粥样硬化的发展。
①与正常对照组比较,t=14.748 9,8.639 9,P<0.05;②与模型对照组比较,t=1.929 2~6.134 2,P<0.05。
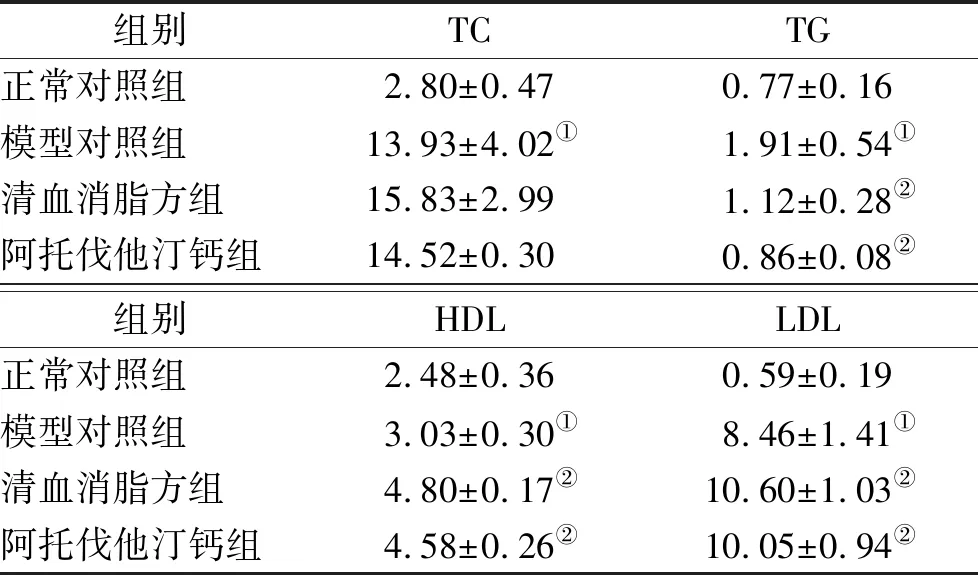
表2 四组小鼠血脂水平
银屑病和脂代谢紊乱都伴有炎症细胞的激活和炎症细胞因子的升高。银屑病被认为是Th1/Th17/Th22细胞亚群自身免疫性疾病,IL-23/Th17轴起主导作用[17]。咪喹莫特诱导ApoE-/-小鼠复合模型表现出系统性和局部皮损的IL-23/Th17轴激活,表现为皮肤、脾脏和血清中相关免疫细胞和炎症因子的升高,与咪喹莫特对BALB/c小鼠的免疫发病机制一致[6,18]。炎症因子如IL-17A升高可促进细胞内胆固醇升高,进入循环导致血液胆固醇水平升高,这可能是银屑病患者发生脂代谢紊乱的原因[19]。文献报道,他汀类药物有益于银屑病的治疗可能通过抑制IL-17A信号途径[20]。

表3 4组小鼠血清炎症因子水平

表4 4组小鼠皮损炎症因子mRNA表达
清血消脂方可显著降低小鼠脾脏Th1和Th17细胞计数(P<0.05),抑制皮损中炎症因子IL-17A、IL-23和IL-6的基因表达;同时对血清中炎症因子IL-17F水平有一定的抑制作用。因此,清血消脂方可通过抑制IL-23/Th17轴发挥对银屑病的干预作用。
综上所述,清血消脂方能够明显改善咪喹莫特诱导ApoE-/-小鼠银屑病样皮损,减少鳞屑和红斑,降低PASI评分,抑制表皮细胞增殖、角化不全,减少表皮脂质堆积;调节血脂水平;抑制局部皮肤和全身IL-23/Th17轴激活。因此,清血消脂方通过抑制IL-23/Th17轴改善银屑病样皮损,从而发挥对银屑病合并脂代谢紊乱的干预作用。此外,本研究提示调节脂代谢紊乱也可能作为治疗银屑病的一个新的有效策略。
