基于石墨烯量子点/铜-金属有机框架构建关-开型电化学发光传感器
2021-11-29张效伟刘尊年
张效伟,刘尊年
(青岛理工大学理学院 ,山东青岛 266033)
0 引言
生物传感器具有选择性高、操作简单、分析速度快等特点而受到广泛关注。根据换能方式不同,生物传感器主要有光学传感器[1]、压电传感器[2]、电化学传感器[3-4]等。电化学发光传感器具有灵敏度高、制作简单、易于微型化等优点已经成为国内外研究的热点。石墨烯量子点作为一种新兴的纳米材料具有独特的光学性能和尺寸效应[5],在光学和电化学传感[6-7]、光催化[8]等领域具有重要应用。但由于石墨烯量子点的量子产率低[9-10],限制了其在微分析中的应用。掺杂型石墨烯量子点可以有效优化原有碳元素的电子特性和化学特性[11],提高荧光量子产率,放大生物传感中的电化学信号[12]。D. Qu等报道了一种水热法合成了氮硫掺杂石墨烯量子点(NS-GQDs),量子产率高达71%[13]。S. H. Li等利用硫掺杂的石墨烯量子点构建了高选择性的荧光传感器用于Fe3+的检测[14]。然而,目前关于NS-GQDs的研究主要集中在荧光、光催化和光致发光方面[15],对它们电化学发光(ECL)性质的研究和应用较少。
金属有机框架(MOFs)材料是由金属离子和有机物组装成的三维网状多孔材料,具有比表面积大、孔隙率高和较多不饱和金属结合位点等独特性能,在气体储存、生物医学、电化学等领域显示出良好的应用潜力[16]。MOFs的多孔结构使分子更容易扩散,加快反应过程中的电子传递[17],使MOFs可以用来提高电化学传感器的效率。L. Cui等制备了DNA修饰铁卟啉金属有机框架电化学传感器,实现对铅离子具有高选择性检测[18]。K. Liang等利用MOF材料作为仿生矿化的保护涂层,很好地固定并保护了生物分子的稳定性[19]。石墨烯量子点在导电性、机械性能及电化学性能方面具有独特的优势,将石墨烯量子点与MOFs结合来修饰电极,将会促进电极表面与反应物之间的电子传递,加快反应进程,提高检测灵敏度。本文首先合成了导电性好、电化学发光(ECL)强度高、光稳定性好的NS-GQDs并组装到金电极上,然后合成了铜-金属有机框架(Cu-MOFs)材料,基于Cu-MOFs上的金属活性位点Cu(II)与NS-GQDs的表面基团氨基相互作用使量子点的发光信号关闭、多巴胺与结合于量子点表面的Cu-MOFs发生电子转移反应将Cu-MOFs从量子点表面移除而使量子点的发光信号重新打开,构建了关-开型ECL传感器用于多巴胺的高灵敏检测。
1 传感器的制备
1.1 试剂
多巴胺(DA)、硫脲(Thiourea)、柠檬酸(CA);1,3,5-苯三甲酸(H3BTC)、N,N-二甲基甲酰胺(DMF,99.5%)、乙醇、硝酸铜、三羟甲基氨基甲烷(Tris)、盐酸(HCl)。
1.2 氮硫掺杂石墨烯量子点和铜-金属有机框架的制备
氮硫掺杂石墨烯量子点制备过程如下。如图1(a)所示,在10 mL四氟乙烯杯中加入0.20 g柠檬酸、0.30 g硫脲和8.0 mL DMF,超声20 min,转入不锈钢反应釜中,密封,于烘箱中180 ℃反应8 h,冷却,乙醇洗涤,然后用截留分子量为1 000 Da的透析袋纯化处理24 h,烘干。
铜-金属有机框架制备过程如下。如图1(b)所示,30 mL四氟乙烯杯中加入2.0 g硝酸铜、1.0 g H3BTC、8.0 mL水、8.0 mL DMF和8.0 mL乙醇,超声20 min,转入不锈钢反应釜中,密封,烘箱中100 ℃反应10 h,冷却,去除母液,得到蓝色晶体,分别用乙醇和DMF洗涤3次,烘干。
1.3 传感器的制备

(a)氮硫掺杂石墨烯量子点的制备过程

(b)铜-金属有机框架制备过程图1 2种不同纳米材料的制备过程
传感器的制备及检测系统如图2所示。将金电极(工作电极)用三氧化二铝抛光粉在抛光布上抛光,达到镜面效果之后,然后分别用乙醇和超纯水超声清洗,晾干。取10 μL上述石墨烯量子点滴涂到工作电极表面,晾干,如图2(a)过程A所示。再取10 μL铜-金属有机框架滴涂到工作电极表面,晾干,如图2(a)过程B所示。即可将氮硫掺杂石墨烯量子点和铜-金属有机框架有序组装到金电极上。在工作电极未组装NS-GQDs和Cu-MOFs的部位套上密封圈,装入检测池中,再将铂丝辅助电极、甘汞参比电极分别安装至检测池中构成三电极系统,如图2(b)所示。将三电极分别与信号处理器对应的3根电极线连接,构成传感器系统,如图2(c)所示,连接好高压电源输出接口与传感器系统高压输入接口的连线,连接好传感器信号输出接口与数据处理器信号输入接口的连线,连接好数据处理器与计算机串行接口之间的通讯电缆,即可进行ECL研究。

(a)工作电极
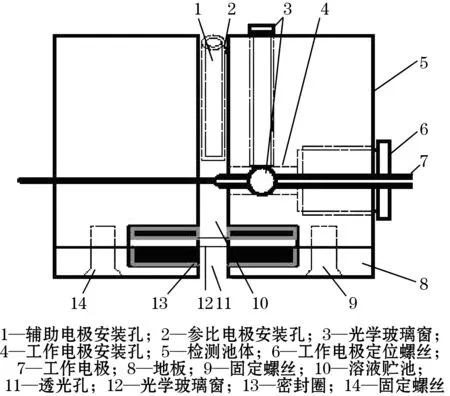
(b)传感器的三电极系统
(c)传感器系统图2 “关-开”型ECL传感器的制备及检测原理示意图
2 “关-开”型ECL传感器的原理
将NS-GQDs组装到工作电极上后,在一定外电压下,NS-GQDs转化为激发态的NS-GQDs*,而激发态的NS-GQDs*跃迁到基态时发出高强度的ECL信号;在工作电极上进一步组装上Cu-MOFs后,由于NS-GQDs的表面含有大量氨基、羟基等基团,与Cu-MOFs表面的Cu(Ⅱ)通过螯合作用结合生成配位聚合物(MOFs-Cu-NS-GQDs)n;这种聚合物在电极进行循环扫描过程中不能生成激发态的NSGQDs*,导致量子点ECL猝灭,发光信号“关闭”;当往检测池中加入多巴胺后,如图2(a)过程C所示,多巴胺与结合于量子点表面的Cu-MOFs中的Cu(Ⅱ)发生电子转移反应,Cu(Ⅱ)被还原为Cu(Ⅰ),导致Cu-MOFs从量子点表面剥离,NS-GQDs的电化学发光得以恢复,发光信号重新“打开”。
3 传感器的表征及性能测试
3.1 铜-金属有机框架的表征
图3为铜-金属有机框架的扫描电镜图,从图3(a)可见,Cu-MOFs的平均粒径在5 μm左右,颗粒分布均匀;图3(b)为Cu-MOFs的高分辨电镜图,单个Cu-MOFs晶体为正八面体结构,晶体表面光滑。

(a)扫描电镜图 (b)高分辨电镜图图3 Cu-MOFs的扫描电子显微镜图
3.2 氮硫掺杂石墨烯量子点的表征
图4(a)为氮硫掺杂石墨烯量子点的透射电镜图,可以看出NS-GQDs的大小均匀,平均粒径在4 nm左右,颗粒分散性好,无团聚。图4(a)右上角为NS-GQDs的高分辨透射电镜图,晶格清晰,晶格间距为0.21 nm,与石墨烯的晶格结构一致[20]。
图4(b)为NS-GQDs的傅里叶红外光谱图,1 750 cm-1、2 100 cm-1和2 750 cm-1处分别是C=O、C≡N和S-H的特征吸收峰,1 000~1 500 cm-1和3 050~3 500 cm-1处的宽吸收带分别是由C-N、C-S和N-H和O-H的伸缩振动引起,说明N和S成功接入到了石墨烯量子点中,量子点表面存在大量的氨基、羟基和羰基等官能团,这使得NS-GQDs具有很好的水溶性,同时也为其与Cu-MOFs结合提供了条件。

(a)透射电镜图
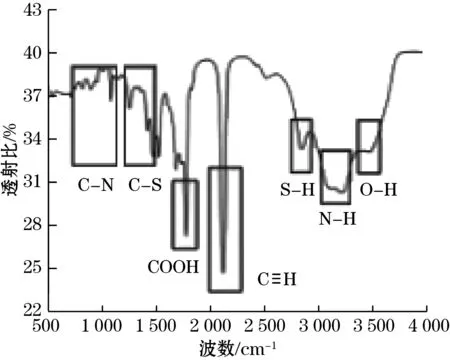
(b)傅里叶红外光谱图图4 氮硫掺杂石墨烯量子点的表征
3.3 传感器的光学特性
分别通过紫外-可见光谱(图5(a))和荧光光谱(图5(b))研究了NS-GQDs与Cu-MOFs、多巴胺之间的相互作用。可以看出,NS-GQDs在460 nm处有一个吸收峰(图5(a)曲线1)和较强的荧光发射(图5(b)曲线1);加入Cu-MOF后,紫外吸收峰明显下降(图5(a)曲线2)、荧光强度明显降低(图5(b)曲线2);加入多巴胺后,紫外吸收(图5(a)曲线3)和荧光信号(图5(b)曲线3)都明显增强。然后研究了它们的ECL性能(图5(c)),将组装了NS-GQDs的金电极放入ECL检测池中,在外电压的作用下,产生很强的ECL信号(图5(c)曲线1),此为NS-GQDs中C=N的n-π*跃迁,NS-GQDs从激发态跃迁到基态时发光;在上述电极上再组装上Cu-MOFs之后,再将电极放入检测池中,ECL信号猝灭(图5(c)曲线2),这是因为NS-GQDs中的氨基与Cu-MOFs中的Cu(Ⅱ)相互作用生成配位聚合物导致ECL猝灭,发光信号关闭;往检测池中加入多巴胺后,多巴胺与Cu(Ⅱ)发生电子转移反应,将Cu(Ⅱ)还原为Cu(Ⅰ),Cu-MOFs从NSGQDs表面移除,ECL强度明显增强(图5(c)曲线3),发光信号打开。
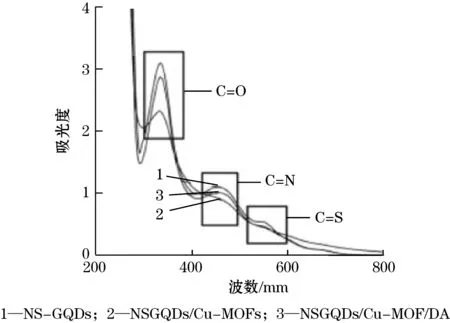
(a)紫外可见光谱图

(b)荧光发射光谱图

(c)电化学发光谱图图5 3种不同体系的光谱图
3.4 传感器的性能研究
3.4.1 传感器稳定性
为了检测传感器的稳定性,利用同一支传感器对1.0 μmol/L的多巴胺连续测定7次,如图6所示,ECL强度的相对标准偏差(RSD)为0.9%。利用同一支传感器分别于1、2、4、6、8、10 d后测定浓度为1.0 μmol/L的多巴胺标准溶液,ECL强度的RSD为5.6%,表明该传感器具有较好的稳定性。
3.4.2 传感器重现性
采用相同的方法制备5支传感器并对多巴胺进行测定,如图7所示,ECL强度的RSD为2.8%,表明该传感器的制备重现性良好。
3.4.3 传感器选择性


图6 传感器稳定性
图7 传感器重现性

图8 传感器选择性
4 实验方法
开始检测前,先确认各部分的电源线已经连接好,将电源插头插入电源插座中。打开电源开关,显示屏被点亮;将多巴胺(或待测样品)和缓冲溶液放入检测池中;然后进行参数设定:初始电位0 V,扫描速率100 mV/s,采样速率10次/s,电压滤波器频率5 kHz,信号滤波器频率5 kHz,光电倍增管高压800 V,发光检测方式为强度方式;盖上传感器的盖子,将体系置于暗箱中进行ECL反应,记录ECL信号的变化值。
5 结果与讨论
5.1 ECL传感器检测条件的优化
首先研究了扫描速率对传感器ECL强度的影响。量子点ECL的发光效率与激发态物质的生成和湮没比率有关,而激发态物质在电极上发生电子转移反应的效果与扫描速率的快慢有关,扫描速率太快或太慢都会导致量子点ECL强度降低。考察了60~150 mV/s范围内的扫描速率对传感器ECL 强度的影响。结果表明,随着扫描速率的增大,ECL强度增大,当扫描速率为100 mV/s时,ECL强度达最大值,继续增大扫描速率,ECL强度逐渐减弱,因此选择扫描速率为100 mV/s。
研究了检测池中溶液的pH对传感器ECL强度的影响,如图9所示,随着pH 的不断增大,ECL强度增大并在pH=7.5时达到最大值,随着pH的继续增加,ECL强度减弱。

图9 溶液pH对ECL强度的影响
5.2 “关-开”型ECL传感器检测多巴胺
为考察新构建的“关-开”型ECL传感器的分析性能,研究了利用该传感器检测多巴胺的工作曲线、线性范围、线性方程和检出限。如图10所示,随着多巴胺浓度(1~50 μmol/L)的增大,传感器的ECL信号升高,测定了多巴胺浓度在0.05~100 μmol/L范围内,其ECL强度与浓度的关系,结果表明,多巴胺浓度在0.05~60 μmol/L范围内,传感器的ECL强度与多巴胺浓度成良好的线性关系,线性回归方程为I=162.8c+34.5(I为传感器的ECL强度,c为多巴胺浓度),线性相关系数R2=0.998 6,线性范围为0.05~60 μmol/L,检出限为62 nmol/L。

图10 “关-开”型ECL传感器在不同浓度多巴胺溶液中的ECL谱图
为验证该传感器的实际应用性和可靠性,对多巴胺注射液进行检测分析,结果如表1所示,回收率在96%~102%之间,表明该传感器准确可靠,可用于实际样品中多巴胺的测定。

表1 多巴胺注射液的检测
6 结束语
本文研究了铜-金属有机框架对氮硫掺杂石墨烯量子点电化学发光信号的关闭作用,构建了新型的“关-开”型电化学发光传感器。基于多巴胺可使量子点被关闭的信号重新打开的现象,实现了对多巴胺的定量检测,方法选择性好、灵敏度高,检出限达62 nmol/L。该研究不仅大大拓展了铜-金属有机框架材料的应用领域,也为多巴胺的快速灵敏检测提供了新思路,在实际样品检测中具有良好的应用前景。
