microRNA-125b通过调控Nrf2/Keap1信号通路影响光感受器细胞氧化应激
2021-11-27刘金霞王钰池郭卓赵江月孔珺秦宇
刘金霞,王钰池,郭卓,赵江月,孔珺,秦宇
(中国医科大学附属第四医院眼科,中国医科大学眼科医院,辽宁省晶状体学重点实验室,沈阳 110005)
年龄相关性黄斑变性(age-related macular degeneration,AMD)是老年人群不可逆转性盲的主要原因之一[1]。AMD分为干性和湿性2种类型,其中,干性AMD占比较多,目前尚无有效治疗手段[2-3]。干性AMD的病理改变以光感受器细胞变性为主[4]。视网膜氧化损伤已被确定为干性AMD的主要致病因素之一,光感受器细胞受到各种来源的氧化应激刺激,导致视网膜退行性变,严重影响视力[5]。
核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是机体发挥抗氧化应激反应的重要转录因子。基础状态下,Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein-1,Keap1)与Nrf2在细胞质中结合,引起Nrf2降解;氧化应激时,Nrf2与Keap1解离,移位入核,与下游基因血红素单加氧酶(heme oxygenase-1,HO-1)结合,发挥抗氧化作用[6-7]。因此,通过激活Nrf2/Keap1信号通路,可增加细胞抗氧化反应能力,减轻细胞氧化损伤[8]。微RNA(microRNA,miRNA)可通过内源性RNA干扰机制抑制多种靶基因的表达,调节各种细胞功能[9]。已有研究[10]证明,多种miRNAs可通过调控Nrf2影响AMD发 病,包 括miR-144[11]、miR-141[12]、miR-626[13]等。但光感受器细胞中miRNAs对Nrf2的调控机制尚未完全明确。本研究通过细胞实验,研究在干性AMD中miR-125b通过Nrf2/Keap1信号通路对光感受器细胞氧化应激反应的调控作用。
1 材料与方法
1.1 材料
小鼠视锥细胞系661W细胞由美国休斯顿大学Muayyad R.AL-UBAIDI教授赠予。DMEM培养液、青链霉素混合液、胰蛋白酶、PBS(中国江苏凯基生物公司),3%过氧化氢(H2O2)溶液、DMSO(美国SIGMA公司),胎牛血清(澳大利亚AusGeneX公司),RNAiso Plus、LipofectamineTMRNAiMAX、OPTI-MEM(美国Invitrogen公司),PrimerScript RT reagent Kit(日本TaKaRa公司)、TB Green premix Ex Taq Ⅱ(日本TaKaRa公司),增强型CCK-8试剂盒(美国Apexbio公司),mRNA引物(中国上海生工生物工程公司),miR-125b与RNU6B的RT引物、PCR引物、miR-125b模拟物、模拟物对照、抑制物、抑制物对照(中国广州锐博公司),SDS-PAGE胶(中国碧云天生物技术有限公司),PCR逆转录仪(美国BIO-RAD公司)。RT-PCR仪(美国AppliedBiosystem公司),荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养:用含5%胎牛血清和1%青链霉素混合液的 DMEM 培养基,于37 ℃、5% CO2的培养箱中,培养 661W细胞。待细胞生长至80%~90%融合后,用0.25%胰蛋白酶进行消化、传代,用于后续实验。
1.2.2 CCK-8试剂盒检测细胞增殖活性:取对数生长期661W细胞消化并离心后,用含5%胎牛血清DMEM 培养基重悬细胞,制成细胞悬液,以每孔2×104细胞接种于96孔板中。用正常培养细胞组作为对照组,用培养基不含细胞组作为空白对照组。用不同浓度H2O2(400,600,800,1 000 μmol/L)处理细胞6 h后,每孔加入10 μL CCK-8溶液,37 ℃培养箱中孵育1 h,用酶标仪检测450 nm 波长处的吸光度值(A)。细胞增殖活性=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.2.3 细胞转染:将661W细胞培养至30%~50%融合。用LipofectamineTMRNAiMAX和无血清Opti-MEM培养基将miR-125b模拟物、模拟物对照(100 nmol/L)和miR-125b 抑制物、抑制物对照(30 nmol/L)分别转染至661W细胞,在37 ℃培养箱中继续培养48 h后,进行后续实验。
1.2.4 实时荧光定量PCR(qPCR)检测:用TRIzol提取各组细胞的总RNA,用反转录试剂盒Primer Script RT reagent Kit反转录为cDNA,qPCR试剂盒TB Green premix Ex Taq Ⅱ检测miR-125b与Keap1/Nrf2/HO-1mRNA的表达水平,RNU6B为miR-125b内参对照,GAPDH为Keap1/Nrf2/HO-1内参对照。所有操作均严格遵循说明书。引物序列见表1。

表1 实时PCR引物序列(5’-3’)Tab.1 Primers for qPCR assay(5’-3’)
1.2.5 Western blotting检测:利用RIPA细胞裂解液提取各组细胞总蛋白,BCA法测定蛋白浓度。95 ℃水浴10 min变性,蛋白上样行SDS-PAGE凝胶电泳。转移至PVDF膜,5%脱脂奶粉室温封闭1 h。用Keap1抗体(1 ∶5 000)4 ℃过夜孵育,GAPDH作为内参对照。将孵育过一抗的PVDF膜用TBST洗3次,10 min/次,用山羊抗兔二抗(1 ∶5 000)室温孵育2 h,TBST 洗膜3次,10 min/次。ECL 发光显影,采用Image J软件分析条带灰度值。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析,用Graph-Pad Prism 8作统计图。所有结果均以表示;采用独立样本t检验和单因素方差分析对结果进行显著性比较,检验水准α=0.05。
2 结果
2.1 661W细胞氧化应激模型中miR-125b与Keap1/Nrf2/HO-1 mRNA的表达
分别利用400、600、800、1 000 μmol/L H2O2处理661W细胞6 h,用CCK-8试剂盒检测细胞活性变化。结果显示,当H2O2浓度为800 μmol/L时,细胞活性降低至50%左右,故后续试验选用800 μmol/L H2O2构建细胞氧化应激模型。qPCR结果显示,与对照组相比,随着H2O2浓度逐渐增加,miR-125b表达逐渐降低。661W细胞氧化应激模型中,Nrf2及其下游基因HO-1mRNA表达升高,Keap1mRNA表达降低,差异均有统计学意义(P< 0.05)。见图1。说明661W细胞受到氧化应激刺激后,miR-125b表达降低,Nrf2及其下游基因HO-1表达水平升高,Keap1表达水平降低。
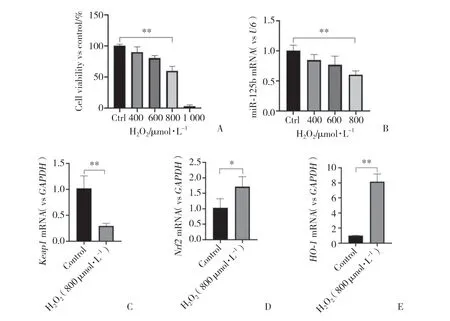
图1 661W细胞氧化应激模型中miR-125b及Keap1/Nrf2/HO-1 mRNA的表达Fig.1 Expression of miR-125b and Keap1/Nrf2/HO-1 mRNA in oxidative stress model of 661W cells
2.2 miR-125b调控661W细胞氧化应激模型中Keap1/Nrf2/HO-1 mRNA的表达
661W细胞氧化应激模型中,转染miR-125b 模拟物组miR-125b、Nrf2和HO-1mRNA的表达显著高于转染模拟物对照组,差异均有统计学意义(P<0.05);转染miR-125b抑制物组miR-125b、Nrf2和HO-1mRNA的表达水平显著低于转染抑制物对照组,差异均有统计学意义(P< 0.05);转染miR-125b 模拟物组和转染miR-125b抑制物组分别与转染模拟物对照组和转染抑制物对照组比较,Keap1表达在mRNA水平无明显变化,见图2。说明miR-125b可能通过调控Nrf2及HO-1mRNA的表达以增强661W细胞抗氧化应激能力,但对Keap1mRNA的表达无明显影响。

图2 调控miR-125b对661W细胞氧化应激模型中Keap1/Nrf2/HO-1 mRNA表达的影响Fig.2 Up-or down-regulating miR-125b affects expression of Keap1/Nrf2/HO-1 mRNA
2.3 miR-125b通过在转录后水平调控Keap1蛋白表达调控Nrf2信号通路
如前所述,661W细胞氧化应激模型中,miR-125b 对Keap1mRNA的表达无明显影响,Western blotting结果显示,转染miR-125b 模拟物组Keap1的蛋白表达水平显著低于转染模拟物对照组;转染miR-125b抑制物组Keap1的蛋白表达水平显著高于转染抑制物对照组,差异均有统计学意义(P< 0.05)。见图3。说明miR-125b可能通过在转录后水平调控Keap1蛋白的表达,调控Nrf2及HO-1的表达,从而促进661W细胞抗氧化应激能力。

图3 调控miR-125b对Keap1蛋白表达水平的影响Fig.3 Up-or down-regulating miR-125b affects expression of Keap1 protein
3 讨论
干性AMD早期病变主要表现为玻璃膜疣形成,玻璃膜疣数目和大小的增加显著增加疾病进展的风险;干性AMD的晚期病变地图状萎缩的形成主要由光感受器和视网膜色素上皮(retinal pigment epithelium,RPE)细胞死亡引起[14]。视网膜由RPE和神经视网膜组成,其生理结构和高代谢活性对视觉功能至关重要,尤其容易受到氧化损伤。视网膜氧化损伤是包括AMD在内的视网膜退行性疾病的主要致病因素之一[15]。
Nrf2信号通路是体内主要的抗氧化信号通路之一,关于miRNAs对该通路的调控目前国内外尚未见明确报道。LAI等[16]发现,虾青素能够通过PI3K/Akt/Nrf2通路减少661W细胞中活性氧的产生,并抑制细胞凋亡。CARLOTTA等[17]发现2-乙酰基-5-四羟基丁基咪唑能够通过激活Nrf2/HO-1通路减轻H2O2诱导的661W细胞的氧化应激反应和细胞凋亡。此外,Nrf2激动剂RS9能够减轻光诱导的661W细胞损伤[18]。miR-125b与细胞增殖、迁移、凋亡和分化等密切相关[19]。YANG等[20]发现,miR-125b通过Keap1/Nrf2通路减轻肝损伤,并利用双荧光素酶报告基因系统验证了miR-125b与Keap1之间存在直接的连接位点,提示了miR-125b对Keap1/Nrf2直接的调控作用。
本研究利用H2O2构建光感受器细胞氧化应激模型,研究在干性AMD发病过程中miR-125b对抗氧化信号通路Keap1/Nrf2/HO-1可能的调控机制。结果显示,与对照组相比,miR-125b在光感受器细胞氧化应激模型中表达显著降低,Nrf2及其下游基因HO-1表达增加,Keap1表达降低,表明当光感受器细胞受到氧化刺激以后,Keap1表达减少,对Nrf2的锚定作用降低,因此Nrf2表达增加且移位入核发挥抗氧化作用。转染miR-125b 模拟物后,Nrf2/HO-1表达增加,Keap1表达在mRNA水平无明显变化,在蛋白水平显著降低,提示miR-125b可能在转录后水平调控Keap1蛋白的表达,进而促进Nrf2/HO-1的表达,从而增强光感受器细胞的抗氧化能力,转染miR-125b抑制物的结果也证明了这一点。然而,miR-125b与Keap1之间的直接靶向关系还需将来进一步验证。
综上所述,miR-125b可促进光感受器细胞的抗氧化应激能力,该作用可能通过调控Keap1/Nrf2/HO-1信号通路实现。本研究利用细胞转染的方法调控miR-125b在光感受器细胞中的表达,初步论证了miR-125b在干性AMD发病过程中的调控作用,提示miR-125b可能成为干性AMD治疗的新靶点。
