不同Calot三角解剖入路腹腔镜胆囊切除术治疗慢性结石性胆囊炎的对比
2021-11-26王小四
王小四
(连云港市赣榆区中医院普外科,江苏 连云港 222100)
胆囊结石患者多合并胆囊炎,主要因结石长时间对胆囊黏膜形成刺激,进而造成黏膜受损,产生炎症。临床目前多通过手术方式切除病灶进行治疗,腹腔镜胆囊切除术为常用术式,其优势在于切口小、伤害低、术后更易恢复[1]。然而少数患者可能出现胆道受损并发症,研发发现与Calot 入路不当相关。人体Calot 三角区域生理结构复杂,入路操作难度高,因此,合理选择入路途径至关重要[2]。本研究选取2017年1 月至2020 年6 月本院收治74 例慢性结石性胆囊炎患者为研究对象,比较分析胆囊三角入路与胆囊后三角入路的差异性,现报道如下。
1 资料与方法
1.1 临床资料 选取2017年1月至2020年6月本院收治慢性结石性胆囊炎患者74 例为研究对象,根据患者自愿选择形式分为两组,每组37 例。对照组男15 例,女22 例;年龄30~68岁,平均(46.5±1.5)岁;其中单发结石28例,多发结石9 例;未出现粘连情况20 例,发生粘连17 例。观察组男16例,女21 例;年龄30~69 岁,平均(46.6±1.4)岁;其中单发结石27例,未多发结石10例;未出现粘连情况19例,发生粘连18 例。两组患者临床资料比较差异无统计学意义,具有可比性。本研究经患者及家属均知情同意并签署知情同意书,研究通过医院伦理委员会批准。
1.2 方法 两组患者均选择腹腔镜下胆囊切除手术治疗,术前协助其正确摆放体外,选择平卧仰卧位,经口腔气管插管式麻醉。待麻醉生效后开展手术,于脐下穿刺点位置放置镂空铺巾,穿刺成功后建立二氧化碳气腹,手术过程中需始终保持气腹压力12~14 mmHg。
1.2.1 观察组 观察组患者采用经胆囊后侧三角解剖的入路方式,以常规腹腔镜三孔操作法开展,在建立气腹后,分别在肚脐两侧麦氏点做操作孔,置入相应配套器械后,利用腹腔镜探查患者腹腔内脏器情况,确认胆囊和周围组织的粘连程度,利用刀具松解粘连组织,并继续分辨胆总管窗、肝韧带、十二指肠韧带等的具体方向,以此作为手术风险的评估标准。找到胆囊壶腹部具体位置后,利用组织钳在其左侧向上方牵拉,并逆时针旋转,确保胆囊后侧的三角区能够充分暴露。使用电凝刀切开胆囊浆膜,以钝性分离的方式切割三角区内的胆囊组织,暴露胆囊管、壶腹部,针对支动脉等特殊部位需小心处理,最终暴露Calot 三角。再使用组织钳向右下方牵拉Calot三角部位,并电切分离浆膜层,使前后两侧三角区穿通,进一步确认胆总管、肝总管、胆囊管的相互关系,并离断胆囊管,彻底开放胆囊三角区,夹闭其中的血管后切除整个胆囊组织。
1.2.2 对照组 对照组患者采用经胆囊三角入路方式,同样以三孔法实施手术,松解胆囊粘连,以腹腔镜确认胆囊三角和肝门,直接经胆囊三角切入完全开放胆囊浆膜层,并顺行完全切除胆囊组织。
两组患者手术完成后需释放腹腔内二氧化碳气体,并以适温生理盐水冲洗腹腔,直至无出血或凝血块,以腹腔镜完全确认后逐层缝合创口,并预留引流管,根据实际恢复情况于手术结束后1~2 d拔除即可。
1.3 观察指标 比较两组患者手术指标。利用VAS 自评法[3]评估患者术后疼痛情况,总分10 分,分数与痛感呈正相关。经免疫比浊法[4]测定患者治疗前后血清C 反应蛋白水平,通过ELISA法[5]测定患者治疗前后白介素-6(IL-6)、白介素-8(IL-8)及肿瘤坏死因子(TNF-α)。比较两组患者术后并发症发生率给手术中转开腹手术发生率。
1.4 统计学方法 采用SPSS 26.0 统计学软件进行数据分析,计量资料以“±s”表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组手术指标比较 两组未发生粘连情况患者手术相应指标比较差异无统计学意义,观察组发生粘连患者手术指标均明显优于对照组(P<0.05),见表1~2。
表1 两组未发生粘连情况患者手术指标比较(±s)
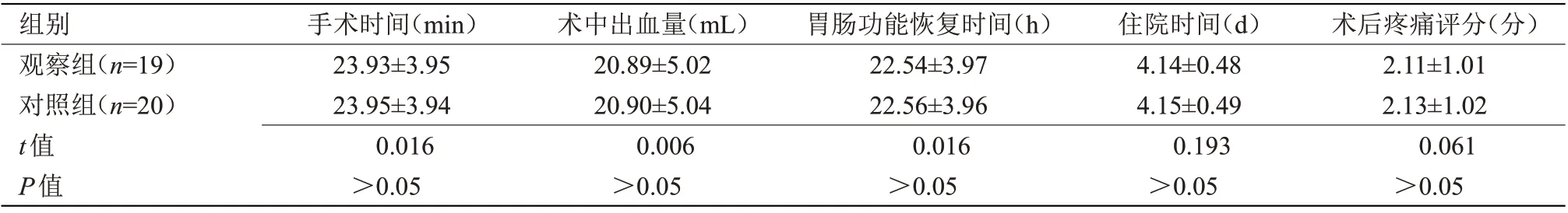
表1 两组未发生粘连情况患者手术指标比较(±s)
组别观察组(n=19)对照组(n=20)t值P值手术时间(min)23.93±3.95 23.95±3.94 0.016>0.05术后疼痛评分(分)2.11±1.01 2.13±1.02 0.061>0.05术中出血量(mL)20.89±5.02 20.90±5.04 0.006>0.05胃肠功能恢复时间(h)22.54±3.97 22.56±3.96 0.016>0.05住院时间(d)4.14±0.48 4.15±0.49 0.193>0.05
2.2 两组治疗前后患者血清因子水平变化比较 治疗前,两组患者血清炎性因子水平比较差异无统计学意义,治疗后,两组CRP、IL-6、IL-8、TNF-α 均高于治疗前,但观察组均低于对照组(P<0.05),见表3。
表2 两组发生粘连情况患者手术指标比较(±s)

表2 两组发生粘连情况患者手术指标比较(±s)
组别观察组(n=18)对照组(n=17)t值P值手术时间(min)29.89±5.59 58.77±5.98 15.560<0.05术后疼痛评分(分)4.12±0.33 5.09±0.34 9.034<0.05术中出血量(mL)32.28±5.65 45.99±5.66 7.568<0.05胃肠功能恢复时间(h)25.77±3.91 30.39±3.92 3.683<0.05住院时间(d)6.15±1.02 8.98±1.03 8.617<0.05

表4 两组并发症发生率、中转开腹率比较
表3 两组治疗前后患者血清炎性因子水平比较(±s)

表3 两组治疗前后患者血清炎性因子水平比较(±s)
注:CRP,血清C反应蛋白;IL-6,白介素-6;IL-8,白介素-8;TNF-α,肿瘤坏死因子
组别观察组(n=37)对照组(n=37)t值P值CRP(mg/L)治疗前5.61±1.03 5.62±1.02 0.042>0.05治疗后19.16±3.39 24.01±3.38 6.163<0.05治疗后12.13±2.24 19.89±2.23 14.934<0.05 IL-6(ng/L)治疗前8.15±1.77 8.16±1.76 0.024>0.05治疗后20.41±5.02 36.25±5.03 13.558<0.05 IL-8(ng/L)治疗前10.19±1.44 10.18±1.46 0.030>0.05治疗后18.39±3.71 24.24±3.72 6.773<0.05 TNF-α(ng/L)治疗前14.55±2.92 14.54±2.93 0.015>0.05
2.3 两组并发症发生、中转开腹率比较 观察组患者并发症发生率及中转开腹率均明显低于对照组(P<0.05),见表4。
3 讨论
腹腔镜下胆囊切除手术的效果直接取决于胆囊管、胆总管、肝总管分辨的准确率和分离的成功率,由于腹腔镜手术属于镜下非接触性操作,主刀医生只能通过镜头影像观察患者胆囊组织结构,加之操作空间有限,导致视觉空间感相对较低。如患者因胆囊结石影响产生胆囊炎症,不仅会使胆囊本身与周围组织形成粘连病灶,还会造成胆囊内Calot 三角区的解剖结构模糊化。如直接选择经三角区入路开展手术,则在分离组织过程中对胆囊管、胆囊血管等造成损伤的发生率较高,使术后内出血类并发症发生率上升,也会造成胆道损伤,二次治疗的难度相对较高。根据国际医学界临床研究指出,腹腔镜下手术患者胆道损伤大多数是由于胆囊三角区解剖不当造成,且50%以上的患者术后出血也与这一问题密切相关[6-7]。因此,为保证腹腔镜下胆囊切除手术的整体预后质量,应选择更加合理的入路方式。
人体解剖学研究显示,胆囊三角主要包含胆囊壶腹部后壁、胆囊管、三角间隙,该区域内分布经肝脏右叶动脉发源的胆囊动脉血管,在分离操作时很易对其造成损伤[8]。传统腹腔镜下胆囊切除手术大多采取“三管一壶腹”的分离方式,虽然操作简便,但受胆囊病变程度、患者自身因素等影响,使术后胆囊损伤发生率居高不下。实际开展手术时,经胆囊后的三角区入路方式更加符合特殊解剖的理念,该三角区位于胆囊尖端向前的位置,其右前界、左前界、后界分别在壶腹部后壁、胆囊管、胆总管等位置,属于胆囊壶腹部和胆囊管的交汇位点,与Calot三角间互相穿通,底部被浆膜层所包裹。腹腔镜下手术时如选择此入路方式,不仅在于该区域在腹腔镜下显示的清晰度较高,还可清晰暴露解剖后胆囊管、胆总管等组织的关系,且该入路方式可有效规避传统入路时的胆囊动脉血管,降低对胆囊血管造成的损伤,有效控制术后并发症发生率[9-10]。
随着现代腹腔镜技术的进一步完善和发展,镜下观察胆囊三角区结构的技术应运而生,使存在粘连病灶的患者也可施行腹腔镜手术。但实际实施手术时胆囊粘连的松解效果仍会对预后效果造成直接影响,且粘连越严重手术时间越长。总体而言,传统胆囊三角入路操作难度较低,但对炎症组织的分离难度更大,且术中容易造成出血或胆管损伤[11]。胆囊后三角入路虽然操作难度较高,但更易被分离,加之腹腔镜下于胆囊后三角的操作空间更大,区域内胆囊动脉血管分布更少,因而拥有更好的手术视野,也可降低术中出血量和术后并发症发生率。本研究结果显示,观察组术后并发症发生率为2.70%,明显低于对照组的18.92%(P<0.05),与邵加厂[12]研究结果一致。
综上所述,慢性结石性胆囊炎患者接受腹腔镜胆囊切除术治疗时应首选胆囊后三角解剖入路,能有效改善患者血清因子水平,预防术后并发症,降低中转开腹率,值得临床推广应用。
