有机无机肥配施对盐渍化土壤微生物量和呼吸的影响
2021-11-26史海滨张文聪王维刚苏永德
周 慧,史海滨,张文聪,王维刚,苏永德,闫 妍
有机无机肥配施对盐渍化土壤微生物量和呼吸的影响
周 慧,史海滨※,张文聪,王维刚,苏永德,闫 妍
(1. 内蒙古农业大学水利与土木建筑工程学院,呼和浩特 010018;2. 内蒙古农业大学旱区农业节水与水土环境研究所,呼和浩特 010018)
微生物可以通过摄入能量合成有机渗透压物质来实现对盐度的适应,然而,不同程度盐渍土微生物对能量的需求可能会发生改变。因此,该研究于2018-2019年开展田间定位试验,选取河套灌区轻度盐渍土S1(电导率为0.46 dS/m)及中度盐渍土S2(电导率为1.07 dS/m)为研究对象,设置了6个处理,包括不施氮(CK),单施无机氮(U1)以及分别用有机氮(U3O1、U1O1、U1O3和O1)替代25%、50%、75%和100%的无机氮,监测了土壤微生物量碳氮及土壤呼吸在第二个生长季的动态状况。结果表明:土壤盐渍化程度增加会导致土壤微生物量及微生物活性下降,S1土壤较S2土壤微生物量碳高12.01%~68.81%,土壤微生物量氮高14.31%~58.58%,土壤呼吸速率高11.75%~54.71%。不同盐分条件下,适当的有机肥施入比例可以显著提高土壤微生物量及微生物活性,S1和S2盐渍土分别以U1O1及O1处理较优。相关性分析表明,土壤呼吸速率与土壤微生物量碳氮呈极显著正相关(<0.01),土壤温度、土壤矿质氮与土壤微生物量碳氮、土壤呼吸速率呈显著正相关(<0.05)。从玉米产量及改善土壤微生物生存环境角度,得到该地区适宜的施肥模式为,轻度盐渍土:有机氮替代50%无机氮;中度盐渍土:有机氮替代100%无机氮。
碳;氮;土壤;盐渍化;有机无机肥配施;微生物量;呼吸
0 引 言
土壤盐渍化是限制干旱地区农业发展的主要问题[1]。耕地次生盐碱化的发生将对全球农业生产产生严重威胁,预计在未来25年内造成30%的土地损失,而在21世纪中叶这一数据将达到50%左右[2]。统计数据表明,目前全球约有8.31×108~9.32×108hm2土地受盐分影响[1],高土壤盐分浓度通过渗透胁迫、营养失衡、氧化损伤和离子毒性等[3]对植物产生负面影响,造成农业生产资源萎缩[4]。盐分不仅会直接影响植物生长发育,还会影响与之相互作用的土壤微生物[5]。盐渍土中植物覆盖量较少导致输入土壤的有机质不足,从而降低了土壤微生物量[6]。此外,高土壤盐分浓度会降低土壤呼吸速率[7-8],并杀死对盐分敏感的微生物[9]。盐分胁迫降低了微生物活性及生物量,从而抑制土壤养分转化,导致土壤生产力下降[5,10]。因此,改善盐渍化土壤微生物生存环境对于农业可持续发展至关重要。
微生物主要通过积累渗透压物质来适应盐渍土中的低渗透势,而有机渗透压物质的合成需要大量的能量[11]。近年来,有机农业被认为是可持续农业文化的典范[12],有机添加物可作为微生物容易获取的能源,以抵消土壤盐分的负面影响。有机肥可以通过改变土壤理化性质从而降低盐分产生的负面影响[13]。此外,有机肥料的施用不仅向土壤中接种了大量的外源微生物直接影响土壤微生物[14],且为微生物生长提供碳源和能源,其养分的缓慢释放还可为微生物提供更稳定的栖息环境[15]。同时,有机化合物解吸可以增加底物的有效性,从而增加土壤呼吸[16]。可以看出,施入有机肥是改善盐渍化土壤微环境的一项有效措施。
内蒙古河套灌区是重要的粮食产区,盐渍化土地已超过当地灌溉面积的50%以上[17]。此外,灌区生产实践过程中化肥用量已超过60万t/a,单位面积的施用量远高于世界平均水平[18]。一方面,施用化肥对土壤生态功能和理化特性造成不利影响[19-20]。另一方面,过量施用化肥可能加重土壤盐渍化程度[21]。因此,合理将化肥与有机肥料结合施用是创造集约型可持续发展农业的有效施肥模式。当前关于有机无机肥配施对于土壤微生物的研究大多集中于非盐渍化土壤或单一程度的盐渍化土壤中[7,9,22]。然而,土壤微生物随着盐分梯度改变会产生明显变化[23],有机氮投入比例对于不同程度盐渍化土壤微生物生物量及微生物活性的影响尚不清楚,因此,亟需量化不同盐渍化程度土壤微生物对有机肥的响应程度。本文针对不同盐分水平土壤,探讨了不同有机无机氮肥配施比例对河套灌区轻、中度盐渍化土壤微生物活性及微生物生物量的影响。本研究的目的是:1)确定有机氮投入比例对不同程度盐渍化土壤微生物生物量碳(MBC)、氮(MBN)和微生物活性(呼吸)的影响;2)探讨有机无机肥配施对盐渍化土壤微生物量及微生物活性的影响机理。
1 材料与方法
1.1 试验区概况
本试验于内蒙古河套灌区解放闸灌域沙壕渠试验站(40°54′40″N, 107°9′57″E)进行,该地区为典型干旱地区,多年平均气温为7.7 ℃,降雨量为143 mm,蒸发量2 100 mm。大于10 ℃的年积温为3 551 ℃,年平均日照时数3 200 h,年冻融期大约180 d。全年太阳总辐射约为6 000 MJ/m2。2019年生育期有效降雨量为52.2 mm,灌溉总量为225 mm(分别于玉米拔节期、大喇叭口期和抽雄期灌水75 mm)。土壤为硫酸盐-氯化物型盐土,0~20 cm和40~60 cm土层为粉壤土,>20~40 cm土层为粉质黏壤土,>60~100 cm为砂壤土。试验区轻、中度盐渍土初始土壤性质如下:有机质14.04、13.04 g/kg,全氮1.43、1.07g/kg,碱解氮54.68、46.54 mg/kg,速效磷37.78、23.58 mg/kg,速效钾199.67、176.33 mg/kg,pH值分别为8.2、8.4。
1.2 试验设计
本试验开展于2018—2019年,种植作物为玉米(内单314),大小行种植,大行距70 cm,小行距40 cm,株距27.7 cm。播种日期为4月末,收获日期为9月中旬。参考当地优化畦灌灌水定额750 m3/hm2作为灌水量,优化施氮量240 kg/hm2为施氮总量,在S1(轻度盐渍土,播前电导率:0.46 dS/m)、S2(中度盐渍土,播前电导率:1.07 dS/m)盐渍化农田分别设置6个处理,各重复3次,包括不施氮(CK)、单施无机氮(U1)以及用有机氮分别替代25%、50%、75%和100%的无机氮(U3O1、U1O1、U1O3和O1)。小区规格为6 m×5 m。各小区间设有隔离带以防止相互水氮影响。选取尿素(含氮46%)及商品有机肥(由玉米秸秆制造而成,含N 10%,有机质≥45%)进行氮素配施试验。有机肥和磷肥(过磷酸钙50 kg/hm2)作为基肥一次性施用(均匀撒施后旋耕20 cm),尿素按1:1比例于玉米播前和拔节期灌水时施入。
1.3 样品采集与测定方法
1.3.1 土壤呼吸及温度测定
2019年在各小区内放置2根PVC管(直径20 cm),分别置于株间(用于测定土壤全呼吸速率,高10 cm,嵌入土壤5 cm)和裸地(用于测定土壤异养呼吸速率)。裸地布置前清理其中可见根系,PVC管高50 cm,嵌入土壤45 cm,在管壁四周处钻孔(从管口5 cm处向下钻孔),试验期间保证管内无活体植物。使用Li-8100土壤碳通量自动测量系统(Li-Cor,Inc,NE,USA)测定土壤全呼吸速率(R,mol/(m2∙s))和土壤异养呼吸速率(R,mol/(m2∙s)),土壤全呼吸速率与土壤异养呼吸速率的差值为土壤自养呼吸速率(R,mol/(m2∙s))。由于有机肥肥效较慢,故于连续施肥的第二年(2019年)春玉米苗期(5月21日)、拔节期(6月20日)、抽雄期(7月11日)、灌浆期(8月5日)及成熟期(9月5日)各观测1次,每次测量在10:00-14:00之间完成。土壤温度由Li-8100碳通量自动测量系统自带的土壤温度探针测定(10 cm)。
1.3.2土壤微生物量碳氮、矿质氮、含水率、电导率及pH测定
2019年,每次进行土壤呼吸测定的当天利用5点法进行土壤采样(0~20 cm),过2 mm筛,一部分在4 ℃下保存,测定土壤微生物量[24],另一部分用于测定土壤理化性质。土壤含水率采用烘干法测定,土壤矿质氮用氯化钙浸提法[25]。
1.4 数据分析
10值计算方法为[26]
10=e10b(1)
式中10值是土壤温度敏感性系数,是土壤呼吸与温度单因素指数曲线模型R=e中的温度反应常数(为温度0 ℃时的R,为土壤温度, ℃)。将2019年5月—2019年9月R及相对应的值进行指数分布曲线回归,将所得的值代入式(1)中计算10值[26]。
微生物量C、N,微生物代谢熵计算方法为[24]


同一采样时间不同有机无机肥配施对土壤各指标的影响采用单因素方差分析(one-way ANOVA),土壤微生物指标与各环境因子的关系采用Pearson相关分析以及线性、非线性回归分析。利用Origin 2018软件作图。
2 结果与分析
2.1 土壤理化性质的变化
从表1可以看出,有机无机肥配施对土壤温湿度、土壤EC及pH大多没有显著影响。在整个生育期,土壤温度呈先升高后降低的趋势,在苗期最低,在拔节期最高;由于试验区周边在4月底和5月中旬进行了2次灌水,在整个苗期地下水位(0.52~0.83 m)较高,在地下水补给作用下使得此时期土壤含水率较高,而随着生育期推进,地下水位逐渐降低,地下水对土壤水补给量减少,再加气温升高导致腾发量增加,因而土壤含水率随着生育期推进呈逐渐降低趋势。土壤EC则在蒸发作用下随时间推移呈逐渐增加的态势(除拔节期灌水后降低外),而土壤pH则在时间上没有明显变化。
有机无机肥配施对轻、中度盐渍土土壤矿质氮含量产生极显著影响(<0.01),轻度盐渍土矿质氮含量在玉米生育前期(苗期及拔节期)以U1处理较大,而在后期则以U1O1处理较高;随着土壤盐分增大,无机肥氮素有效性降低,而有机肥的施入为氮素矿化创造了良好的环境,导致中度盐渍土基本表现出配施有机肥比例较大的处理土壤矿质氮含量较高,其中U1O3和O1处理之间无显著性差异。

表1 2019年不同施肥处理下土壤温湿度、电导率、pH及矿质氮动态变化
注:不同小写字母表示处理间差异显著(<0.05),S1为轻度盐渍土,S2为中度盐渍土,CK、U1、U3O1、U1O1、U1O3和O1分别为不施氮、单施无机氮以及用有机氮分别替代25%、50%、75%和100%的无机氮处理,下同。
Note: Different lowercase letters indicate statistically significant difference in treatment (<0.05), S1is mild saline soil, S2is moderate saline soil, no fertilization (CK); urea (U1); and 25%, 50%, 75%, and 100% of the urea N substituted by organic fertilizers U3O1, U1O1, U1O3, and O1, respectively, the same below.
2.2 不同程度盐渍土微生物量碳氮对有机无机肥配施的响应
从表2可以发现,施氮促进了生长季MBC、MBN的增长,但变化趋势随着盐分水平与有机无机肥配施比例不同而有所差异。在整个生育期内,同一处理S1土壤微生物量要明显高于S2土壤,随着有机肥施入比例增加两者之间的差异先增后减,生育期内S1土壤平均MBC、MBN分别较S2土壤显著高出12.01%~68.81%、14.31%~58.58%。
随着生育期推移,S1、S2土壤MBC、MBN基本呈现出先升后降的趋势,在拔节期达到最大值,成熟期出现最低值。在S1土壤,土壤微生物量随有机肥施入比例增加呈现出先升后降的趋势,其中以U1O1处理最大,土壤平均MBC、MBN分别比其余施氮处理显著高出12.41%~49.56%和5.45%~42.99%(土壤MBN与U1O3处理不显著);S2土壤则表现出有机肥施入比例越大土壤MBC、MBN越大的趋势,O1处理土壤平均MBC、MBN分别比其余施氮处理显著高出11.88%~68.07%和10.14%~48.99%(<0.05)。
从表2可以看出,随着生育期推移,土壤微生物碳氮比整体呈增加的态势,S1土壤MBC/MBN要显著高于S2土壤(除CK处理外)。说明在同一盐渍化土壤中,各施肥处理对于土壤MBC/MBN的改变较为一致。
2.3 不同程度盐渍土土壤呼吸和微生物代谢熵对有机无机肥配施的响应
从表3可以发现,土壤盐分的增加导致土壤呼吸速率显著下降,生育期S1土壤平均全呼吸速率、自养呼吸速率、异养呼吸速率比S2土壤分别高出11.75%~54.71%、19.68%~51.51%和16.42%~69.24%。
施氮增加了土壤呼吸速率。随着生育期推移,土壤呼吸速率呈先升后降的趋势,在抽雄期达到最大值,在成熟期出现最小值。各土壤呼吸指标变化基本一致,在S1土壤,随着有机肥施入比例增加呈现先增加后降低的趋势,其中以U1O1处理最大,土壤平均全呼吸速率、自养呼吸速率和异养呼吸速率较其余施氮处理分别显著高出11.59%~31.74%、6.30%~34.66%(与U1O3处理不显著)、13.24%~36.07%(<0.05)。在S2土壤则随着有机肥施入比例增加土壤呼吸速率呈逐渐增加的变化趋势,土壤平均全呼吸、自养呼吸和异养呼吸速率较其余施氮处理分别显著高出8.07%~45.19%、5.89%~41.49%(与U1O3处理不显著)、9.55%~47.73%(<0.05)。
本试验中CK处理土壤微生物代谢熵最高(表3),这是因为施肥使得微生物可利用的碳源较为充足,提高了土壤碳利用效率而导致。S1、S2土壤配施有机肥均可以降低土壤微生物代谢熵,说明施有机肥能缓解环境胁迫对微生物的影响,使微生物更有效地利用有机碳转化为生物量碳。

表2 土壤微生物量碳氮对施氮的响应

表3 土壤呼吸和微生物代谢熵对施氮的响应
2.4 土壤呼吸和代谢与土壤理化性质的关系分析
Person相关性分析表明(表4),S1、S2土壤温度与呼吸均呈显著正相关;土壤含水率与MBN呈极显著正相关,而与MBC/MBN呈极显著负相关;土壤矿质氮含量与土壤呼吸、MBC、MBN呈极显著正相关;土壤pH与MBC/MBN呈极显著正相关;土壤EC与土壤呼吸、MBC和MBN呈显著负相关,而与MBC/MBN呈极显著正相关;土壤呼吸与MBC和MBN呈极显著正相关。此外,S2土壤pH与土壤微生物量氮呈极显著负相关。
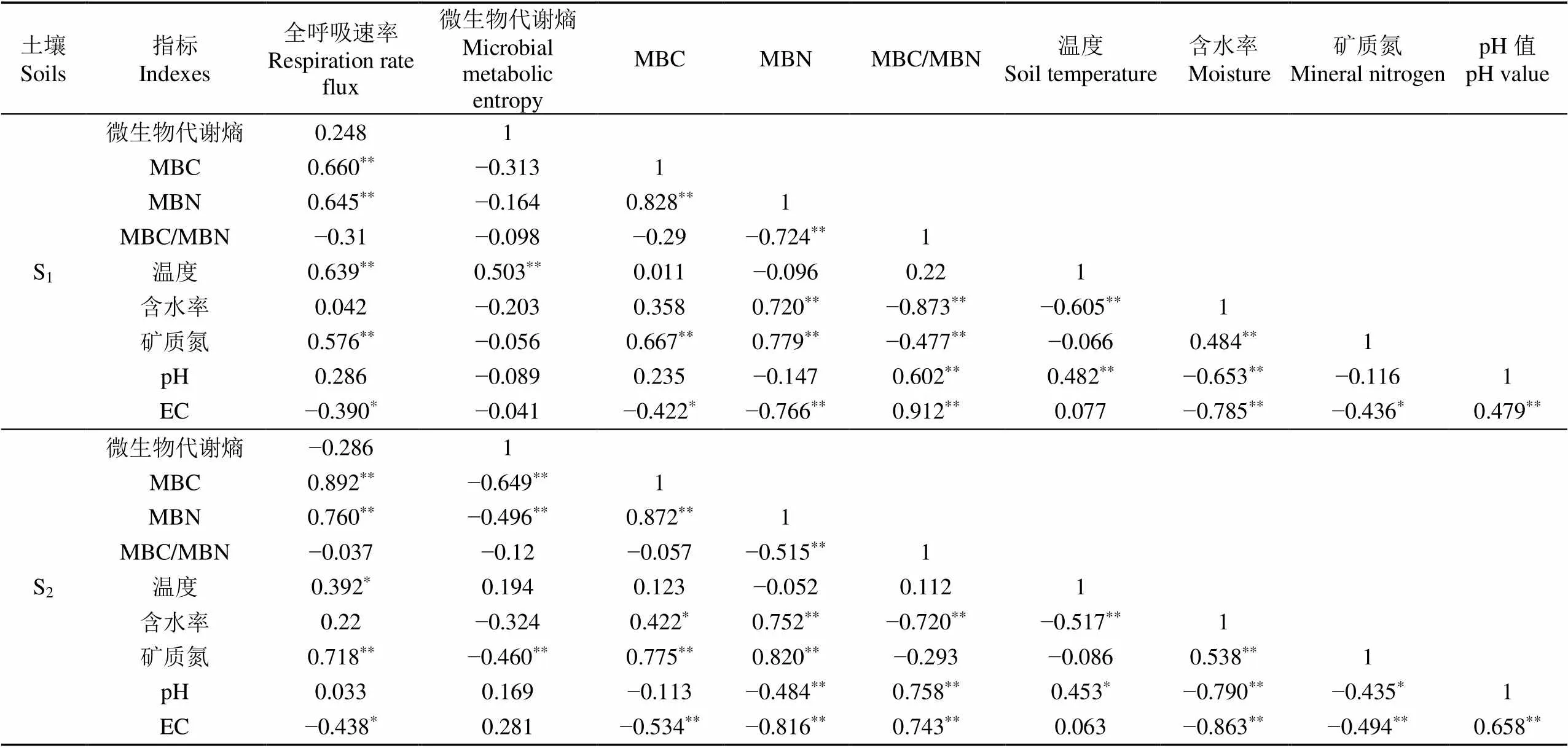
表4 S1、S2土壤呼吸和代谢与土壤理化性质的相关分析
注:样本数90,*,<0.05;**,<0.01。
Note: Sample size is 90,*,<0.05;**,<0.01.
进一步地,对于S1、S2土壤,各处理土壤呼吸与土壤温度之间存在显著的指数回归关系(表5),决定系数2在0.273~0.602之间。S1土壤10值在1.17~1.31之间,S2土壤10值在1.11~1.29之间,10值较小且各处理之间差异并不显著。通过二次函数拟合方程发现,S1、S2各处理土壤呼吸速率与土壤含水率关系不显著(>0.05),故本文土壤呼吸与含水率不符合二次函数关系(表6)。

表5 土壤呼吸速率与土壤温度关系
注:样本数15,为土壤温度,℃。
Note: Sample size is 15,is soil temperature, ℃.

表6 土壤呼吸速率与土壤含水率关系
注:样本数15,1为土壤含水率,%。
Note: Sample size is 15,1is Soil moisture, %.
通过回归分析得到了土壤微生物量、各土壤呼吸指标在有机肥施入比例与土壤盐分交互作用下的二元二次非线性回归模型(表7),通过显著性分析得知,各回归方程显著水平均小于0.05,获得了较好的拟合度。
分析回归方程各系数可知,在本研究条件下(施氮总量240 kg/hm2,土壤EC在0.59~1.56 dS/m之间),适当增加土壤盐分及有机肥施入比例可以提高土壤微生物量,并促进土壤呼吸,而过高的土壤盐分则会减少土壤微生物量,抑制土壤呼吸。可以看出,在不同盐分水平下,适宜的有机无机肥配施比例才能最大程度提高土壤微生物量及微生物活性。

表7 土壤微生物量及土壤呼吸在氮与盐分作用下的回归模型
注:样本数10,数据为全生育期平均值;1表示有机肥施入比例(%);2表示土壤盐分(dS·m-1)。
Note: Sample size is 10, the data is the average of the whole growth period;1is organic fertilizer application ratio (%);2is soil salinity (dS·m-1).
2.5 不同程度盐渍土作物产量对有机无机肥配施的响应
由图1可以看出,S1土壤作物产量显著高于S2土壤(<0.05);有机无机氮配施比例在不同盐分条件下对玉米产量影响不一,在S1盐渍土,表现出随着有机肥施入比例越大产量先增后降的趋势,S2盐渍土则表现出着有机肥施入比例越大产量越大的趋势,S1、S2盐渍土分别以U1O1及O1处理玉米产量最大,分别为11 902.91、7 609.67 kg/hm2(S2中U1O3与O1处理差异不显著,>0.05)。究其原因,这主要与有机无机氮配施在不同盐分土壤中产生的氮素供应过程不同,适宜的配施比例可以满足玉米对氮素的需求,从而利于玉米增产。
3 讨 论
3.1 盐分与有机无机肥配施对土壤微生物量的影响
研究表明高土壤盐浓度会导致土壤微生物量降低[27-29]。本研究结果也表明,土壤微生物量碳氮随着土壤盐渍化程度增加显著减少,这与Porcel等[4]的研究结果一致。一般来说,细菌和真菌的碳氮比分别在3~5和7~12之间[22],本研究S1土壤MBC/MBN在3.58~7.68之间,随着生育期推进逐渐由细菌向真菌群落转变,这可能是因为凋落物进入土壤为真菌繁殖创造了良好的条件而造成[23]。随着盐分增加会明显降低MBC/MBN,S2土壤MBC/MBN在2.92~5.41之间,在整个生长季内均以细菌为主,这是因为真菌在高盐分条件下更容易死亡[7]。本研究结果发现,随着生育期推进,S1、S2土壤MBC/MBN大部分逐渐增大,这可能是由于生长后期土壤氮素供应不足,MBN降低所导致。
施肥是影响土壤MBC、MBN的主要因素。本研究发现,单施无机肥可以促进土壤MBC、MBN的增加,这可能是因为施氮降低了土壤C/N比会加速土壤有机碳的矿化,或作为能量来源而产生正激发效应[30]。前人研究表明,在盐渍土中施入有机肥可以为土壤微生物提供能量和养分,促使微生物合成渗透压物质,从而减少盐度对微生物的负面影响[5]。本研究也表明,在S1、S2土壤,配施有机肥均可以提高土壤MBC、MBN含量,但随有机肥施入比例不同而不同。在盐度较低的S1土壤,以有机无机各半配施较为适宜,而S2土壤则以单施有机肥能最大程度提高微生物量。这可能是因为在盐分胁迫较低时,有机肥所提供的养分并不能完全满足玉米生长的需求,加剧其与土壤微生物的竞争,导致土壤MBC、MBN减少,因此需要配施适量的无机肥来满足微生物对矿质氮的同化需求;随着盐渍化程度增加,一方面,盐胁迫会抑制作物对养分的吸收利用,另一方面,在盐分较高时无机肥有效性降低,所产生的矿质氮含量和有机肥差异减小[31],而较多的有机物输入可以为微生物提供更多的底物及能量,从而减少盐度对微生物的负面影响,使土壤微生物量增加。这也是导致轻、中度盐渍土分别以有机无机氮各半配施和单施有机氮处理能产生较好的氮素供应过程的原因。
相关性分析表明,土壤含水率与土壤MBN呈显著正相关,而与MBC/MBN呈极显著负相关,这可能是因为土壤湿度促进了土壤氮素的矿化,增加了微生物固氮量。此外,本研究发现在pH较大的S2土壤,土壤pH与土壤MBN呈显著负相关关系,这表明土壤碱化可能会成为土壤微生物量的限制性因素。
3.2 盐分与有机无机肥配施对土壤呼吸的影响
土壤呼吸是衡量微生物对C循环总体贡献的最直接的指标[8]。在盐渍化土壤中,盐分是土壤呼吸的主要限制因子之一,在大多数情况下,自然盐梯度下土壤呼吸与盐度呈显著负相关[32-33]。本研究结果表明,与S1土壤相比,S2土壤各呼吸指标均有所降低,这可以解释为盐分限制了作物生长,由于土壤渗透胁迫导致微生物活性减弱[34],还可能是因为高盐度土壤具有较低的C底物可利用性,导致呼吸速率降低[34]。
本研究发现,单施无机肥使S1、S2土壤全呼吸速率分别显著提高10.32%~23.94%、21.43%~31.91%。这是因为土壤盐渍化和养分匮乏是河套灌区作物生产力的限制条件,施氮增加了土壤微生物可利用底物,并缓解了土壤盐分胁迫,增加了土壤微生物生物固氮量[35],这使得微生物呼吸得到了加强。而微生物活性的提高会促进作物根系对氮素的吸收,使土壤异养呼吸也得到加强[36]。有研究表明,使用有机物料改良的土壤中盐度对土壤呼吸的负面影响有所减少[37]。本研究发现,施入有机肥对不同程度盐渍土各呼吸指标均有所提高,这可能是因为有机肥的施入增加了对底物的利用率将产生剩余资源,微生物可以用于渗透压物质的生产[38],从而提高微生物活性。S1、S2土壤分别以有机无机各半配施和单施有机肥处理土壤呼吸强度较高,表明不同盐分水平下需要适宜的有机无机肥配施才能使土壤微生物处于良好的状态,可以存储和循环更多养分。
本研究发现,土壤呼吸与土壤温度呈显著正相关(<0.05),但是各处理敏感性系数10值均较小。这可能是由于本试验施肥时间较早,此时期土壤温度较低,而土壤矿质氮含量与土壤呼吸、微生量碳氮呈极显著正相关(<0.01),表明在作物生长前期氮素是影响土壤呼吸的主要原因,导致土壤呼吸对温度变化敏感性不高。本研究发现土壤呼吸速率与土壤含水率的二次函数关系并不显著,这可能是因为土壤含水率只有在过低或过高时才会成为土壤呼吸的限制因子[39],本试验条件下土壤含水率不构成胁迫,所以二者之间的二次函数关系不显著(>0.05)。
3.3 土壤微生物量改变对土壤呼吸的影响
研究表明,土壤微生物量的增加会导致土壤呼吸的增加,而微生物量的改变也回引起土壤呼吸变化[40]。对于N素匮乏的盐渍化地区,由于微生物受到可用性N的限制,会使土壤呼吸受到抑制[41]。本研究通过有机无机肥配施提高了土壤的供氮能力,且在土壤温湿度适宜的条件下,土壤微生物量和根系生物量增加,最终导致土壤全呼吸速率得到增强。
微生物代谢熵是反映环境因素、管理措施变化等对微生物活性影响的一个敏感指标,其值的增加或减少与微生物代谢的变化有关[42]。低微生物代谢熵(高碳利用效率)表示土壤较少的C损失并将其转化为微生物量,反之则表示大量C通过土壤呼吸损失到大气中,最终减少了土壤微生物量以及土壤固碳量[43]。因此,微生物代谢熵被应用为评价土壤微生物代谢状况[44]和土壤碳循环[45]的参数。本研究发现,适宜的有机无机肥配施可以降低土壤微生物代谢熵,说明配施有机肥可以缓解盐分等环境因子对微生物的胁迫,增加了碳利用效率。
在盐渍化地区,盐分对土壤微生物量及微生物活性的影响不容忽视,而盐度随着季节的变化而改变,因此了解微生物对盐度变化的响应十分重要。由于河套灌区地下水埋深较浅(0.52~2.41 m),而地下水含盐量较高,在强蒸发作用下生育期内土壤EC基本呈现出逐渐增加的趋势,本研究发现盐浓度与土壤呼吸、MBC、MBN均呈显著或极显著负相关关系。Asghar等[46]研究表明,在底物存在的条件下,盐渍土中微生物群落可以适应由于淋溶、灌溉或水位变化而可能发生的田间盐度波动。因此,底物的变化可能是引起土壤微生物量及活性变化的主要原因,生长季内盐浓度波动是否会引起土壤微生物量及活性变化的原因还有待进一步研究。
4 结 论
1)本研究通过连续2 a有机无机肥配施试验发现,有机无机肥配施对土壤温湿度、pH及电导率(Electrical conductivity)值大多没有显著影响,而合理的有机无机氮配施可以产生良好的氮素释放过程。
2)随着盐渍化程度升高,土壤微生物量碳(Microbial Biomass Carbon,MBC)、微生物量氮(Microbial Biomass Nitrogen,MBN)、土壤全呼吸、异养呼吸、自养呼吸显著降低;配施有机肥可以提高土壤微生物量及微生物活性,轻、中度盐渍土分别以有机无机各半配施及单施有机肥较优,同时可以获得最高产量。
3)相关性分析表明,土壤呼吸与土壤MBC、MBN呈极显著正相关(<0.01),土壤温度与土壤呼吸、土壤微生物量碳氮呈显著正相关(<0.05)。不同有机无机肥配施比例能够调控土壤矿质氮水平,是土壤微生物量及土壤呼吸的主要调控因子。
4)回归分析表明,土壤呼吸与土壤温度之间存在显著的指数回归关系(<0.05),各处理敏感性系数值均较小(1.11~1.31)。轻、中度盐渍土各处理土壤呼吸速率与土壤含水率之间二次函数关系不显著(>0.05)。土壤微生物量及土壤呼吸与有机肥施入比例、土壤盐分呈显著二元二次非线性回归模型(<0.05),回归系数表明,针对不同盐分土壤,施入适量有机氮才能最大程度提高土壤微生物量及土壤呼吸。
[1] Osman K T. Management of soil problems[C]. American: Springer International Publishing AG, 2018: 255-298.
[2] Wang W X, Vinocur B, Altman A. Plant responses to drought,salinity and extreme temperatures: Towards genetic engineering for stress tolerance[J]. Planta, 2003, 218: 1-14.
[3] Chinnusamy V, Jagendorf A, Zhu J K. Understanding and improving salt tolerance in plants[J]. Crop Science, 2005, 45(2): 437-448.
[4] Porcel R, Aroca R, Ruiz-Lozano J M. Salinity stress alleviation using arbuscular mycorrhizal fungi: A review[J]. Agronomy for Sustainable Development, 2012, 32(1): 181-200.
[5] Elmajdoub B, Marschner P. Salinity reduces the ability of soil microbes to utilisecellulose[J]. Biology and Fertility of Soils, 2013, 49(4): 379-386.
[6] Rath K M, Rousk J. Salt effects on the soil microbial decomposer community and their role in organic carbon cycling: A review[J]. Soil Biology & Biochemistry, 2015, 81: 108-123.
[7] Chowdhury N, Marschner P, Burns R G. Soil microbial activity and community composition: Impact of changes in matric and osmotic potential[J]. Soil Biology & Biochemistry, 2011, 43(6): 1229-1236.
[8] Rousk J, Elyaagubi F K, Jones D L, et al. Bacterial salt tolerance is unrelated to soil salinity across an arid agroecosystem salinity gradient[J]. Soil Biology and Biochemistry 2011, 43: 1881-1884.
[9] Yan N, Marschner P, Cao W, et al. Influence of salinity and water content on soil microorganisms[J]. International Soil & Water Conservation Research, 2015, 3(4): 316-323.
[10] Tripathi S, Kumari S, Chakraborty A, et al. Microbial biomass and its activities in salt-affected coastal soils[J]. Biology and Fertility of Soils, 2006, 42(3): 273-277.
[11] Oren A. The bioenergetic basis for the decrease in metabolic diversity at increasing salt concentrations: Implications for the functioning of saltlake ecosystems[J]. Hydrobiologia, 2001, 466(1/2/3): 61-72.
[12] Bueren E T L V, Struik P C, Jacobsen E. Ecological concepts in organic farmingand their consequences for an organic crop ideotype[J]. NJAS-Wageningen Journal of Life Science, 2002, 50: 1-26.
[13] Shao H S, Lei T, Fahad N,et al. Response of microbial communities and enzyme activities to amendments in saline-alkaline soils[J]. Applied Soil Ecology, 2019, 135: 16-24.
[14] 于淑玲. 腐生真菌在有机质分解过程中的作用研究进展[J]. 河北师范大学学报:自然科学版,2003,27(5):519-522.
Yu Shuling. A study of function that rot funguses have in the decomposition of organic matter[J]. Journal of Hebei Normal University: Natural Science Edition, 2003, 27(5): 519-522. (in Chinese with English abstract)
[15] 魏巍,许艳丽,朱琳,等. 长期施肥对黑土农田土壤微生物群落的影响[J]. 土壤学报,2013,50(2):372-380.
Wei Wei, Xu Yanli, Zhu Lin, et al. Effect of long-term fertilization on soil microbial communities in farmland of black soil[J]. Acta Pedologica Sinica, 2013, 50(2): 372-380. (in Chinese with English abstract)
[16] Mavi M S, Sanderman J, Chittleborough D J, et al. Sorption of dissolved organic matter in salt-affected soils: Effect of salinity, sodicity and texture[J]. Science of the Total Environment, 2012, 435: 337-344.
[17] Feng Z Z, Wang X, Feng Z W. Soil N and salinity leaching after the autumn irrigation and its impact on groundwater in Hetao Irrigation District, China[J]. Agricultural Water Management, 2005, 71(2): 131-143.
[18] 杜军,杨培岭,李云开,等. 基于水量平衡下灌区农田系统中氮素迁移及平衡的分析[J]. 生态学报,2011,31(16):4549-4559.
Du Jun, Yang Peiling, Li Yunkai, et al. Nitrogen balance in the farmland system based on water balance[J]. Acta Ecologica Sinica, 2011, 31(16): 4549-4559. (in Chinese with English abstract)
[19] Saha S, Prakash V, Kundu S, et al. Soil enzymatic activity as affected by long term application of farm yard manure and mineral fertilizer under a rainfed soybean–wheat system in N-W Himalaya[J]. European Journal of Soil Biology, 2008, 44(3): 309-315.
[20] Soares J R, Cantarella H, Menegale M L D C. Ammonia volatilization losses from surface-applied urea with urease and nitrification inhibitors[J]. Soil Biology & Biochemistry, 2012, 52(8): 82-89.
[21] Céccoli G, Senn M E, Bustos D, et al. Genetic variability for responses to short- and long-term salt stress in vegetative sunflower plants[J]. Journal of Plant Nutrition and Soil Science 2012, 175(6): 882-890.
[22] 王宇峰,孟会生,李廷亮,等. 培肥措施对复垦土壤微生物碳代谢功能多样性的影响[J]. 农业工程学报,2020,36(24):81-90.
Wang Yufeng, Meng Huisheng, Li Tingliang, et al. Effects of fertilization regime on the functional diversity of microbial carbon and nitrogen metabolism in reclaimed soil[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(24): 81-90. (in Chinese with English abstract)
[23] Morrissey E M, Gillespie J L, Morina J C, et al. Salinity affects microbial activity and soil organic matter content in tidal wetlands[J]. Global Change Biology, 2014, 20(4): 1351-1362.
[24] Varma A, Oelmüller R. Advanced techniques in soil microbiology[J]. Soil Biology, 2007, 11: 202-207.
[25] Houba V J G, Novozamsky J, Huybregts A W M, et al. Comparison of soil extractions by 0.01 mol/LCaCl2by EUF and by some conventional extraction procedures[J]. Plant Soil, 1986, 96: 433-437.
[26] 涂利华,胡庭兴,黄立华,等. 华西雨屏区苦竹林土壤呼吸对模拟氮沉降的响应[J]. 植物生态学报,2009,33(4):728-738.
Tu Lihua, Hu Tingxing, Huang Lihua, et al. Response of soil respiration to simulated nitrogen deposition in pleioblastusamarus forest, rainy area of west China[J]. Chinese Journal of Plant Ecology, 2009, 33(4): 728-738. (in Chinese with English abstract)
[27] Zhang Y, Cao C, Guo L, et al. Soil properties, bacterial community composition, and metabolic diversity responses to soil salinization of a semiarid grassland in northeast China[J]. Journal of Soil and Water Conservation, 2015, 70(2): 110-120.
[28] Bannur E, Stephen B, Petra M. Response of microbial activity and biomass in rhizosphere and bulk soils to increasing salinity[J]. Plant and Soil, 2014, 381(1/2): 297-306.
[29] Zhang X M, Xue C H, Wang C X. Effects of imidacloprid on soil microbial communities in different saline soils[J]. Environmental Science and Pollution Research, 2015, 22: 19667-19675.
[30] Kuzyakov Y, Friedel J K, Stahr K. Review of mechanisms and quantification of priming effects[J]. Soil Biology and Biochemistry, 2000, 32(11/12): 1485-1498.
[31] 周慧,史海滨,徐昭,等. 有机无机肥配施对盐渍土供氮特性与作物水氮利用的影响[J]. 农业机械学报,2020,51(4):299-307.
Zhou Hui, Shi Haibin, Xu Zhao, et al. Effects of Combined application of organic and inorganic fertilizers on nitrogen supply and crop water and nitrogen utilization in salinized soils[J]. Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(4): 299-307. (in Chinese with English abstract)
[32] Yuan B C, Li Z Z, Liu H, et al. Microbial biomass and activity in salt affected soils under arid conditions[J]. Applied Soil Ecology, 2007, 35: 319-328.
[33] Sardinha M, Torsten M, Schmeisky H, et al. Microbial performance in soils along a salinity gradient under acidic conditions[J]. Applied Soil Ecology, 2003, 23(3): 237-244.
[34] Rietz D N, Haynes R J. Effects of irrigation-induced salinity and sodicity on soil microbial activity[J]. Soil Biology & Biochemistry, 2003, 35(68): 45-854.
[35] 陶朋闯,陈效民,靳泽文,等. 生物质炭与氮肥配施对旱地红壤微生物量碳、氮和碳氮比的影响[J]. 水土保持学报,2016,30(1):231-235.
Tao Pengchuang, Chen Xiaoming, Jing Zewen, et al. Effects of combined with nitrogen fertilizers on microbial biomass C, N and carbon-to-nitrogen ratio of upland red soil[J]. Journal of Soil and Water Conservation, 2016, 30(1): 231-235. (in Chinese with English abstract)
[36] 曾清苹,何丙辉,毛巧芝,等. 重庆缙云山两种林分土壤呼吸对模拟氮沉降的季节响应差异性[J]. 生态学报,2016,36(11):3244-3252.
Zeng Qingping, He Binghui, Mao Qiaozhi, et al. Seasonal response of soil respiration to simulated nitrogen deposition in a cirus plantation and masson pine forest in Mt.Jinyun, Chongqing, China[J]. Acta Ecologica, 2016, 36(11):3244-3252. (in Chinese with Englishabstract)
[37] Muhammad S T, Müller T, Joergensen R G. Decomposition of pea and maize straw in Pakistani soils along a gradient in salinity[J]. Biology & Fertility of Soils, 2006, 43(1): 93-101.
[38] Schimel J, Balser T C, Wallenstein M. Microbial stress-response physiology and its implications for ecosystem function[J]. Ecology, 2007, 88: 1386-1394.
[39] Luo Y Q, Zhou X H. Soil Respiration and the Environment[M]. American: Springer International Publishing AG, 2006: 257-305.
[40] 刘静,孙涛,程云云,等. 氮沉降和土壤线虫对落叶松人工林土壤有机碳矿化的影响[J]. 生态学杂志,2017,36(8):2085-2093.
Liu Jing, Sun Tao, Cheng Yunyun, et al. Effect of nitrogen deposition and soil nematode on soil organic carbon mineralization in a Larixgmeliniiplantation[J]. Chinese Journal of Ecology, 2017, 36(8): 2085-2093. (in Chinese with Englishabstract)
[41] Bowden R D, Davidson E, Savage K, et al. Chronic nitrogen additions reduce total soil respiration and microbial respiration intemperate forest soils at the Harvard Forest[J]. Forest Ecology and Management, 2004, 196(1): 43-56.
[42] Fierer N, Morse J L, Berthrong S T, et al. Environmental controls on the landscape-scale biogeography of stream bacterial communities[J]. Ecology, 2007, 88: 2162-2173.
[43] Manzonis S, Taylor P, Richter A, et al. Environmental and stoichiometric controls on microbial carbon-use efficiency in soils[J]. New Phytologist, 2012, 96: 79-91.
[44] Wardle D A, Ghani A. A critique of the microbial metabolic quotient (q CO2) as a bioindicator of disturbance and ecosystem development[J]. Soil Biology and Biochemistry, 1995, 27: 1601-1610.
[45] Sulman B N, Phillips R P, Oishi A C, et al. Microbe-driven turnover offsets mineral-mediated storage of soil carbon under elevated CO2[J]. Nature Climate Change, 2014, 4: 1099-1102.
[46] Asghar H N, Setia R, Marschner P. Community composition and activity of microbes from saline soils and non-saline soils respond similarly to changes in salinity[J]. Soil Biology & Biochemistry, 2012, 47: 175-178.
Effects of the combined application of organic and inorganic fertilizers on soil microbial biomass and soil respiration in saline soil
Zhou Hui, Shi Haibin※, Zhang Wencong, Wang Weigang, Su Yongde, Yan Yan
(1.,,010018,; 2.,,010018)
Microorganisms can adapt to the salinity by ingesting energy, further to synthesize organic osmolytes in soil. However, microbial demand for energy may change, as the soil salinity changes. In this study, a field experiment was carried out to explore the effects of the combined application of organic and inorganic fertilizers on soil respiration and microbial biomass in saline soil. The samples were taken as the mild saline soil, S1(electrical conductivity (EC) 0.46 dS/m) and moderate saline soil, S2(electrical conductivity (EC) 1.07 dS/m) in Hetao Irrigation District of Inner Mongolia, China, in 2018. Soil respiration rate was measured by a li-8100 soil carbon flux automatic measurement system. Surface soil samples of 0-20 cm depths were collected under various fertilization regimes in mild and moderate saline soil. Calcium chloride and chloroform fumigation extraction were used to investigate the effect of various fertilization regimes on the mineral nitrogen contents and microbial biomass in soil. Six treatments were set, including no fertilization (CK), urea (U1), and 25%, 50%, 75%, as well as 100% of urea N substituted by organic fertilizers U3O1, U1O1, U1O3, and O1, respectively, during the second growing season (April-September). The parameters were measured under equal N application rates of 240 kg/hm2, the dynamics of soil microbial biomass (i.e., microbial biomass carbon [MBC] and microbial biomass nitrogen [MBN]), and soil respiration (i.e., soil respiration rate, soil autotrophic respiration rate, and soil heterotrophic respiration rate). The results showed that the contents of mineral nitrogen in S1soil were higher in the U1treatment during the early growing stage (seedling and stem elongation stage), but higher in the U1O1treatment in the later stage. S2soil showed that the soil mineral nitrogen contents were higher in the whole growing stage, as the application rate of organic fertilizer increased. Furthermore, the increase of soil salinization resulted in the decrease of microbial biomass and microbial activity in the soil. The MBC in S1soil increased by 12.01%-68.81%, while the MBN increased by 14.31%-58.58%, and the soil respiration flux increased by 11.75%-54.71%, compared with S1soil. Furthermore, the organic fertilizer significantly increased the microbial biomass and microbial activity under different degrees of saline soils. The S1saline soils treated with U1O1presented the higher MBC, MBN, and soil respiration flux, indicating a significant increase compared with U1treatment (<0.05). The performance of S2saline soil after the O1treatment was better than that after the U1treatment, where the MBC, MBN, and soil respiration flux increased (<0.05). The highest maize yield was also achieved in the S1and S2soil treated with U1O1and O1, which were 11 902.91, and 7 609.67 kg/hm2, respectively. A correlation analysis was found that the soil respiration presented a significant positive correlation with the MBC and MBN (<0.05). The soil temperature and mineral nitrogen had a significant positive correlation with the soil respiration, MBC, and MBN (<0.05). Regression analysis showed that there was a significant exponential relationship between the soil respiration and temperature (<0.05), but the relationship between soil respiration rate and soil moisture content was not significant. Additionally, there was a significant nonlinear relationship of soil microbial biomass and respiration rate with the organic fertilizer rate and soil salt concentration. The regression coefficient demonstrated that the appropriate organic fertilizer rate contributed to maximizing the soil microbial biomass and respiration rate in different saline soils. Optimal organic and chemical fertilizer management models were achieved for the mild saline soil in the Hetao irrigation area. Specifically, the mild saline soil (120 kg/hm2urea+120 kg/hm2organic fertilizer), and moderate saline soil (240 kg/hm2organic fertilizer) can be expected for the higher corn yield under the improved soil microbial environment.
carbon; nitrogen; soils; salinization; combined application of organic and inorganic fertilizers; microbial biomass; respiration
周慧,史海滨,张文聪,等. 有机无机肥配施对盐渍化土壤微生物量和呼吸的影响[J]. 农业工程学报,2021,37(15):86-95.doi:10.11975/j.issn.1002-6819.2021.15.011 http://www.tcsae.org
Zhou Hui, Shi Haibin, Zhang Wencong, et al. Effects of the combined application of organic and inorganic fertilizers on soil microbial biomass and soil respiration in saline soil[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(15): 86-95. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.15.011 http://www.tcsae.org
2021-01-02
2021-06-10
国家自然科学基金项目(51769024、51539005)
周慧,博士生,研究方向为氮素循环与环境效应。Email:792606382@qq.com
史海滨,教授,博士生导师,研究方向为节水灌溉原理及应用。Email:shi_haibin@sohu.com
10.11975/j.issn.1002-6819.2021.15.011
S154.4
A
1002-6819(2021)-15-0086-10
