非肥胖人群中HDL-C水平与NAFLD关系的前瞻性队列研究
2021-11-26蔡昕添王梦茹刘莎莎木拉力别克黑扎提李南方
蔡昕添 陈 梦 王梦茹 刘莎莎 朱 晴 木拉力别克·黑扎提 李南方
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的慢性代谢性疾病[1]。伴随着肥胖和代谢综合征患病人群的增长,NAFLD目前已成为我国常见的慢性代谢性疾病之一[2]。近年来,越来越多的证据表明NAFLD与2型糖尿病、心血管疾病、慢性肾脏疾病以及结直肠恶性肿瘤等疾病的发生、发展密切相关[3]。目前,已经证实肥胖是促使NAFLD患病的一个独立危险因素,然而大量证据表明,非肥胖人群中NAFLD的发生率同样较高[4]。
此外,越来越多的研究证明高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)与NAFLD的发生、发展关系密切。但这些研究主要为横断面研究,无法评估HDL-C水平与NAFLD发生之间的因果关系。因此,为深入了解非肥胖人群中HDL-C水平与NAFLD发生之间的因果关系,笔者基于一项中国非肥胖人群的前瞻性队列研究数据开展了本研究。
资料与方法
1.研究对象:本研究中所涉及全部资料来自于Sun等[5]于2010年1月开展的一项前瞻性队列研究。在参加本研究之前,所有参与者均签署知情同意书。所有参与者均在2010年1月~2014年12月于温州市人民医院体检中心进行健康体检后被纳入本研究。排除标准:①缺乏基本资料或失访;②自我报告过量饮酒(男性每天>20g,女性每天>10g);③既往明确诊断患有肝病;④体重指数(body mass index,BMI)≥25kg/m2;⑤低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)>3.12mmol/L;⑥正在服用降压药、降糖药或降脂药。最终共纳入16173例初次体检时无NAFLD的非肥胖参与者,并对其完成了为期5年的定期随访。上述16173例合格参与者中,共有2322例非肥胖参与者在随访过程中被诊断为NAFLD患者。
2.NAFLD的诊断标准:NAFLD的诊断依据中国肝病协会超声诊断指南进行评估[6]。
3.数据收集:所有参与者的血压测量均在安静的环境中进行,参与者取坐姿,使用自动血压计测量。所有生化指标均采用自动测量分析仪(雅培AxSYM)按标准方法进行分析。主要收集并观察以下指标:年龄、性别、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulin,GLB)、总胆红素(total bilirubin,TB)、直接胆红素(direct bilirubin,DBIL)、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、血尿酸(uric acid,UA)、LDL-C、空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(HDL-C)、BMI、随访时间以及随访过程中NAFLD的患病情况。
结 果
1.研究人群的特征:通过对原始数据进行检查、评估和删除缺失值超过15%的数据后,共有12128例参与者被纳入本次分析。多重插补前后的敏感度分析结果显示,各指标在插补前后差异均无统计学意义。在12128例参与者中,NAFLD的总体发生率为17.7%。进入队列时参与者平均年龄为42.5岁,其BMI均值为21.1kg/m2。根据HDL-C四分位数水平分为4组,各组基线生化指标和临床特征详见表1。

2.单因素分析:单因素分析结果详见表2。HDL-C、GGT、ALT、AST、TP、GLB、TB、BUN、Scr、UA、FPG、TC、TG、LDL-C、SBP、舒张压、年龄、BMI与NAFLD的发生密切相关。
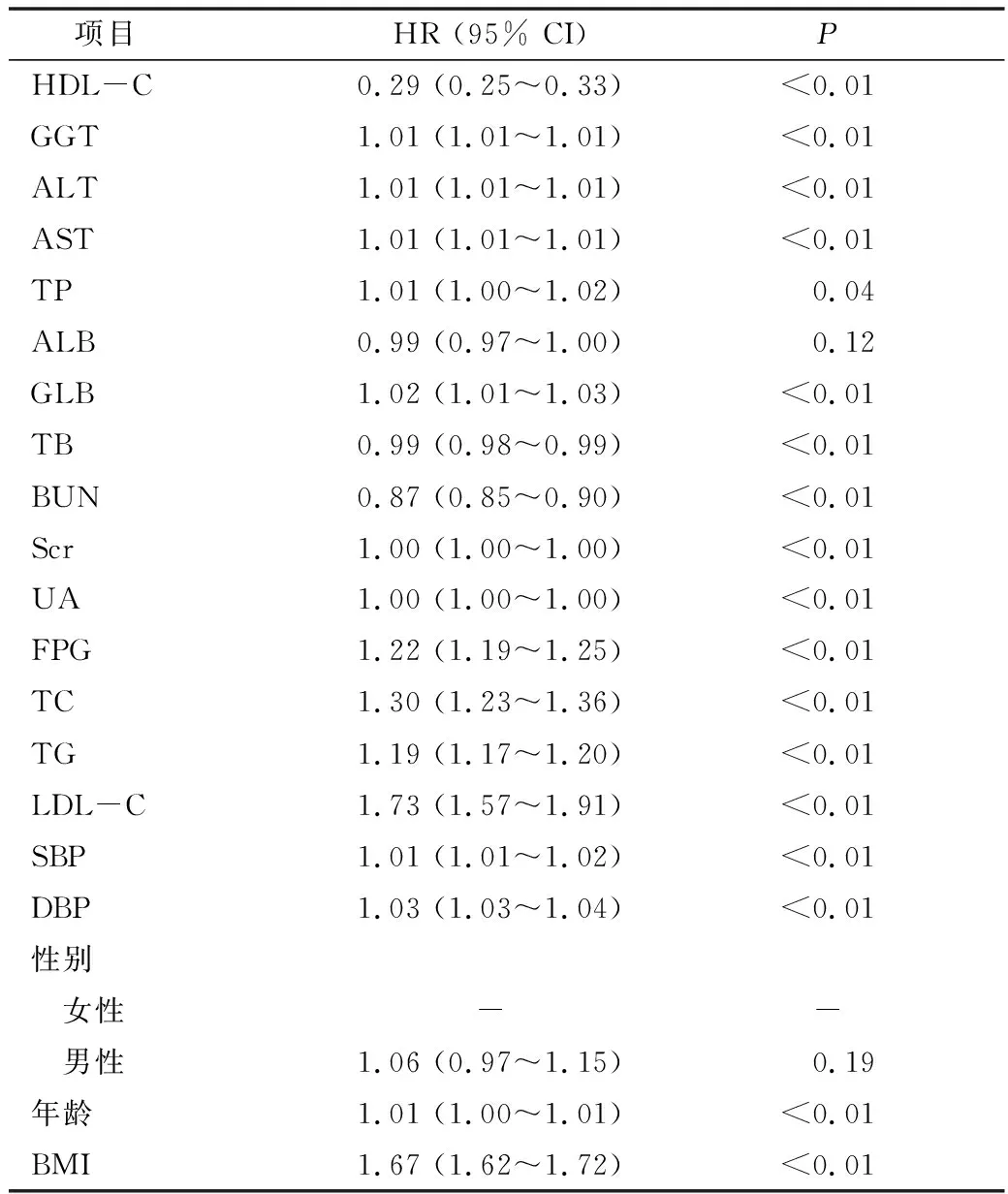
表2 单因素分析的结果
3.HDL-C与NAFLD发病关系的研究:本研究中使用COX比例风险回归模型来评估HDL-C与NAFLD发病的关系。在表3中展示了原始模型和调整后的模型结果。在原始模型中,HDL-C可作为NAFLD事件发生的保护因素(HR=0.28,95% CI:0.24~0.32,P<0.01)。在模型1中(调整因素:性别、年龄、BMI、SBP、DBP),结果无明显变化(HR=0.44,95% CI:0.39~0.51,P<0.01)。在模型2中(调整因素:性别、年龄、BMI、SBP、DBP、GGT、ALT、AST、TP、GLB、TB、BUN、Scr、UA、FPG、TC、TG、LDL-C),其结果仍然稳定(HR=0.47,95% CI:0.40~0.55,P<0.01)。将HDL-C作为分类变量后,与Q1比较,Q4的NAFLD风险显著降低,并且Q1至Q4间的趋势是显著的(P<0.01)。

表3 不同回归模型中HDL-C与NAFLD发病的关系
4.平滑曲线拟合与阈值效应分析:在本研究中,采用广义加性模型来评估HDL-C与NAFLD发病之间的非线性关系(图1)。在调整了性别、年龄、BMI、SBP、DBP、GGT、ALT、AST、TP、GLB、TB、BUN、Scr、UA、FPG、TC、TG、LDL-C后,发现HDL-C与NAFLD发病之间存在阈值效应,且阈值效应的拐点为1.09mmol/L。当基线HDL-C<1.09mmol/L时,HDL-C可作为NAFLD事件发生的危险因素(HR=2.76,95% CI:1.51~5.05,P<0.01)。当基线HDL-C≥1.09mmol/L时,HDL-C可作为NAFLD事件发生的保护因素(HR=0.17,95% CI:0.14~0.20,P<0.01,表4)。

图1 HDL-C与NAFLD发病风险的平滑曲线拟合图

表4 HDL-C水平与非酒精性脂肪肝风险的阈值效应分析
讨 论
本研究中,为期5年的随访期内NAFLD的累积发生率为17.70%。调整其他协变量后,HDL-C水平与NAFLD的发生呈负相关。本研究还发现HDL-C水平与NAFLD发病存在非线性关系。HDL-C阈值效应拐点左右两侧的效应大小趋势存在显著差异,其中当基线HDL-C<1.09mmol/L时,HDL-C与NAFLD发生率呈正相关(HR=2.76,P<0.01);而当基线HDL-C≥1.09mmol/L时,HDL-C与NAFLD发生率呈负相关(HR=0.17,P<0.01)。这一结果提示HDL-C与NAFLD发病之间的独立关联存在阈值饱和效应。当基线HDL-C水平为1.09mmol/L时,中国非肥胖人群的NAFLD患病风险最大,而随着HDL-C水平的升高NAFLD患病风险逐渐降低。
HDL-C是胰岛素抵抗的标志物之一,而胰岛素抵抗在NAFLD的发病机制中发挥着重要作用[8]。虽然HDL-C与NAFLD之间的关联机制尚未完全阐明,但有研究表明胰岛素抵抗是其一种潜在的介导因素[9]。当HDL-C水平较低时,随着脂肪分解的加速,游离脂肪酸水平大幅升高。游离脂肪酸水平的升高会导致胰岛素敏感度的降低,随着抗氧化和抗炎能力的降低,组织氧化应激的诱导会导致组织胰岛素抵抗逐渐增强。而胰岛素抵抗可通过诱导脂肪组织中甘油三酯的分解加速和肝脏中甘油三酯的从头合成增强来促进NAFLD的发生[10~12]。因此,胰岛素抵抗可能是HDL-C与NAFLD发生相关的原因之一。由于缺乏血清胰岛素水平资料,本研究未探讨HDL-C与胰岛素抵抗间的关系。另外,脂联素可能是HDL-C与NAFLD之间的另一种潜在的介导因素。既往的研究表明,脂联素可增加血清HDL-C水平,因此脂联素减少可能导致HDL-C的降低[13~15]。对于NAFLD,低血清脂联素已被证明是其进展的一个预测因子。因此另一种可能的机制为,脂联素信号的降低通过腺苷单磷酸活化蛋白激酶的失活、线粒体的生物生成和β-氧化的减少来促进NAFLD的发生[16~18]。
本研究也存在一定的局限性。首先,原始数据中缺乏关于中枢性肥胖、生活方式和饮食因素的人体测量学参数。其次,尽管非肥胖参与者的胰岛素抵抗可能与NAFLD密切相关,但本研究原始设计中并未检查胰岛素水平和胰岛素抵抗情况。最后,尽管肝脏超声具备安全性、经济性和实用性等优点,且在NAFLD的流行病学调查中被广泛使用,但超声检查无法确定NAFLD的严重程度。
综上所述,本队列研究结果表明中国非肥胖人群中HDL-C可作为NAFLD事件发生的保护因素,且HDL-C水平与NAFLD发病存在非线性关系与阈值饱和效应。
