DPN患者周围神经传导速度的影响因素及预测价值分析
2021-11-26梁玲霞李树法
梁玲霞 赵 猛 李树法 李 伟
糖尿病周围神经病变(DPN)是持续的高糖血症通过影响各种代谢途径造成周围神经系统损伤的一种疾病,据统计DPN在糖尿病患者中的发生率已高达60%,成为最常见的慢性并发症之一[1]。临床中DPN常通过相应的临床表现及肌电图检测来进行诊断,但由于患者早期临床症状隐匿不易发觉,且肌电图检查为有创操作,有部分患者不耐受,常因拒绝检查而延误诊疗。本研究旨在通过利用常见临床指标来预测DPN的发生风险,以达到对高危人群进行及早干预的目的。
对象与方法
1.研究对象:选取2018年5月~2019年8月笔者医院内分泌科住院患者为研究对象,198例研究对象中,DPN组患者111例,平均年龄为58.66±11.50岁,病程9(5,15)年;NDPN组患者87例,患者平均年龄为49.64±11.30岁,病程3(0.5,7.0)年。研究对象的纳入标准:①既往明确诊断为T2DM;②诊断时或之后出现肢体疼痛、麻木、感觉异常等神经受损的临床症状;③肌电图中有2条或2条以上周围神经传导速度减慢(上肢周围神经传导速度<45m/s),下肢神经传导速度<40m/s为周围神经传导速度异常)。排除标准:①1型糖尿病(T1DM)、特殊类型糖尿病、继发性糖尿病及妊娠糖尿病者;②既往有自身免疫性疾病者;③并发T2DM酮症酸中毒、非酮症高渗性昏迷等急性并发症者;④电解质紊乱或存在其他内分泌疾患者;⑤近期出现各种急性、慢性重度感染,创伤、手术者;⑥其他病因导致的周围神经病变;⑦资料不全者。
2.研究方法:所有实验室指标均为研究对象晚上10:00时后禁食、禁水,于次日清晨8:00时空腹状态下采集肘窝正中静脉血检测空腹血糖(FBG)、糖化血红蛋白(HbA1c)、空腹C-肽(FC-P)、餐后2h C-肽(2h C-P)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、尿酸(UA)、K+、Na+、尿微量白蛋白(UMA),计算血浆渗透压(POP)=(Na++K+)×2+空腹血糖+尿素氮(mmol/L)。HbA1c由全自动糖化血红蛋白分析仪(瑞士罗氏公司)检测,采用全自动生化分析仪(日本奥林巴斯公司)放射免疫法测定尿微量白蛋白,罗氏Cobase602全自动电化学免疫分析仪检测血糖、血脂、肝、肾功能等。采用笔者医院丹麦Keypoint肌电图诱发电位仪进行周围神经传导速度(NCV)的监测,注意检查前无剧烈运动、无肌肉拉伤等外界因素干扰,在室温21~26℃范围内,由专业人员操作。
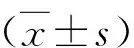
结 果
1.一般临床资料比较:DPN组患者的年龄、病程、FBG、HbA1c、UMA、POP明显高于NDPN组,FC-P、2h C-肽、双侧腓总神经MCV、双侧腓肠神经SCV、正中神经MCV、正中神经SCV低于NDPN组,差异有统计学意义(P<0.05),详见表1。

2.周围神经传导速度的多元线性回归分析:以患者周围神经传导速度为因变量,部分临床指标为自变量进行多元线性回归分析后发现,T2DM患者的年龄、HbA1c、2h C-肽、UMA是周围神经传导速度异常的影响因素,详见表2。

表2 周围神经传导速度的多元线性回归分析
3.影响因素对DPN的预测价值分析:为研究这些影响因素对诊断DPN是否具有预测价值,对其进行ROC曲线分析发现,年龄、HbA1c、2h C-肽、UMA预测DPN的曲线下面积分别为0.700(P=0.000)、0.673(P=0.000)、0.763(P=0.000)、0.651(P=0.000),详见表3、图1。
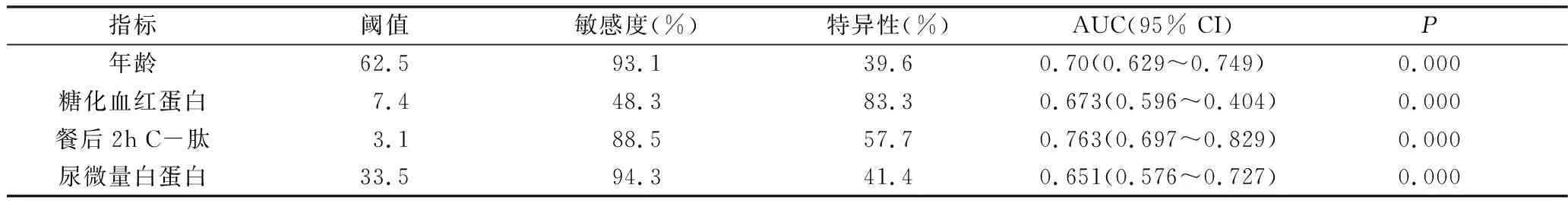
表3 独立危险因素预测DPN的ROC曲线分析

图1 不同危险因素的ROC曲线比较
4.DPN风险预测模型构建及评估:为进一步探究DPN有效的预测因素,现将上述4个影响指标纳入二元Logistic回归分析中发现,年龄、HbA1c、2h C-肽、UMA是DPN发生的独立危险因素。在此基础上,联合独立危险因素构建Logistic回归模型进行DPN风险预测,建立的模型方程为Logit (P)=0.086×年龄+0.143×糖化血红蛋白-0.396×餐后2h C-肽+0.040×尿微量白蛋白-4.987,详见表4。绘制预测P值的ROC曲线显示,预测概率P值AUC为0.86,预测P值截断值为0.70,详见图2。
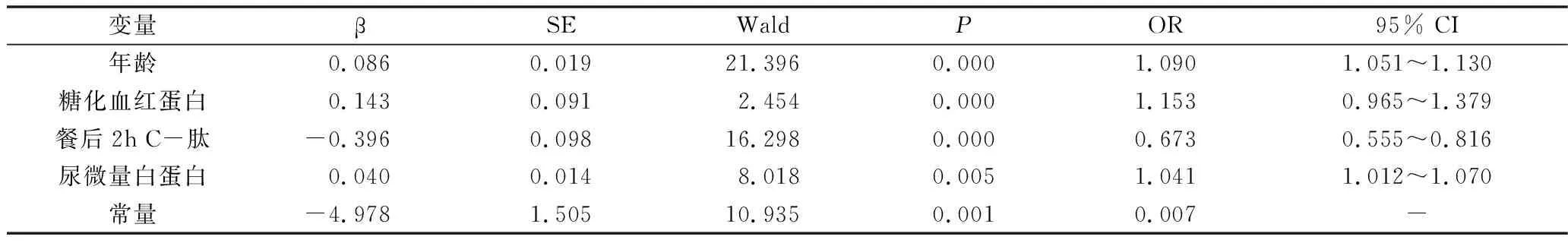
表4 预测模型多因素Logistic回归分析结果

图2 预测模型的ROC曲线
讨 论
我国T2DM的发生率已经从过去的0.67%上升至10.40%,越来越多的人受其及其并发症的影响[3]。DPN作为T2DM最严重、最常见的慢性并发症,治疗不当可直接导致患者残疾或死亡。
在出现周围神经损伤的患者中发现,其感觉神经、运动神经和自主神经等均可受累,其中感觉神经的损害最为明显[4]。本研究在对两组患者的周围神经传导速度进行组间比较分析时发现,DPN组患者的双侧腓肠神经SCV低于NDPN组,且与双侧腓总神经MCV[42(38,45)m/s]比较,双侧腓肠神经SCV[33.5(30,36)m/s]减慢更为显著,这与玛依努尔·买买提明等[5]的研究结果一致。这是因为周围神经的感觉神经处于背根神经节,且纤维直径比运动神经纤维更为纤细,使得各种代谢产物、糖脂毒性物质透过神经-组织屏障更容易对感觉神经造成影响,导致感觉神经最早出现损伤,肌电图检测时表现为神经传导速度的减慢[6]。Hussain等[7]研究发现,在T2DM病程较短的患者中,下肢神经较上肢更早出现异常,尤其以腓肠神经传导速减慢最为显著。腓肠神经容易受损这可能与其解剖位置有关,对于糖尿病这类代谢性疾病,周围神经代谢所需物质本身存在缺乏,而腓肠神经位于肢体末梢,营养物质更为不足,最易受到损害。如若不及时的进行诊断、干预,随着T2DM病程的延长,上肢周围神经也会逐步受累,严重时可影响患者日常生活。
DPN的致病因素较多且发病机制十分复杂,在使用链脲佐菌素诱导发生糖尿病的动物实验中发现,高糖状态下的小鼠大在4周左右就会出现周围神经传导速度的减慢,8周左右出现热痛觉的异常,在血糖控制不佳或未经胰岛素降糖治疗的糖尿病小鼠中神经传导速度的减慢程度更为明显,说明在高糖血症的个体中,神经传导速度的减慢可能要早于相应的临床症状[8]。糖尿病患者体内持续高糖状态通过影响糖脂代谢、氧化应激、炎性反应、神经营养因子、神经免疫等,造成周围神经损伤,在DPN的发生、发展中起到重要影响作用[9]。本研究分析结果显示,FBG、HbA1c是DPN发病的独立危险因素,这在Nie等[10]的研究中也得到证实。在使用HbA1c单独预测或与年龄、2h C-P、UMA联合预测DPN的价值均具有统计学意义,且联合预测效能高于独立危险因素的单独预测价值。
研究发现,T2DM患者体内的血清C-肽水平越低,DPN的临床分期越严重[11]。本研究分析显示DPN组患者的FCP、2h C-肽水平均低于NDPN组,且2h C-肽是DPN发生的独立危险因素,在对T2DM患者预测周围神经损伤中具有一定的参考价值,这说明餐后C-肽水平降低可能会影响T2DM患者出现周围神经病变的发生[12]。同时,在对T1DM患者服用外源性C-肽或C-肽类似物的研究中发现,生理浓度下的C-肽替换治疗可以改善体内多种脏器的功能、结构异常,减轻肢体末梢疼痛超敏的临床症状[13,14]。相关报道指出,血清C-肽水平与糖尿病患者周围神经电流感觉阈值呈负相关[15]。这表明血清C-肽不仅具有保护周围神经,促进C-纤维再生的能力,还可以保持周围神经对外界电刺激的敏感度[16]。
本研究中DPN组患者的UMA水平高于NDPN组,且UMA是DPN发生的独立危险因素,对DPN还具有一定的预测价值。由此分析尿微量白蛋白水平不仅表明肾小球的病变情况,还能反映周围神经的损伤程度,可作为DPN高危人群的筛选指标,并监测其变化。DPN的发病机制与肾脏损伤存在相同途径,T2DM患者体内的高糖血症会增强醛糖还原酶的活性,对周围神经的影响主要是通过生成过量的山梨醇造成神经细胞肿胀,髓鞘保护轴突的萎缩、脱落[17]。同时,过量的山梨醇不能及时转化成果糖参与细胞代谢,造成糖化产物聚集在细胞内,使肾脏的渗透性降低,导致肾脏损伤出现蛋白尿[18]。有实验使用醛糖还原酶抑制剂改善实验性糖尿病动物周围神经的功能和结构,在临床上多使用抗氧化剂延缓DPN的进展,在对出现尿微量白蛋白的糖尿病患者要警惕周围神经损伤的存在[19,20]。
综上所述,DPN的发病机制十分复杂,可受多种因素的影响,对T2DM患者尤其是老年患者要严格控制FBG、HbA1c水平。对不愿接受肌电图检测的糖尿病患者,可以利用年龄、HbA1c、2h C-肽及UMA联合预测并发DPN的风险,对高危患者及早进行干预,通过降糖、降脂等药物治疗,联合优质的饮食习惯,适当的体育运动可延缓周围神经损伤的进展。
