四君子汤合痛泻要方对感染后肠易激综合征肝郁脾虚证小鼠肠道免疫及黏膜屏障功能的影响*
2021-11-25王文峰司会强方妹辉
王文峰,司会强,方妹辉
(珠海市中西医结合医院消化内科,珠海 519000)
肠易激综合征(IBS)是一种反复发作的功能性肠病,以腹胀、腹痛、大便习惯改变为主要症状[1]。其中约有3.7%~36%的IBS患者既往有急性感染性胃肠炎病史,这种在肠道感染后形成的IBS即感染后肠易激综合征(PI-IBS)[2]。目前研究表明,PI-IBS的发生发展与肠道免疫功能异常、肠道通透性改变及肠黏膜低度炎症密切相关[3]。肠道感染所引起的肠黏膜免疫功能异常在PI-IBS发生、发展中发挥重要作用,以辅助性T细胞(Th1)型细胞因子占优势的免疫失衡还可引起肠黏膜紧密连接蛋白下调,导致细胞间通透性增加,加重肠黏膜损伤[4]。PI-IBS可归属于中医“腹痛”“泻泄”等范畴,临床以肝郁脾虚证型最为常见,治疗以抑肝扶脾、祛湿止泻为原则,多用四君子汤合痛泻要方加减[5]。然而,目前PI-IBS的动物模型多以感染细菌、寄生虫进行诱导,中医病证结合动物模型尚缺乏统一的建立标准。本实验在旋毛虫感染NIH小鼠的基础上,采用慢性束缚应激+过度疲劳+饮食失节的复合方法复制小鼠PIIBS肝郁脾虚证模型,应用四君子汤合痛泻要方灌胃治疗,观察其在PI-IBS肝郁脾虚证小鼠急性及慢性感染期中的治疗作用,并探讨其通过调节肠道细胞免疫平衡,保护肠黏膜屏障功能而发挥作用的可能机制。
1 材料与方法
1.1 实验动物 NIH小鼠50只,雄性,SPF级,体质量18~22 g,饲养于清洁级实验动物房中,室内保持12 h光照与黑暗交替。
1.2 实验药物及试剂 旋毛虫活体幼虫购自兰州兽医研究所;四君子汤合痛泻要方组成为党参15 g,茯苓 15 g,白术 15 g,陈皮 10 g,防风 15 g,白芍15 g,枳壳10 g,炙甘草5 g。参照《中药药理实验方法学》换算小鼠灌胃等效剂量为13 g/kg。临用前生理盐水稀释至终浓度为1.3 g/mL,按0.01 mL/g灌胃给药。干扰素(IFN-γ)、白介素-10(IL-10)、白介素-17(IL-17)小鼠酶联免疫吸附实验(ELISA)试剂盒购自北京市福瑞生物工程公司;闭合蛋白(occludin)、紧密粘连蛋白-1(ZO-1)一抗购自Santa Cruz公司;总RNA提取试剂盒、逆转录试剂盒购自TaKaRa公司。
1.3 模型建立 参考肝郁证模型的慢性束缚应激法和脾虚证模型的过度劳累加饥饱失常法[6-7],采用慢性束缚应激+过度疲劳+饮食失节方法建立NIH小鼠肝郁脾虚证模型:实验前全部小鼠进行预游泳,剔除游泳时间少于10 min或大于20 min的小鼠,将合格的造模小鼠每日上午8∶00放置于束缚盒中3 h限制活动,每日下午2∶00放置于盛水塑料桶[水温(22±1)℃]中游泳 10 min。隔日喂食,连续3周,观察1周。旋毛虫感染制备PI-IBS模型:于实验第5周应用旋毛虫感染小鼠,每只小鼠灌胃含400~500个旋毛虫幼虫的0.9%生理盐水0.2 mL,感染后2周为急性感染期,感染8周后为PI-IBS期,肠道无明显炎症,内脏敏感性明显增高为造模成功。
1.4 分组与给药 将NIH小鼠随机分为空白组、感染2周组、感染8周组、2周治疗组、8周治疗组,共5组,每组10只。除空白组外,其余各组小鼠采用慢性束缚应激+过度疲劳+饮食失节+旋毛虫感染建立PI-IBS肝郁脾虚证模型,感染2周组、感染8周组除造模外不予其他干预,以感染后2周、8周为时间点处死小鼠用作实验;2周治疗组于感染2周后给予四君子汤合痛泻要方灌胃治疗6周;8周治疗组于感染8周后给予四君子汤合痛泻要方灌胃治疗6周;空白组正常饲养,不做任何处理。
2 观察指标
2.1 一般状况及临床表征观察 参考肝郁脾虚证实验动物模型相关特点[8]观察并记录小鼠主要表现:毛发疏松,毛色枯焦无光,乏力,倦怠,喜扎堆,弓背等一般状态改变;伴随情绪不稳,灌胃抵抗,易怒,兴奋程度减低,饮食饮水量减少,大便不成形,便质稀溏等变化。
2.2 内脏敏感性检测 小鼠实验前禁食不禁水24h,经乙醚麻醉后,将带气囊的导管经小鼠肛门插入约2 cm,待小鼠适应30 min后开始检测。向气囊内随机注入空气,达到目标容量后持续20 s,观察腹壁回撤反应(AWR)并进行评分,每一容量下重复3次,取平均值。由0.25 mL开始,随后每隔5 min分别递增至0.35、0.5、0.65 mL。AWR评分标准:扩张时无反应者记为0分;扩张时出现轻微头部运动,而身体无反应者记为1分;扩张时腹部肌肉收缩而未抬离桌面者记为2分;扩张时腹部肌肉收缩且抬离桌面者记为3分;扩张时身体呈弓形,骨盆抬起者记为4分。
2.3 粪便含水百分数检测 连续收集各组小鼠8 h粪便,称取每只小鼠每隔2 h的粪便质量,随后将粪便置于65℃烘箱中过夜干燥,再次称量粪便干质量,计算小鼠粪便含水百分数。
2.4 肠道组织病理学观察 各组小鼠摘眼球取血并处死,解剖后取部分末端回肠、近端结肠组织,生理盐水冲洗去除肠内容物,于4%多聚甲醛中固定,石蜡包埋,切片机5 μm切片后进行苏木精-伊红(HE)染色,中性树胶封片,光学显微镜观察结肠组织病理形态改变,并对各组小鼠进行组织病理学评分。评分标准:固有层未见中性粒细胞浸润,间质无明显水肿为正常,记为0分;固有层仅见少量中性粒细胞浸润,间质轻度水肿为轻度,记为1分;固有层可见中等量的中性粒细胞浸润,间质呈中度水肿为中度,记为2分;固有层及整个黏膜层可见大量中性粒细胞浸润,间质重度水肿或坏死为重度,记为3分。
2.5 血清细胞因子含量检测 采用ELISA法检测小鼠血清中IL-10、IFN-γ、IL-17细胞因子水平。各组小鼠眼球取血,3 000 r/min,离心15 min,离心半径8 cm,分离血清,设置空白孔、标准孔和样本孔,标准品孔按标准品不同浓度各加入50 μL;样品孔加入血清样品 10 μL,样品稀释液 40 μL,空白孔不加;标准孔和样本孔各加入辣根过氧化物酶(HRP)标记的抗体100 μL,空白孔不加,封板膜封住反应孔后,置于37℃恒温箱中孵育1 h;弃去液体,洗板6次,每次 1 min,每孔加入显色液 A、B 各 50 μL,37℃避光孵育15 min,加入终止液50 μL,于酶标仪450 nm下检测各反应孔OD值,做标准曲线,计算各样本IL-10、IFN-γ、IL-17 含量。
2.6 肠道组织中IL-10、IFN-γ、IL-17的mRNA表达检测 取各组小鼠结肠组织,采用Trizol法提取组织总RNA,紫外分光光度仪测定总RNA浓度并逆转录为cDNA,再进行PCR扩增,以β-actin为内参。反应条件:95℃预变性5 min 1个循环,95℃变性10 s,退火温度60℃30 s,扩增40个循环,最后72 ℃延伸 7 min,56 ℃ 30 s。结果以 2-ΔΔCt法分析 IL-10、IFN-γ、IL-17的相对 mRNA 表达量。

表1 各基因引物序列Tab.1 Primer sequence of each gene
2.7 肠道组织中occludin、ZO-1的蛋白表达检测 取各组小鼠结肠组织,匀浆后加入RIPA裂解液提取总蛋白,BCA法测定蛋白浓度。加入10 μL蛋白样品,电泳分离,冰上转膜,室温封闭2 h,occludin、ZO-1一抗4℃孵育过夜,二抗室温孵育2 h,滴加显影液,凝胶成像并拍照后用Image J软件进行定量分析。
2.8 统计学方法 采用SPSS 20.0软件进行分析,数据以均值±标准差(±s)表示,多组数据采用单因素方差分析比较,组间两两比较采用LSD检测。P<0.05为差异有统计学意义。
3 结果
3.1 一般状况及临床表征变化 空白组小鼠精神状态正常,动作灵活,毛色光泽,不喜扎堆,进食及饮水量正常,二便正常,粪便呈球形,干湿适中。感染2周组小鼠出现易怒表现,灌胃时剧烈抵抗,毛发竖立,少动喜聚集,饮食及饮水量减少,大便稀溏不成形。感染8周后小鼠情绪逐渐转为低落,毛发枯乱无光,喜聚集,大便质地稀溏,较感染2周时稍干。2周治疗组、8周治疗组小鼠精神状态及大便形态较治疗前均有明显改善,小鼠毛发整齐,恢复光泽,时喜扎堆,饮食及饮水量较前增多,大便呈球型。
3.2 各组小鼠AWR评分比较 各组小鼠的AWR评分均随着气囊内空气体积的增加而增高。当注入空气体积为0.35 mL和0.5 mL时,感染后2周及感染后8周组小鼠AWR评分较空白组显著升高(P<0.05),2周治疗组、8周治疗组小鼠评分明显低于感染后2周及感染后8周组(P<0.05)。注入空气体积为0.25 mL和0.65 mL时,各组小鼠AWR评分无统计学差异(P>0.05)。见表 2。
表2 各组小鼠AWR评分比较(±s)Tab.2 Comparison of AWR scores of mice in each group(±s) 分
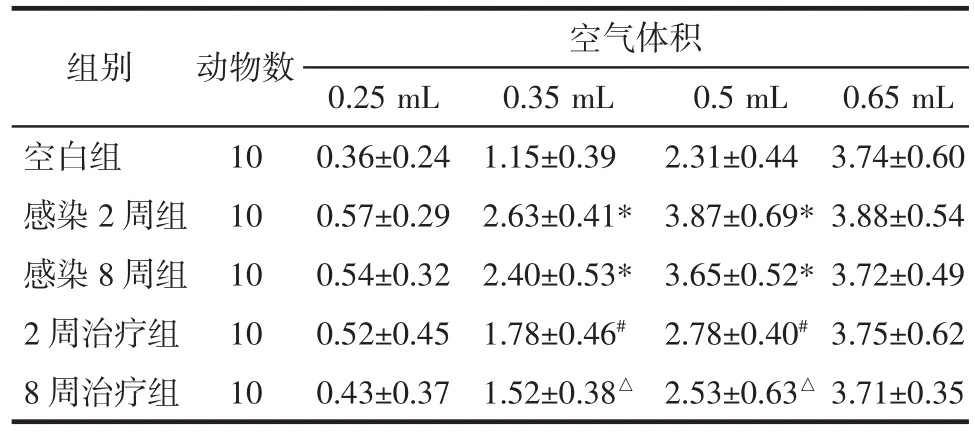
表2 各组小鼠AWR评分比较(±s)Tab.2 Comparison of AWR scores of mice in each group(±s) 分
注:与空白组比较,*P<0.05;与感染 2 周组比较,#P<0.05;与感染 8 周组比较,△P<0.05。
组别 动物数 空气体积0.25 mL 0.35 mL 0.5 mL 0.65 mL空白组 10 0.36±0.24 1.15±0.39 2.31±0.44 3.74±0.60感染 2周组 10 0.57±0.29 2.63±0.41* 3.87±0.69*3.88±0.54感染 8 周组 10 0.54±0.32 2.40±0.53* 3.65±0.52*3.72±0.49 2 周治疗组 10 0.52±0.45 1.78±0.46# 2.78±0.40#3.75±0.62 8 周治疗组 10 0.43±0.37 1.52±0.38△ 2.53±0.63△ 3.71±0.35
3.3 各组小鼠粪便含水百分数比较 与空白组相比,感染2周组及感染8周组小鼠每2 h粪便含水百分数均显著增高(P<0.05),2周治疗组小鼠每2 h粪便含水百分数较感染后2周组明显降低,8周治疗组每2 h粪便含水百分数较感染后8周组明显降低(P<0.05)。见表 3。
表3 各组小鼠粪便含水百分数比较(±s)Tab.3 Comparison of water content in feces of mice in each group(±s)%
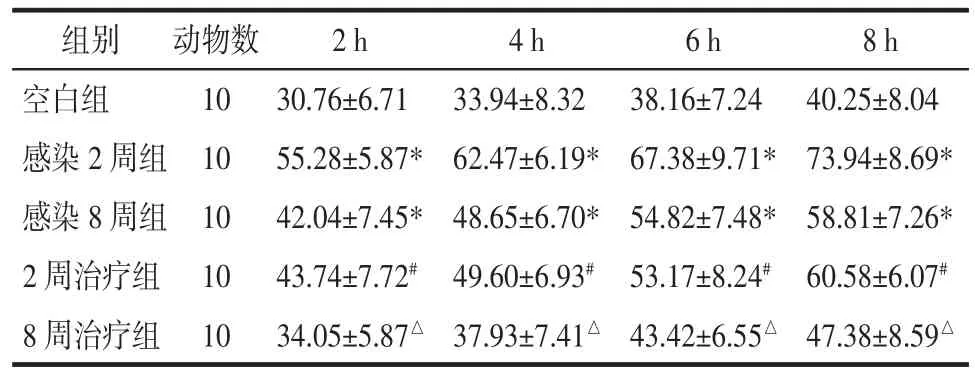
表3 各组小鼠粪便含水百分数比较(±s)Tab.3 Comparison of water content in feces of mice in each group(±s)%
注:与空白组比较,*P<0.05;与感染 2 周组比较,#P<0.05;与感染 8 周组比较,△P<0.05。
组别 动物数 2 h 4 h 6 h 8 h空白组 10 30.76±6.71 33.94±8.32 38.16±7.24 40.25±8.04感染 2 周组 10 55.28±5.87* 62.47±6.19* 67.38±9.71* 73.94±8.69*感染 8 周组 10 42.04±7.45* 48.65±6.70* 54.82±7.48* 58.81±7.26*2 周治疗组 10 43.74±7.72# 49.60±6.93# 53.17±8.24# 60.58±6.07#8周治疗组 10 34.05±5.87△ 37.93±7.41△ 43.42±6.55△ 47.38±8.59△
3.4 各组小鼠肠道组织病理学变化 见图1。HE染色结果可见,空白组小鼠回肠、结肠黏膜各层结构完整,黏膜下未见炎细胞浸润。感染2周组小鼠回肠、结肠组织染色显示明显炎症性改变,可见黏膜结构严重受损,黏膜及黏膜下层明显充血、水肿及炎性细胞浸润,组织病理学评分明显高于空白组(P<0.05)。而感染8周组小鼠回肠、结肠组织未见明显炎性损伤及炎症细胞浸润,病理学评分与空白组比较无统计学差异(P>0.05)。经2周治疗组灌胃治疗后,小鼠回肠、结肠组织损伤明显减轻,黏膜结构基本恢复,炎性细胞浸润较感染2周组显著减少,病理学评分明显低于感染2周组(P<0.05)。感染8周组小鼠回肠、结肠组织未见明显炎性损伤,病理学评分与空白组比较无统计学差异(P>0.05)。

图1 各组小鼠肠组织病理改变(HE染色,×200)Fig.1 Pathological changes of intestinal tissue in mice of each group(HE staining,×200)
3.5 各组小鼠血清中IL-10、IFN-γ、IL-17细胞因子含量比较 与空白组比较,感染2周组、感染8周组小鼠血清中IFN-γ及IL-17的含量均显著升高,IL-10的含量显著降低(P<0.05)。2周治疗组、8周治疗组小鼠血清中IFN-γ、IL-17水平明显低于感染后 2周及感染后 8周组(P<0.05),IL-10水平较感染后2周及感染后8周组明显升高(P<0.05)。见表4。
表4 各组小鼠血清中IL-10、IFN-γ、IL-17含量比较(±s)Tab.4 Comparison of IL-10,IFN-γ and IL-17 in serum of mice in each group(±s)ng/mL

表4 各组小鼠血清中IL-10、IFN-γ、IL-17含量比较(±s)Tab.4 Comparison of IL-10,IFN-γ and IL-17 in serum of mice in each group(±s)ng/mL
注:与空白组比较,*P<0.05;与感染 2 周组比较,#P<0.05;与感染8 周组比较,△P<0.05。
组别 动物数 IL-10 IFN-γ IL-17空白组 10 25.34±6.07 19.38±4.15 9.58±2.64感染 2 周组 10 11.21±4.92* 45.86±7.46* 24.87±6.90*感染 8 周组 10 15.46±7.94* 38.59±6.05* 18.83±8.47*2 周治疗组 10 18.39±7.05# 30.19±8.65# 16.09±5.71#8 周治疗组 10 20.75±5.26△ 25.63±6.94△ 12.55±4.86△
3.6 肠道组织中IL-10、IFN-γ、IL-17的mRNA表达 与空白组相比,感染2周组、感染8周组小鼠结肠组织中IFN-γ及IL-17的mRNA表达显著增加,IL-10的mRNA表达显著减少(P<0.05)。2周治疗组、8周治疗组IFN-γ及IL-17的mRNA表达较感染后 2周及感染后 8周组明显减少(P<0.05),IL-10的 mRNA 表达明显上调(P<0.05)。见表 5。
表5 各组小鼠结肠组织中IL-10、IFN-γ、IL-17 mRNA比较(±s)Tab.5 Comparison of IL-10,IFN-γ and IL-17 mRNA in colon tissue of mice in each group(±s)
注:与空白组比较,*P<0.05;与感染 2 周组比较,#P<0.05;与感染 8 周组比较,△P<0.05。
组别 动物数 IL-10 IFN-γ IL-17空白组 10 1.01±0.01 1.01±0.01 1.01±0.01感染 2 周组 10 0.25±0.13* 3.33±0.51* 3.26±0.47*感染 8 周组 10 0.38±0.42* 2.99±0.36* 2.53±0.30*2 周治疗组 10 0.49±0.24# 1.71±0.28# 1.89±0.23#8周治疗组 10 0.62±0.17△ 0.31±0.25△ 1.42±0.15△
3.7 各组小鼠肠道组织中occludin、ZO-1的蛋白表达情况比较 感染后2周组小鼠结肠组织中occludin、ZO-1的蛋白表达较空白组显著降低(P<0.05),至感染8周后表达有所增强,但仍显著低于空白组(P<0.05)。2 周治疗组、8 周治疗组 occludin、ZO-1的蛋白表达较感染2周及感染8周组显著增多(P<0.05)。见图 2。

图2 各组小鼠结肠组织中occludin、ZO-1的蛋白表达情况Fig.2 Protein expression of occludin and ZO-1 in mouse colon
4 讨论
PI-IBS常可见肠道免疫功能异常,炎性细胞因子分泌增多,肠黏膜低度炎症等病理改变。研究表明[9-10],PI-IBS患者肠黏膜处于免疫激活状态,黏膜内T淋巴细胞及炎性细胞因子分泌增多,这些炎性因子的过度分泌能够刺激肠道神经系统,引起内脏高敏感性,继而导致腹痛及大便习惯的改变。促炎和抗炎细胞因子的平衡失调能够影响肠道生理和免疫功能,从而导致PI-IBS症状出现。如辅助性T细胞亚群Th1释放IFN-γ等促炎细胞因子以促进炎症反应,IFN-γ的过度升高可破坏肠上皮细胞,使黏膜屏障功能受损,肠道紧密连接通透性增加[11-12]。Th2细胞表达IL-10等抑炎因子以调节自身免疫,防止过度炎症反应,IL-10的减少能够引起促炎和抗炎机制的平衡失调,导致肠道慢性炎症[13]。而由Th17细胞所分泌的IL-17能够诱导自身免疫,IL-17与IFN-γ还能发挥协同效应,促进肠道黏膜炎症反应[14]。肠上皮间的紧密连接蛋白在保护肠黏膜屏障功能,调节肠道通透性中起着关键作用[15]。研究表明[4],肠道感染所引起的以Th1型细胞占主导的免疫失衡可能引起肠黏膜紧密连接蛋白的表达下调,导致细胞紧密连接结构受损,细胞间通透性增加,加重肠黏膜损伤。Occludin具有细胞旁屏障功能,能够封闭细胞间隙,形成细胞间紧密连接的基础结构。ZO-1被看作紧密连接的桥梁蛋白,有连接跨膜蛋白和细胞骨架蛋白的作用。其表达水平的变化可作为观察黏膜屏障功能与细胞通透性的指标[16-17]。
PI-IBS可归属于中医“腹痛”“泻泄”等范畴,其病位在肠,脾虚湿困为病机关键,同时与肝、肾等脏腑功能失调密切相关。肝郁脾虚证为PI-IBS最常见的临床证型,可占50%以上[5]。多因饮食不节、七情内伤等导致气机不利,肝郁气滞,肝气横逆侮脾,脾胃受损,升降失职,致小肠清浊不分,水谷相杂并走大肠而成泄泻。治疗以抑肝扶脾、祛湿止泻为原则,有效方剂多用四君子汤合痛泻要方加减[18]。方中党参甘温入脾,健脾益胃,白术苦温,健脾同时亦可燥湿,共为君药;白芍酸甘而微寒,既可养阴柔肝,合甘草又有缓急止痛之效,为臣药;茯苓渗湿补脾,促脾之运化,陈皮、枳壳疏肝理气,使补而不滞,共为佐药;防风有升发之性,合陈皮能散肝郁而舒脾气,为佐使药;使以炙甘草甘温和中,调和诸药。全方合用,共奏泻肝补脾、祛湿止泻之效。
目前PI-IBS的动物模型多以感染细菌、寄生虫进行诱导,而中医病证结合动物模型尚缺乏统一的建立标准。本实验在旋毛虫感染NIH小鼠的基础上,借鉴肝郁证[6]及脾虚证[7]实验动物模型的制备方法,采用慢性束缚应激+过度疲劳+饮食失节的复合方法复制小鼠PI-IBS肝郁脾虚证模型,应用四君子汤合痛泻要方灌胃治疗,观察其在PI-IBS肝郁脾虚证小鼠急性及慢性感染期中的作用。实验结果显示,感染2周组小鼠出现易怒表现,排便次数增加、大便稀溏不成形,至感染8周后,小鼠情绪逐渐转为低落,大便质地较感染2周时稍干。形态学结果可见,感染后2周小鼠肠道处于急性炎症期,回肠、结肠组织均可见明显炎性损伤;至感染后8周,小鼠肠黏膜炎症消退,组织形态未见明显异常,提示此时旋毛虫一过性感染导致的肠道感染在病理学上己基本恢复,和人类PI-IBS病变类似。而感染8周组小鼠AWR评分及粪便含水百分数较空白组仍显著增高,提示小鼠内脏高敏感性和肠动力功能异常仍然存在,说明实验造模成功。四君子汤合痛泻要方给药治疗后,感染2周组小鼠结肠、回肠组织病理损伤明显减轻,感染后2周、8周组小鼠AWR评分及粪便含水百分数显著改善,提示四君子汤合痛泻要方在旋毛虫感染所致PI-IBS急性及慢性感染期中均具有明显的治疗作用。ELISA及RT-PCR结果均显示,感染后2周、8周组小鼠血清及结肠组织中IFN-γ和IL-17的表达明显升高,IL-10的表达降低。IFN-γ和IL-17水平的升高能够抑制IL-10的表达水平,导致肠道免疫系统持续活化,可能是造成PI-IBS小鼠症状持续存在的原因之一[19]。四君子汤合痛泻要方干预后,小鼠血清及结肠组织中IFN-γ、IL-17的表达均明显降低,同时上调了IL-10的表达,说明四君子汤合痛泻要方能够调节旋毛虫感染所引起的免疫失衡,从而改善PI-IBS小鼠症状。感染后2周组小鼠结肠组织中occludin和ZO-1的蛋白表达显著降低,至感染后8周组表达有所增强,但仍显著低于空白组,提示在旋毛虫感染建立的PI-lBS模型中存在肠黏膜紧密连接蛋白的异常变化。经四君子汤合痛泻要方干预后,occludin、ZO-1的表达较治疗前明显增高,提示四君子汤合痛泻要方治疗能够上调肠黏膜紧密连接蛋白的表达,保护肠黏膜屏障功能。
综上所述,本研究表明四君子汤合痛泻要方对PI-IBS肝郁脾虚证小鼠急性及慢性感染期均具有明显的治疗作用,其机制可能是通过调节肠道细胞因子免疫失衡,从而恢复肠黏膜紧密连接蛋白的表达水平,保护肠黏膜屏障功能,降低肠黏膜通透性,改善PI-IBS小鼠症状。
