CT表现及血清指标预测免疫/靶向治疗对中晚期肝细胞癌的效果
2021-11-24谷小磊李海蛟李晓婷曲金荣黎海亮孙应实
韩 帅,谷小磊,李海蛟,李晓婷,曲金荣,黎海亮,崔 湧*,孙应实
(1.郑州大学附属肿瘤医院 河南省肿瘤医院放射科,河南 郑州 450008;2.北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
肝细胞癌(hepatocellular carcinoma,HCC)早期不易发现,70%~80%患者临床首诊时已为中晚期,失去手术根治机会。肿瘤免疫治疗及靶向治疗迅速发展,已在多种实体肿瘤中取得较好效果[1]。炎症是肿瘤发生和进展的原因之一,炎症反应标志物如血小板计数、中性粒细胞数/淋巴细胞数比值(neutrophil-lymphocyte ratio,NLR)、血小板数/淋巴细胞数比值(platelet-lymphocyte ratio,PLR)、白蛋白/纤维蛋白原比值(albumin-fibrinogen ratio, AFR)为预测多种恶性肿瘤预后的指标[2-3]。本研究评估根据治疗前CT表现及血清指标预测免疫/靶向治疗对中晚期HCC的效果的价值。
1 资料与方法
1.1 一般资料 回顾性收集2017年4月—2020年9月50例于北京大学肿瘤医院就诊的中晚期HCC患者,男44例,女6例,年龄32~71岁,平均(55.2±8.7)岁。纳入标准:①经穿刺活检组织病理学诊断HCC;②不适于手术及局部治疗;③接受免疫/靶向规律治疗≥6个月;④分别于治疗前1周内及开始治疗8周后接受腹部CT检查及血清检查,至少存在一个长径>10 mm病灶。排除标准:①接受其他类型治疗;②CT图像质量差;③伴明确感染性病变。其中20例为初诊,7例为HCC切除术后复发,12例HCC切除术后复发后介入治疗失败,11例HCC介入治疗失败;巴塞罗那分期B期8例、C期42例;34例伴肝硬化,38例有肝炎病史(3例丙型肝炎,35例乙型肝炎)。19例接受靶向药物治疗(索拉非尼),24例接受免疫+靶向药物治疗(信迪利单抗+仑伐替尼等),7例接受免疫治疗(PD-1等)。
1.2 仪器与方法 采用GE Lightspeed 64 VCT或Discovery CT750 HD仪行腹部扫描。嘱患者仰卧,扫描范围自膈顶至腹主动脉分叉处,管电压120 kV,自动管电流,螺距0.984,准直器宽度5 mm,层厚5 mm。采用高压注射器经肘正中静脉以流率3.0 ml/s注射对比剂碘海醇(300 mgI/ml)1.5 ml/kg体质量,之后分别延迟30、70、100 s行动脉期、门静脉期及延迟期扫描。
由2名具有8年以上腹部影像学诊断经验的主治及副主任医师分析图像,确定靶病灶,即可测量病灶,存在多个靶病灶时针对最大者进行分析[4];意见分歧时与另1名具有20年以上影像学诊断经验的主任医师讨论后决定。观察靶病灶CT表现,包括肿瘤形态(不规则/圆形或类圆形)、边界(清楚/模糊)、动脉期强化方式(均匀/不均匀)、强化程度[高强化(动脉期肿瘤强化区域CT值增加>40 HU)及非高强化(动脉期肿瘤强化区域CT值增加≤40 HU)]、肿瘤是否邻近肝被膜、肿瘤包膜(指延迟期图像中包绕肿瘤的线性增强结构,分为完整、包膜不完整/无包膜)及是否伴肿瘤血管和有无腹腔积液,并测量肿瘤长径及最大截面面积。以半自动测量软件测量肿瘤总体积及坏死体积,坏死比为肿瘤坏死体积/肿瘤总体积,肿瘤强化率=[肿瘤强化期(动脉期、静脉期)CT值—平扫CT值]/平扫CT值。
根据改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors,mRECIST)评价疗效,分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)及疾病进展(progressive disease, PD),并据此将患者分为控制组(CR+PR+SD,n=40)和进展组(PD,n=10)。根据治疗前血清指标计算NLR、PLR及AFR。
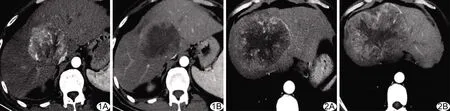
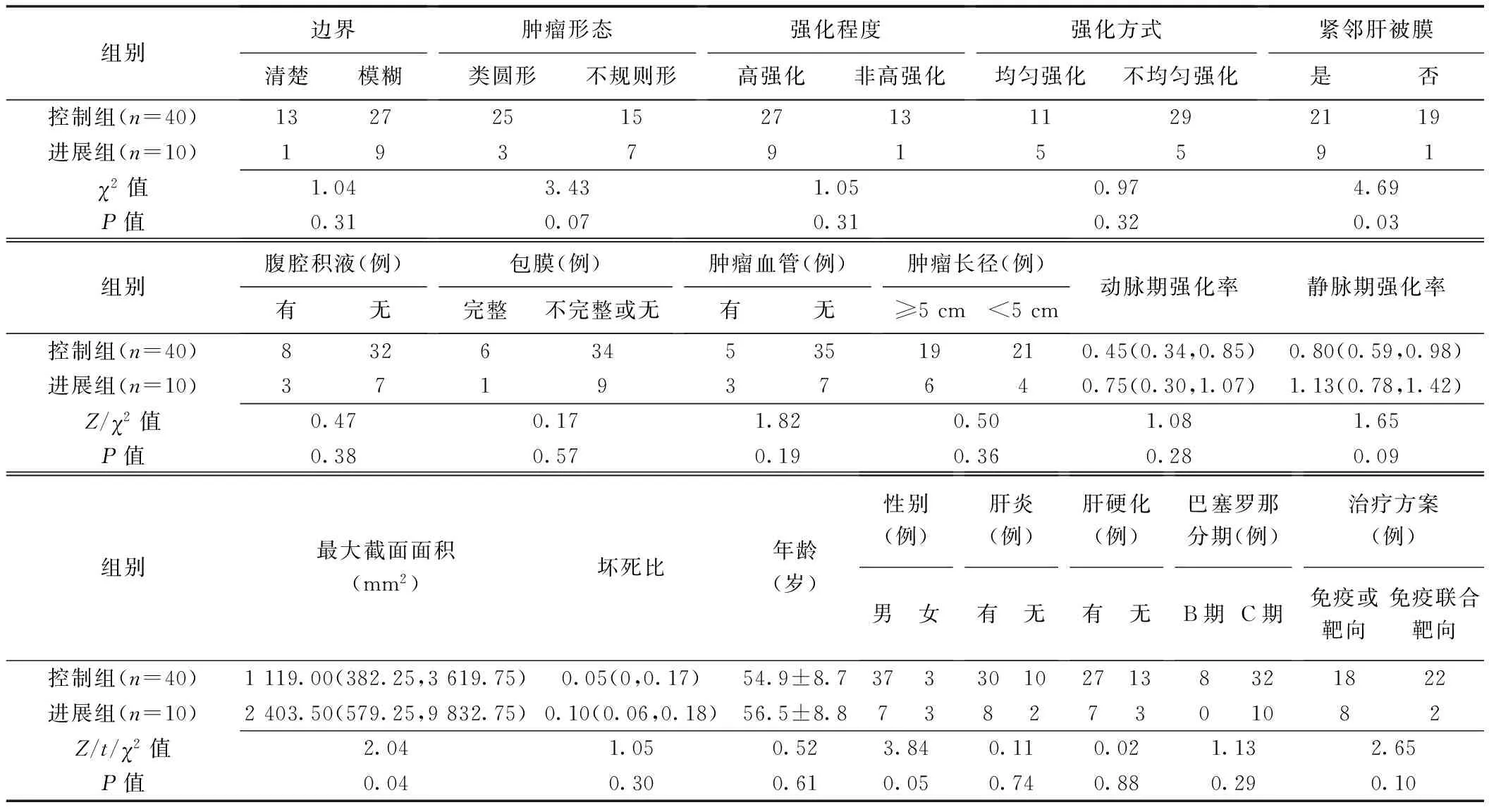
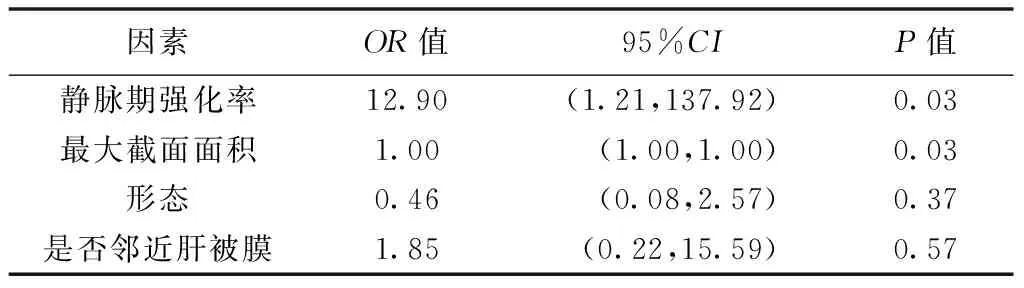
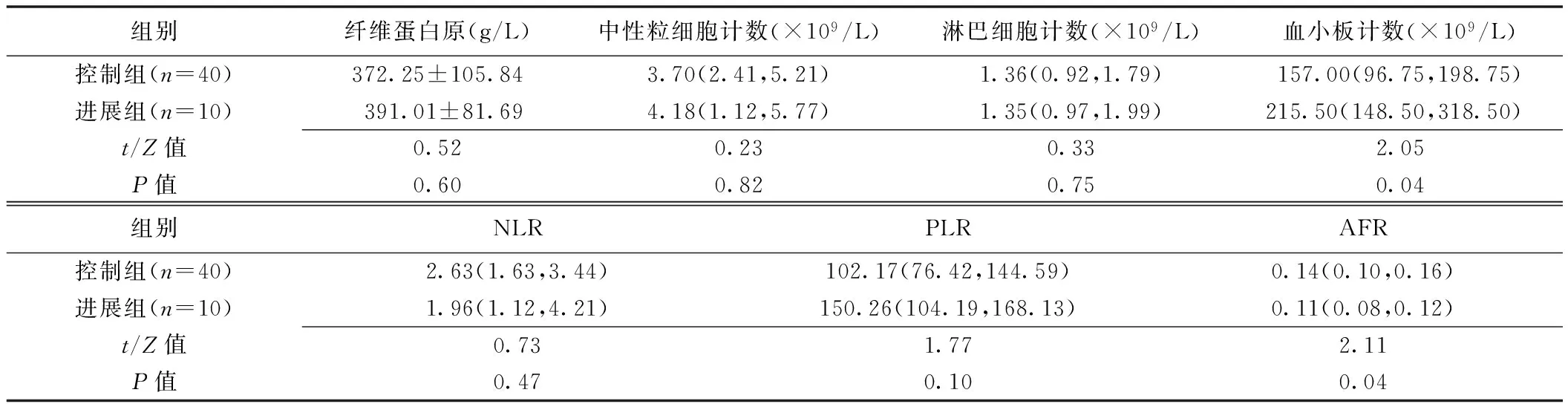
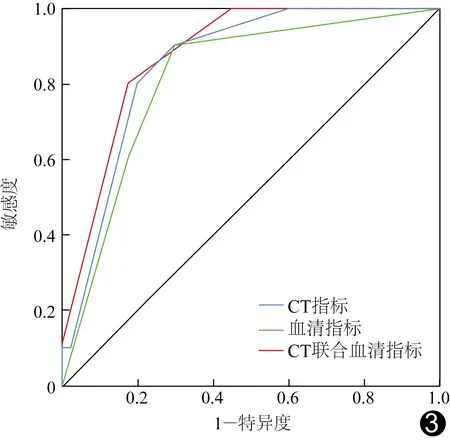
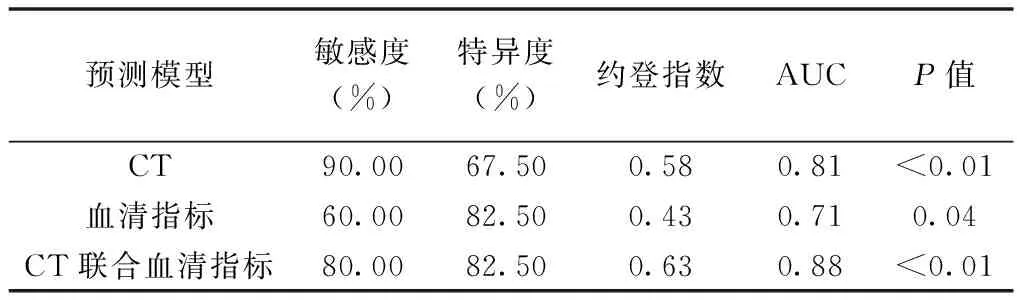
1.3 统计学分析 采用SPSS 18.0统计分析软件。以χ2检验比较计数资料。以±s表示符合正态分布的计量资料,行t检验;不符合者以中位数(上下四分位数)表示,行Mann-WhitneyU检验。对结果进行观察者间一致性评估:以组内相关系数(intra-class correlation coefficient, ICC)评估计量资料,ICC<0.50为一致性差,0.50≤ICC<0.75为一致性一般,ICC>0.75为一致性好;以Kappa检验评估计数资料,0 采用多因素Logistic回归建立免疫/靶向治疗对HCC疗效的预测模型,将单因素分析结果显示P<0.1的CT征象纳入Logistic回归分析,以ROC曲线分析模型的效能,计算相应曲线下面积(area under the curve, AUC),并以DeLong检验比较其差异。P<0.05为差异有统计学意义。 2.1 CT表现与临床资料比较 本组50例中晚期HCC的CT表现与临床资料比较见表1及图1、2。观察者间分析计量资料结果的一致好(ICC=0.97,P<0.01),测量计数资料结果的一致性极高(Kappa=0.89,P=0.04)。相比进展组,控制组肿瘤多邻近肝被膜,最大截面积较小(P均<0.05)。 图1 患者男,39岁,HCC(控制组) A.治疗前增强动脉期CT图示肝内S4与S8交界处肿块不均匀强化,伴肿瘤血管,最大截面面积为3 604 mm2;B.治疗后增强动脉期CT示肿块体积增大,强化范围缩小,强化程度减低 图2 患者男,47岁,HCC(进展组) A.治疗前增强动脉期CT图示肝内S4、S7、S8交界处肿块不均匀强化,伴坏死,最大截面面积为9 823 mm2;B.治疗后增强动脉期CT示肿块增大,强化范围增大 表1 免疫/靶向治疗前HCC的CT表现与临床资料比较(例,n=50) 静脉期强化率及最大截面积预测HCC治疗疗效的最佳截断值分别为1.11、5 594.50 mm2。CT肿瘤形态、是否邻近肝被膜、静脉期强化率及最大截面面积组间差异具有统计学意义(P<0.1),将其纳入Logistic回归分析,结果显示最大截面面积、静脉期强化率是免疫/靶向治疗对HCC疗效的独立预测因素(P均<0.05,表2)。 表2 多因素Logistic回归分析预测免疫/靶向治疗对50例中晚期HCC疗效 2.2 血清指标与免疫/靶向治疗效果的关系 控制组与进展组间血小板计数、AFR差异均有统计学意义(P均<0.05),其余血清指标差异均无统计学意义(P均>0.05),见表3。 表3 免疫/靶向治疗前HCC患者血清指标比较(n=50) 2.3 血清指标多因素回归分析 ROC曲线显示,血小板计数及AFR预测免疫/靶向治疗对中晚期HCC疗效的最佳截断值分别为211.50×109/L及0.14。Logistic回归分析结果显示,血小板计数是疗效的独立预测因素[OR(95%CI)=7.07(1.57,31.86),P<0.05]。 2.4 预测模型的ROC曲线分析 建立CT(静脉期强化率、最大截面面积)、血清指标(血小板计数)及联合预测模型,其AUC分别为0.81、0.71和0.88(P均>0.05),而联合模型的诊断特异度高于CT模型、敏感度高于血清指标模型,见表4及图3。 图3 3种模型预测免疫/靶向治疗HCC效果的ROC曲线 表4 CT、血清指标及联合预模型预测免疫/靶向治疗对HCC疗效的ROC曲线分析 HCC发生、发展是多因素、多步骤作用的结果[5-6]。肿瘤体积越大,异质性越明显,预后趋向不良[7-8]。增强CT强化值能反映肿瘤细胞微血管的生成情况[9]。本研究将肿瘤长径及最大截面面积纳入分析,发现治疗前组间最大截面面积差异有统计学意义;将单因素分析中P<0.1的因素纳入Logistic回归分析,发现最大截面面积及静脉期强化率是免疫/靶向治疗对HCC疗效的独立预测指标,提示相比肿瘤长径,最大截面面积预测疗效的准确性更高,且增强静脉期CT值较动脉期更能反映肿瘤内部血供情况[10]。 炎症指标与肿瘤疾病进展及不良预后相关[11]。血小板计数高者HCC肝外转移风险更高[12],且与多种癌症预后较差相关[13]。有学者[14]观察310例软组织肉瘤,发现AFR能比单一纤维蛋白原或白蛋白更好地预测预后。本组进展组治疗前血小板计数明显高于控制组,而FAR明显低于控制组,且血小板计数是预测疗效的独立因素;分析治疗前血清指标及CT表现可初步预测疗效,有助于临床调整治疗方案。建立CT、血清指标及其联合预测模型,ROC曲线分析结果其间整体及两两比较AUC差异均无统计学意义,可能与样本量小、组间病例数差异较大及治疗方案不完全统一有关;但联合模型的诊断特异度高于CT模型、敏感度高于血清指标预测模型,提示联合CT及血清学指标可能有助于提高预测效能,有待扩大样本量进一步观察。 综上所述,治疗前CT表现及血清学指标均有助于预测免疫/靶向治疗对中晚期HCC的效果,二者联合可能有助于提高预测效能。2 结果
3 讨论
