lncRNA SNHG15-210通过上调CDKN1A对宫颈癌SIHA细胞增殖的影响
2021-11-22鲍群丽万淑琼黄耿汪宏良柯俊尚小玲鄂东医疗集团黄石市中心医院湖北理工学院附属医院检验科45000鄂东医疗集团黄石市中心医院湖北理工学院附属医院妇科45000鄂东医疗集团黄石市中心医院湖北理工学院附属医院泌尿外科45000
鲍群丽 万淑琼 黄耿 汪宏良 柯俊 尚小玲鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)检验科 45000;鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)妇科 45000;鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)泌尿外科 45000
宫颈癌是世界上女性发病率较高的恶性肿瘤之一,复发率高且较易转移,严重威胁女性健康[1]。研究宫颈癌的发病机制,为宫颈癌治疗提供有效的分子靶点是目前临床和基础研究的热点。长链非编码RNA(lncRNA)是一类非编码单链RNA,长度超过200个核苷酸[2]。lncRNA在肺癌、膀胱癌、宫颈癌、黑色素瘤等各种肿瘤中表达上调或下调,与肿瘤细胞的分化、增殖、侵袭等行为有关[3]。研究发现,SNHG15-210是一种由953个核苷酸组成的lncRNA,其在甲状腺癌中发挥抑癌因子作用[4]。SNHG15-210对宫颈癌细胞的作用尚未明了。本研究主要研究SNHG15-210对宫颈癌细胞增殖的影响及其作用机制,以期为宫颈癌的靶向治疗提供新的方向。
1 材料与方法
1.1 细胞与主要试剂 宫颈癌细胞SIHA购于中国科学院典型培养物保藏委员会细胞库;CCK-8试剂盒购于上海生工生物工程股份有限公司;DMEM培养基购于美国Gibco公司;pcDNA-NC、pcDNA-SNHG15-210质粒购于上海吉玛制药技术有限公司;实时荧光定量逆转录聚合酶链反应(qRT-PCR)试剂盒购于大连宝生物公司;Opti-MEM培养基、Lipofectamine 3000购于美国Life Technologies公司;结晶紫购于美国Sigma公司;一抗、辣根过氧化物酶标记的免疫球蛋白G(IgG)二抗购于美国CST公司。
1.2 细胞培养和转染 将SIHA细胞培养于含10%胎牛血清的DMEM培养基,置于37℃、5%CO2培养箱内。将对数生长期SIHA细胞接种于24孔板,根据Lipofectamine 3000试剂说明书将pcDNA-NC、pcDNA-SNHG15-210质粒转染入SIHA细胞,分别记为NC组和SNHG15-210组,转染48 h后检测各组细胞的转染效率。
1.3 qRT-PCR检测SNHG15-210、细胞周期蛋白依赖蛋白激酶抑制剂1A(CDKN1A)信使RNA(mRNA)表达 采用TRIzol试剂提取SIHA细胞RNA,合成cDNA后按照qRT-PCR试剂盒说明书进行反应,引物序列如下。CDKN1A引物正向序列:5’-TGTCCGTCAGAACCCATGC-3’,反 向 序 列:5’-AAAGTCGAAGTTCCATCGCTC-3’;GAPDH引物正向序列:5’-GGAGCGAGATCCCTCCAAAAT-3’,反 向 序 列:5’-GGCTGTTGTCATACTTCTCATGG-3’;SNHG15-210引物正向序列:5’-GGGACCTGACCTGAGAGAAGAT-3’,反向序列:5’-GGTGCCAAGGCTTGCATTCA-3’。以GAPDH为SNHG15-210和CDKN1A mRNA的内参基因,按照2-ΔΔCt法计算SNHG15-210、CDKN1A mRNA的表达。
1.4 CCK-8法检测SIHA细胞增殖情况 将处理后的SIHA细胞制成单细胞悬液,按照每孔3×103个接种至96孔板,每孔加入25μl CCK-8试剂,培养4 h,于酶标仪检测波长在450 nm处的吸光度(OD)值。每组采用4个复孔,分别在第1天、第2天、第3天、第4天进行CCK-8法检测,实验重复4次。
1.5 集落形成实验检测SIHA细胞增殖能力 将处理后的SIHA细胞制成单细胞悬液,按照每孔3×103个接种至6孔板,培养10 d后,用甲醇溶液固定细胞,用0.1%结晶紫溶液染色,用流水洗去残余染液,观察并计数集落形成数。每组采用4个复孔,实验重复4次。
1.6 Western blot检测CDKN1A蛋白的表达 向处理后的SIHA细胞中加入细胞裂解液,提取总蛋白,取50μg蛋白样品上样,进行SDS-PAGE凝胶电泳和转膜,用5%脱脂牛奶封闭3 h,分别加入稀释后的一抗孵育过夜,加入IgG二抗孵育2 h,加入ECL显影液显影、拍照。
1.7 统计学分析 采用SPSS17.0统计软件进行分析,计量资料符合正态分布,均以均数±标准差(±s)表示,组间比较应用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组SIHA细胞中SNHG15-210的表达 如图1,SIHA细胞转染24 h后,NC组和SNHG15-210组SIHA细胞中SNHG15-210的表达分别为(1.14±0.37)和(11.69±2.62),SNHG15-210组相比NC组上调了10.25倍(t=3.99,P<0.01)。
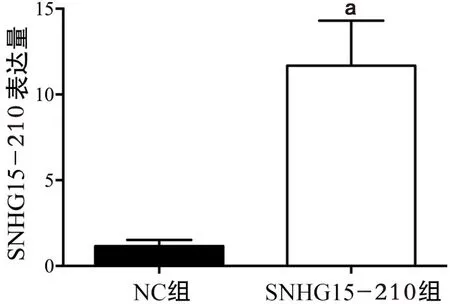
图1 NC组和SNHG15-210组中SNHG15-210的表达
2.2 SNHG15-210对SIHA细胞增殖活性的影响 与NC组相比,SNHG15-210组SIHA细胞在第2、3、4天时增殖活性均有下降趋势(均P<0.05),表明SNHG15-210过表达抑制宫颈癌SIHA细胞增殖活性(图2)。
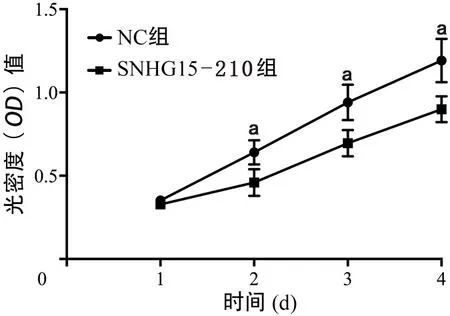
图2 高表达SNHG15-210对SIHA细胞增殖能力的影响
2.3 SNHG15-210对SIHA细胞集落形成能力的影响 NC组和SNHG15-210组集落形成数分别为(162.30±14.92)个和(61.55±12.31)个,差异有统计学意义(t=5.21,P<0.01),提示SNHG15-210过表达可抑制宫颈癌SIHA细胞的集落形成(图3)。

图3 SNHG15-210对SIHA细胞集落形成的影响
2.4 SNHG15-210对CDKN1A mRNA表达的影响 如图4,NC组和SNHG15-210组SIHA细胞中CDKN1A mRNA的 表 达 分 别 为(1.02±0.11)和(6.23±1.16),表 明SNHG15-210可升高CDKN1A mRNA的表达(t=4.50,P<0.01)。

图4 SNHG15-210对SIHA细胞CDKN1A mRNA表达的影响
2.5 SNHG15-210对CDKN1A蛋白表达的影响Western blot结果(图5)表明,与NC组相比,SNHG15-210组SIHA细胞CDKN1A蛋白表达增加,细胞增殖相关蛋白Cyclin D1和Cyclin D2表达降低。
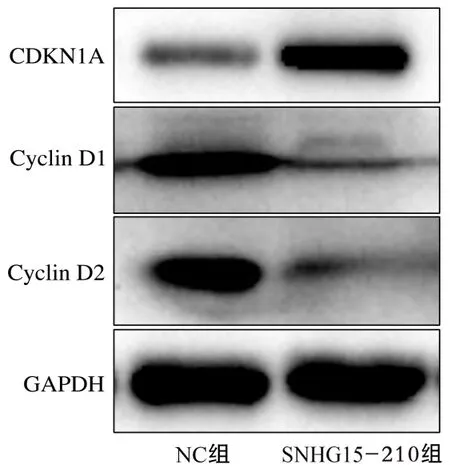
图5 高表达SNHG15-210对SIHA细胞CDKN1A蛋白表达的影响
3 讨 论
研究发现,lncRNA异常表达与宫颈癌的发生、发展密切相关[5]。lncRNA如PTCSC3[6]、PTENP1[7]可通过上调抑癌基因的表达,降低宫颈癌的增殖、迁移和侵袭能力。lncRNA如SOX2OT[8]、EWSAT1[9]可通过上调癌基因的表达,促进宫颈癌的发生和发展。Liu等[4]研究显示,SNHG15-210在甲状腺癌组织和细胞中表达下调,与患者临床分期、肿瘤大小、远处转移相关,SNHG15-210过表达可抑制甲状腺癌细胞的增殖、迁移和侵袭,SNHG15-210在甲状腺癌中起肿瘤抑制作用。SNHG15-210在宫颈癌细胞中的作用尚不明了。本研究显示,过表达SNHG15-210可明显抑制宫颈癌SIHA细胞的增殖能力,SNHG15-210在宫颈癌细胞中表现为抑癌因子作用。
CDKN1A蛋白是一种细胞周期蛋白依赖蛋白激酶抑制剂,通过与细胞周期蛋白依赖蛋白激酶相结合,负性调控细胞周期的进展[10]。CDKN1A蛋白在诱导肿瘤细胞DNA修复、凋亡、衰老等发明发挥重要作用[11]。CDKN1A蛋白在宫颈癌组织中的表达低于癌旁组织,上调CDKN1A基因表达可明显抑制宫颈癌细胞的增殖[12]。本研究显示,过表达SNHG15-210后SIHA细胞中CDKN1A基因表达显著增加,提示SNHG15-210可促进CDKN1A的表达。本研究显示,SNHG15-210促进CDKN1A表达后,SIHA细胞中细胞增殖相关蛋白Cyclin D1和Cyclin D2表达降低,表明SIHA细胞的增殖活性降低。
综上所述,SNHG15-210可能通过促进CDKN1A基因表达抑制宫颈癌细胞的增殖活性,提示SNHG15-210有望成为宫颈癌治疗的潜在靶点。
利益冲突:作者已申明文章无相关利益冲突。
