针刺调节脂肪细胞稳态的减肥作用机制研究*
2021-11-22莫灿婷蒋琰瑜谢汉兴唐红珍
莫灿婷,蒋琰瑜,唐 霁,谢汉兴,唐红珍
(广西中医药大学针灸推拿学院,广西 南宁 530001)
肥胖是指由于机体储存的能量大于消耗的能量,致使体内脂肪积蓄过度,脂肪细胞稳态失调,体质量指数(BMI)≥25.0 kg/m2的慢性代谢性疾病[1]。改革开放以来,我国的经济增长迅速,产业结构优化,人们的工作、生活环境改善,多以静坐方式为主,运动减少,饮食方面以高蛋白、高脂肪、高能量的食物为主。目前众多研究[2-5]表明,肥胖发病率与静坐时间及高脂肪、高能量饮食等因素成正比。根据世界卫生组织研究预测,到2030年全球超重人口或将突破21.6亿[6]。肥胖不仅损害人体形态的外在美,还影响消化、心血管、内分泌等各大系统功能的正常运行,危害机体的健康。目前临床上相关的研究结果指出,肥胖参与肿瘤、哮喘、不孕不育、心血管等疾病的发展过程[7-11]。
近年来,随着分子生物学等研究技术的飞速发展,国内外关于针灸治疗肥胖的作用机制研究已经进入了表观遗传学、神经-内分泌、免疫-炎症反应等分子机制的研究阶段[12]。以往众多的实验研究发现,针刺在调节脂肪细胞的形态大小、数目及分泌各种细胞因子的功能等方面,发挥着维持脂肪细胞稳态的良性调节作用,能有效地降低肥胖患者的体质量,但关于这方面的作用机制的报道尚少,故通过检索针刺治疗饮食诱导的肥胖(diet-induced obsisity,DIO)的相关文献,从针刺对脂肪细胞的分化与凋亡、脂肪细胞形态、脂肪细胞分泌功能的调节作用等方面,阐述针刺通过调节脂肪细胞稳态以达到减肥目的的内在作用机制。
1 脂肪细胞稳态失衡与肥胖
脂肪细胞是构成人体的基本单位,其大小、数目及分泌等生理功能的动态平衡,即脂肪细胞稳态[13-14],是维持人体各项生理机能正常发挥所必需的。WANG G Y[15]通过ODE模型及大量数据分析,发现体质量的稳定性可通过脂肪细胞的自我调节实现。
脂肪细胞数量的增多或者细胞体积的增大,是导致肥胖发生的直接因素。以往的研究结果指出,青春期前的儿童、青少年肥胖以脂肪细胞数量增多为主,而成年后的肥胖以脂肪细胞体积增大为主,数量维持衡定[16]。在脂质代谢平稳的正常条件下,脂肪细胞的分化凋亡及分泌活动处于动态平衡的状态。随着人们高脂高热量的饮食结构、静坐为主的工作生活方式的出现,机体的能量常处于供过于求的局面,导致甘油三酯等脂质积累增多并贮存于脂肪细胞内,使细胞体积普遍增大,自噬体功能异常,脂肪细胞分化、凋亡失衡,脂质代谢紊乱,脂肪组织处于缺氧状态,脂肪细胞的微环境发生改变,促炎因子分泌增多,抗炎因子分泌减少,脂肪细胞稳态失衡,脂肪组织处于慢性炎症状态,并引发瘦素、胰岛素抵抗,最终导致肥胖,形成恶性循环[17]。(见图1)
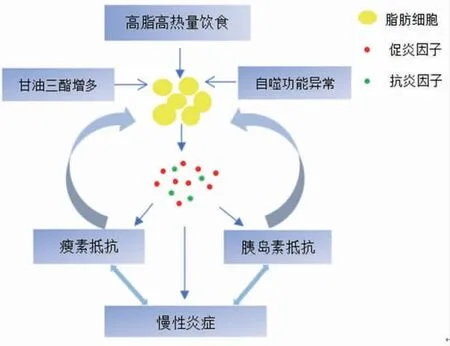
图1 脂肪细胞稳态失衡与肥胖的关系图
2 针刺调节脂肪细胞的分化与凋亡
在细胞水平上,脂肪细胞的形成需经历5个阶段,从骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)开始分化到具有分裂增殖能力的前脂肪细胞是前3个阶段,随后形成成熟的脂肪细胞还需经历2个阶段,这整个分化过程对脂肪细胞数量的稳态极为重要。虽然脂肪细胞数目在成年后基本保持在一个比较稳定的范围,但有新的研究发现,在极度肥胖的成年患者中[18-21],其体内的脂肪细胞数量存在适应性的增加。国内的研究学者在观察实验DIO大鼠体质量增长的过程当中,也检测到前脂肪细胞的分化增殖活动增强,脂肪细胞数量增多,且平均直径明显增大,这可能是机体为适应体内贮存脂肪需求的代偿性机制。而在对肥胖模型大鼠进行跑台训练或针刺治疗后,其脂肪细胞分化增多,但细胞平均体积明显缩小,这说明运动或针刺都可促进脂肪细胞的更新代谢,是维持脂肪细胞更新与代谢动态平衡的适应机制[22-23]。另一个有趣的发现,针刺可以诱导BMSCs向骨细胞、肝细胞、神经元样细胞等非脂肪细胞分化。涂江义等[24]研究发现,电针治疗脑缺血大鼠后,促进了BMSCs向神经丝蛋白-200分化。彭锐等[25]对膝骨关节炎大鼠予以针刺治疗后,发现针刺修复了由炎症造成的软骨细胞损伤。张玮等[26]通过针刺治疗肝纤维化大鼠后,取腹主动脉血并制备血清,培养经传代所得的骨髓干细胞,发现针刺可定向诱导其向肝细胞分化。
脂肪细胞稳态失衡与细胞自噬功能受损有关,当机体营养缺乏时,自噬活动被激活,通过自噬体吞噬细胞内的蛋白质及坏死的细胞器,并运送至溶酶体中,由此进行分解消化,以实现细胞的代谢与更新,维持机体的能量平衡[27]。研究[28]发现,脂肪细胞的自噬活动参与维持脂肪细胞稳态平衡过程。机体发生肥胖后,自噬相关蛋白LC3的表达上调[29-30],为维持机体更新代谢的动态平衡,自噬活动适应性的被激活。但有新的研究[31]表明,自噬的代偿功能是有限度的,长期的高脂饮食饲养导致DIO模型大鼠的脂质积累,超越了自噬的正常代偿功能,其肝脏部分细胞的自噬功能减弱,不能发挥自噬减少机体脂质积累的作用。MIZUNOE Y等[32]在DIO小鼠的白色脂肪中也发现了,自噬溶酶体功能受损也阻碍了脂滴的降解,更重要的是随着自噬活性的增强,抑制了脂肪细胞的凋亡。半胱氨酸天冬氨酸蛋白酶3(Caspase-3)是一种能使细胞迅速凋亡的蛋白酶,李翅翅等[33]研究发现,在机体缺乏营养时,被过度激活的自噬,会下调Caspase-3的蛋白表达,从而使脂肪细胞的凋亡率下降。因此,自噬溶酶体功能异常,脂质代谢能力下降,脂肪细胞凋亡减少,细胞生成与凋亡动态平衡被打破,细胞代谢稳态失衡,导致肥胖的发生。国内外研究发现,针刺能够有效修复受损的自噬功能,逆转上述的肥胖形成过程。胡新颖[34]予电针治疗痴呆大鼠,发现可降低其海马组织LC3-Ⅱ/LC3-Ⅰ的比值,下调自噬蛋白Beclin-1的表达,恢复神经元自噬的正常功能。有研究[35-37]发现,敲除自噬基因Atg5、Atg7后,明显减少了小鼠体内自噬体的生成,严重损坏了肝脏脂代谢的能力。而姚俊鹏等[38]针刺肥胖模型大鼠的中脘、足三里、天枢、三阴交4周后,上调了大鼠下丘脑Atg7蛋白的表达量,减轻了DIO大鼠的体质量。高建芝等[39]通过针刺治疗DIO大鼠,下调了抗细胞凋亡的基因Bcl-2(B-cell lymphoma-2)的蛋白表达,提高了其脂肪细胞的凋亡率。
综上研究表明,针刺可通过促进脂肪细胞更新代谢,诱导BMSCs向非脂肪细胞分化,从源头上减少脂肪细胞的生成,同时改善肥胖机体受损的细胞自噬功能,提高脂肪细胞的凋亡速率,抑制体内脂质的大量合成,维持脂肪细胞分化与凋亡的动态平衡。
3 针刺调控脂肪细胞的形态大小
白色脂肪组织占据成年人正常体质量的15%~20%,是肥胖发生的最初级场所,由白色脂肪细胞、巨噬细胞、少量的成纤维细胞、神经细胞及非脂肪类细胞物质构成,其中以白色脂肪细胞为主。白色脂肪细胞内有90%是脂肪滴,其中脂滴内含有95%以上的甘油三酯(TG)[40]。因此,TG在体内的不断积蓄使细胞的直径普遍扩大,是加速机体肥胖的主要原因。众多动物实验及临床试验研究结果表明,针刺能有效减少机体TG的含量,缩小脂肪细胞的直径。大量临床研究[41-43]表明,针刺能有效降低DIO患者的体脂率及血清TG含量,总体治疗有效率达90%以上。洪浩[44]在针刺治疗DIO小鼠的实验中发现,DIO小鼠的脂肪细胞体积随着体内TG含量的降低而减小。目前关于针刺降低肥胖机体TG含量、改善脂肪细胞形态体积过度增大的作用机制尚未明确,可能与促进TG合成的过氧化物酶体增殖物活化受体γ(PPAγ)、固醇调节元件结合蛋白(SREBPs)、糖反应元件结合蛋白(ChREBP)等转录调控因子有关。
PPAγ在前脂肪细胞终末阶段的分化过程中,参与调控与TG水解密切相关的脂肪甘油三酯脂肪酶(ATGL)、围脂滴蛋白(PLIN)等标志性靶基因的转录,进而影响脂质代谢及脂肪沉积[45]。童国相等[46]在干预3T3-L1前体脂肪细胞的增殖、分化实验过程中发现,细胞内PPAγ的表达下调时,脂肪细胞内生成的脂滴明显较前减小、TG含量也明显减少。王丽华等[47]对DIO大鼠予电针治疗后,发现其PPAγ共激活因子1α(PGC-1α)蛋白表达升高,Lee’s指数显著降低,附睾脂肪出现“棕色化”,且细胞直径缩小。王海英等[48]对DIO大鼠的双侧“带脉”穴进行电针治疗8周后,大鼠体质量及TG的水平显著下降,且下调了该组大鼠肝脏PPAγ的表达水平,减少了肝细胞内的脂滴含量。
ChREBP及SREBPs在维持机体脂质代谢稳定的过程当中,均可通过调控脂肪酸合成酶(FAS)的表达,参与调节TG的合成[49-50]。王辉等[51]在肥胖抵抗的实验研究中发现,肥胖模型组大鼠肝组织中SREBP1c的mRNA表达水平明显高于肥胖抵抗组,且DIO大鼠的肝脏组织切片可见肝细胞内有大量脂肪滴。李知行等[52]通过电针胰岛素抵抗大鼠的双侧“丰隆”“三阴交”穴,治疗2周后,胰岛素抵抗大鼠肝脏SREBP1c、FAS的表达量均显著降低,血清中TG的含量也较模型组降低,这可能与电针降低肝组织SREBP1c的表达、下调FAS等脂肪酸合成酶的活性,使肝组织内TG、TC的合成减少有关。由此可见,针刺可调控PPAγ、SREBP、ChREBP等参与脂肪合成的转录调控因子的表达,促进脂类代谢,减少脂滴生成,缩小脂肪细胞的体积。
4 针刺调节脂肪细胞的分泌功能
脂肪细胞具有分泌各种细胞因子的功能,如促炎性因子瘦素(Leptin)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等,以及抗炎因子脂联素、白细胞介素-10(IL-10)等。在身体处于正常状态的条件下,各类因子的分泌处于一个相对平衡的动态。肥胖时,脂肪细胞内TG的过度储存,使细胞的体积增大,当脂肪细胞的直径≥120 μm时,经血液运输进入到脂肪组织的氧量供给小于其生长的需求量,造成脂肪组织局部含氧量缺乏,脂肪细胞分泌功能失衡,分泌出大量的促炎性因子,而抑制了部分抗炎性因子的生成,最终导致瘦素抵抗及慢性炎症,加剧代谢综合征的发生与发展[53-54]。
Leptin与其相对应的受体结合后,激活JAK/STAT信号通路,调节其靶基因在下丘脑的表达,从而对机体的摄食行为及能量代谢发挥调控作用[55]。丁忱欢等[56]针刺治疗DIO大鼠的实验研究结果为这一理论提供了有力依据。Leptin的表达水平与脂肪细胞脂质含量及细胞大小密切相关。160例肥胖儿童的临床研究[57]结果表明,肥胖组儿童血清Leptin水平高于正常组,并与TG、IL-6、IL-8、TNF-α呈正相关,体内存在瘦素抵抗的现象。关于瘦素抵抗的分子机制十分复杂,目前众多研究表明,瘦素-受体结合后的信号通路途径存在转导障碍。已有研究[58]指出,细胞因子信号转导抑制因子3(SOCS3)可以阻断瘦素-受体信号传导,并对JAK/STAT通路的信号转导起负反馈的调节作用,导致瘦素抵抗。本团队课题组前期研究发现针刺不仅能降低DIO大鼠的体质量,还可降低其血清中SOCS3、瘦素的水平[59]。严志康等[60]发现针刺可以促进肝脏JAK2、STAT3蛋白的磷酸化水平,因此,推测针刺可能通过降低SOCS3的含量,逆转其负反馈调节JAK/STAT通路的作用,进而提高瘦素控制食欲及促进能量消耗的效能。
临床研究[61]表明,肥胖合并脂肪肝的患者血清中IL-6、TNF-α的含量比正常人显著升高,且与胰岛素抵抗指数成正相关。在肥胖儿童脂肪组织的Western blotting、RT-PCR检测中,发现TNF-α可能通过抑制其组织中的DNA断裂因子相似蛋白C(CIDEC)的磷酸化,阻碍胰岛素与其受体底物(IRS)的结合,影响脂肪细胞的脂解活动,导致机体脂质代谢紊乱[62]。同样,有报道[63]证明,IL-6可通过抑制IRS的磷酸化、激活PI3K/AKT信号通路,胰岛素的信号传导受阻,使分泌胰岛素的胰岛β细胞对葡萄糖等物质的刺激所产生的生物学效应降低,即胰岛素抵抗。TNF-α、IL-6不仅影响胰岛素降低机体血糖的生理机能,还是引发慢性炎症相关通路的激动剂。有国外研究[64]报道,TNF-α、IL-6可通过激活NF-κB、JNK等炎症通路,进一步诱导更多促炎性因子的分泌,加剧慢性炎症的进程。徐珊珊等[65]对肥胖小鼠双侧的“后三里”和“内庭”穴进行电针治疗,4周后,取小鼠的脂肪组织进行PCR检测及HE染色的结果显示,IL-6、TNF-α的mRNA在电针组的相对定量明显低于肥胖对照组,且电针组脂肪细胞内堆积的脂滴球较小,直径明显减小,细胞大小较为均匀。
脂联素(adiponectin,ADP)是一种新型的抗炎性细胞因子,与IL-6、TNF-α等促炎性因子的负调节作用相反,ADP能减少糖异生,提高机体胰岛素的生理功能。适当提高ADP的含量,对防治肥胖及其他相关的代谢性疾病具有积极意义。脂联素基因的转录调控,需要依赖于去乙酰化酶沉默信息调节因子1(SIRT1)激活的叉头状转录因子1(FoxO1)的参与[66],大量研究显示,肥胖个体的血清ADP含量明显偏小,并存在胰岛素抵抗的现象[67]。杨亚南等[68]通过电针治疗,激活DIO大鼠白色脂肪组织中的SIRT1/FoxO1信号通路,促进ADP的信号转导,提高了胰岛素调控糖脂合成的功能,可有效降低大鼠的体质量。宋燕娟等[69]的实验研究同样证实了,针刺通过上调SIRT1和FoxO1的蛋白表达,促进DIO大鼠的糖脂代谢。
IL-10是体内重要的免疫抗炎因子,可降低核因子κB(NF-κB)蛋白的表达水平,进而抑制机体的炎症反应[70]。李庆等[71]临床研究发现,血清IL-10含量较低的妊娠期糖尿病患者大多伴随有胰岛素抵抗的现象。张思依等[72]通过针刺DIO大鼠的“关元”“足三里”等穴位,治疗8周后,M2型巨噬细胞在其附睾脂肪中的数量有较显著的增加,且该组附睾脂肪中IL-10的mRNA表达水平也较模型组高,而IL-6的mRNA在附睾脂肪中的表达明显低于肥胖模型大鼠,可见针刺治疗能有效减轻附睾白色脂肪组织的炎性反应。
总结上述研究可见,针刺能有效逆转机体肥胖后由促炎性因子占主导地位而危害生命健康的不利局面,通过针刺的双向调控作用使抗炎性因子、促炎性因子的数量在体内重新达到动态平衡,改善肥胖机体的慢性炎症状态。
5 结 语
针刺在调节肥胖机体脂肪细胞的数目、形态及功能的动态平衡,维持细胞稳态,促进脂质代谢等方面已取得了确切疗效,但其中具体的分子作用机制尚未明确。笔者在整理国内外关于针刺对肥胖机体脂肪细胞的影响等研究文献的过程中发现,以下5个方面的问题仍需在今后进行更深入的研究探讨:(1)抗凋亡蛋白和促凋亡蛋白,以及二者共有的Protein kinase结构域上的蛋白质激酶家族均参与调控脂肪细胞的分化、凋亡[73],针刺可能通过调节这3类蛋白中的哪些蛋白表达以维持脂肪细胞数目的动态平衡;(2)针刺如何通过调节促进脂肪细胞脂滴合成与分解的蛋白质及水解酶类分子物质,以达到调控脂肪细胞形态大小的目的;(3)机体肥胖引起脂肪细胞微环境改变后如何影响细胞的生理机能,针刺如何逆转细胞因子分泌紊乱的局面,以维持脂肪细胞的分泌稳态;(4)前文谈到针刺能诱导BMSCs向非脂肪细胞分化,是否能为有肥胖倾向的儿童、青少年的临床防治策略提供借鉴意义,仍有待探讨;(5)在维护人类健康的前提下,如何更好地利用现代分子生物学等研究技术为临床治疗服务,优化肥胖的防治策略,是需要每个医者及研究人员共同努力解决的关键问题。
