薯蓣皂苷对实验性变态反应性脑脊髓炎模型小鼠损伤的保护作用及机制研究
2021-11-22夏凡林沈磊莹林子晶
夏凡林,沈磊莹,曹 阳,林子晶
(1.上海城建职业学院,上海 201415;2.上海交通大学附属第九人民医院,上海 200011;3.重庆医科大学附属第二医院,重庆 400016)
多发性硬化(multiple sclerosis,MS)是一种慢性、自身免疫性和神经退行性疾病,以中枢神经系统炎性脱髓鞘为主要病理特征。据报道,全球大约有250多万人罹患MS。该病的发病机制目前尚未明确,可能与遗传、环境、感染和自身免疫等有关,其中“自身免疫学说”是研究热点之一。该学说指出,MS的产生是由于髓鞘碱性蛋白(MBP)对自身免疫系统进行攻击,导致中枢神经系统白质髓鞘脱失,从而导致各种神经功能障碍的发生[1]。目前,国内外学者依据“自身免疫学说”开发出了Glatiramer acetate、Fingolimod等新药治疗MS,但其价格昂贵且患者耐受性差,临床应用有限。近年来,中药治疗MS因其疗效稳定、毒副作用小及复发率低的特点引起了学者的广泛关注[2]。
多发性硬化在中医学中无对应的名称,根据其症状及体征可归属于“痿证”。其主要病机是患者多素体禀赋不足,复感受外邪,导致体内痰瘀凝结,诱发脑髓、脊髓病变。治疗应以补肾益气、活血化瘀为主要治疗原则。薯蓣块茎是常用中药材山药,中医学认为薯蓣具有益肾气、健脾胃、止泄痢、化痰涎、舒筋活血、截疟等功效。薯蓣皂苷是其主要活性成分,属于甾体皂苷类化合物之一。药理学研究显示,薯蓣皂苷具有调节免疫、抗氧化、抗肿瘤和抗凋亡等活性[3]。褚春民等[4]研究发现,薯蓣皂苷对胶原性关节炎模型大鼠具有良好的双向免疫调节作用,被认为是非常具有开发前景的免疫调节剂。鉴于此,笔者推测薯蓣皂苷可能通过改善免疫炎症损伤而延缓MS进展。核因子κB(NF-κB)属于转录因子,与细胞增殖、分化、凋亡和炎症反应等密切相关[5]。与健康人比较,MS患者脑脊液、血清、脑组织和脊髓组织中NF-κB表达水平均有所升高[6];且临床上常用于治疗MS的药物[如醋酸格拉替雷、干扰素β(IFN-β)等]均可通过抑制NF-κB的表达而发挥作用[7]。这提示阻断NF-κB表达可能是防治MS的有效手段[8]。基于此,本研究采用髓鞘碱性蛋白(MBP)+完全弗氏佐剂(CFA)诱导建立EAE小鼠模型,观察薯蓣皂苷是否可以通过抑制NF-κB活性而改善MS小鼠神经炎症反应及阻止疾病的进展,旨在探讨薯蓣皂苷对MS的免疫调节作用,为其临床应用提供实验基础。
1 材料与方法
1.1 实验动物 雌性C57BL/6小鼠40只,健康状况良好,SPF级,10周龄,体质量20~30 g,购于斯贝福(北京)生物技术有限公司,动物生产许可证号:SCXK(京)2016-0002,动物使用许可证号:SYXK(京)2016-0037。所有小鼠均饲养于上海交通大学动物实验中心,室温(24±2)℃,每12 h明暗交替,自由摄食、饮水。实验结束后,采用脊椎脱臼法处死小鼠,本实验所有操作均符合中华人民共和国《实验动物管理条例》和上海交通大学实验动物福利和伦理相关规定。
1.2 药物与试剂 薯蓣皂苷原料药(海纯优生物科技有限公司,批号:180704,纯度:≥98%);氯化钠注射液(齐鲁制药有限公司,批号:20180911,规格:500 mL∶450 mg);CFA(内含减毒结核分枝杆菌H37RA(美国Sigma公司,批号:170902);百日咳毒素(美国Sigma公司,批号:P7208);兔抗小鼠MBP多克隆抗体(上海泽叶生物科技有限公司,批号:181207);兔抗小鼠抗离子化钙结合适配分子1(IBA-1)多克隆抗体(日本WAKO公司,批号:180922);兔抗小鼠抗神经胶质原纤维酸性蛋白(GFAP,批号:SC201809)、IFN-γ(批号:SC201294)、白细胞介素-4(IL-4,批号:SC201502)、IL-17(批 号:SC201607)、IL-22(批号:SC201711)、Nod样受体蛋白-3(NLRP-3,批号:SC201609)、NF-κB多克隆抗体(批号:SC201602)(美国Santa Cruz公司);β-actin抗体(美国Santa Cruz公司,批号:SC201801);Alexa Fluor488/568/594结合生物素标记的羊抗小鼠IgG二抗(美国Invitrogen公司,批号:A11029);抗CD4单克隆抗体(武汉生物制品研究所公司,批号:180922);抗小鼠F4/80抗体(美国Abcam公司,批号:ab204451);抗小鼠Hinstone H3抗体(北京百奥莱博科技有效公司,批号:181108);IFN-γ(批号:191108)、IL-4(批 号:180911)、IL-17(批号:191220)、IL-22(批号:180723)、NLRP-3酶联免疫吸附(ELISA)检测试剂盒(批号:180711)(南京森贝伽生物科技有限公司);胎牛血清、结晶紫染液、4’,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染液(美国Sigma公司);苏木精-伊红(HE)染液(上海实验试剂有限公司);蛋白裂解液、胞质或核蛋白提取试剂盒、BCA蛋白定量试剂盒、ECL染色试剂盒(北京百奥莱博科技有限公司);固蓝(luxol fast blue,LFB)染液(上海经科化学科技有限公司);SDS缓冲液(上海榕柏生物技术有限公司公司);Trans AMTM NF-κB p65活性检测试剂盒(美国Active Motif公司,批号:521455deo);其余试剂均为分析纯,水为灭菌注射用水。
1.3 主要仪器ELX808型酶标仪(美国BioTek公司);CM1950型冷冻切片机(北京格美胜达医疗设备有限公司);IX51型荧光显微镜(日本Olympus公司);CX43型光学显微镜[奥林巴斯(中国)有限公司];JIDI-16R型高速冷冻离心机(广州吉迪仪器有限公司);Odyssey 9120双色红外激光成像系统仪器(美国LICOR公司);680型全自动酶标仪(美国BIO-RAD公司)。
1.4 造模与分组 所有小鼠适应性喂养7 d后,随机分为对照组、模型组、薯蓣皂苷低剂量组、薯蓣皂苷高剂量组,每组10只。除对照组外,其余小鼠参考练高建等[9]的研究建立EAE模型:取MBP 15 mg,用磷酸盐缓冲液(PBS,pH 7.2)5 mL稀释,得质量浓度为3 mg/mL的MBP溶液,再将同体积的CFA(内含减毒结核分枝杆菌H37RA)与之混合。将上述混合溶液于4℃下进行乳化,得乳化液。于小鼠脊柱段两侧任意2点皮下注射乳化液0.2 mL(内含MBP 300μg)进行免疫,并于免疫当日同时腹腔注射百日咳毒素0.5 mL(即200 ng/只)以复制EAE模型。取造模小鼠脊髓组织进行HE染色,若出现脊髓血管周围炎性细胞浸润、白质脱髓鞘等症状,提示造模成功。
1.5 实验给药 薯蓣皂苷溶液的配制以生理盐水为溶剂,剂量参照人临床常用剂量的5、10倍并通过人与小鼠的体质量换算而得。于造模完成当日(即为第0天)起,薯蓣皂苷低、高剂量组小鼠按0.1 mL/10 g腹腔注射相应药物,剂量分别为60、120 mg/kg;对照组和模型组小鼠腹腔注射等体积生理盐水,每日中午给药,1次/d,连续20 d。
1.6 观察指标
1.6.1 一般情况及神经功能评分 每日由同一研究者观察各组小鼠进食、饮水、排便、活动度、体质量等一般情况,并对小鼠神经功能进行评估。参照文献[3]进行评分,0分:无明显异常;1分:尾巴瘫痪;2分:共济失调,后肢麻痹性痴呆;3分:双后肢瘫痪;4分:四肢瘫痪;5分:濒死状态或死亡。分别记录造模前及造模后第5、10、15、20天各组小鼠的体质量及神经功能评分情况。
1.6.2 血清炎症因子水平 于造模后第20天,腹腔注射10%水合氯醛溶液(4 mL/kg)进行麻醉,于小鼠眼球取血并分离血清。采用ELISA法以酶标仪于450 nm波长处检测各组小鼠血清IFN-γ、IL-4、IL-17、IL-22、NLRP3水平,严格按照相应试剂盒说明书操作。
1.6.3 组织形态学观察 于取血后处死各组小鼠,取出脊髓组织,置于4%多聚甲醛溶液中固定24 h后,使用冷冻切片机切片(厚度约16μm),经HE染色后使用光学显微镜观察各组小鼠脊髓组织中免疫细胞的浸润情况(浸润细胞呈蓝紫色);经LPB染色后使用光学显微镜观察其脊髓组织脱髓鞘情况(髓鞘呈蓝白色)。
1.6.4 脊髓组织中CD3、F4/80、GFAP、IBA-1蛋白表达 采用免疫荧光染色法检测。取“1.6.3”项下脊髓组织切片,用PBS洗涤2次,用3%过氧化氢孵育20 min以抑制内源性过氧化物酶活性。随后用5%胎牛血清阻断1 h,分别加入CD3、F4/80、GFAP、IBA-1抗体(稀释度均为1∶200),于4℃下孵育过夜;经PBS洗涤3次后,于室温下加入Alexa Fluor 488/568/594结合生物素标记的IgG二抗(稀释度为1∶500),室温孵育1~2 h;经PBS洗涤3次,用DAPI染色后,以中性树脂封片,使用荧光显微镜观察CD3、F4/80、GFAP、IBA-1的表达情况(根据其绿色/红色荧光强弱来判定其表达强弱)。上述试验重复3次。
1.6.5 脊髓组织中炎症蛋白(IFN-γ、IL-4、IL-17、IL-22、NLRP3、NF-κB及p-NF-κB)的表达水平 采用Western blotting法检测。取各组大鼠脊髓组织适量,匀浆后,加入蛋白裂解液提取细胞的总蛋白,分别使用胞质或核蛋白提取试剂盒提取细胞的胞浆或胞核蛋白,冰上裂解25 min后,于4℃下以1 000 g离心5 min,将上清液转移至EP管中,加入SDS缓冲液适量,煮沸5 min使蛋白变性。取变性后的蛋白进行SDS-PAGE,随后转移至PVDF膜上,用5%脱脂奶粉室温封闭1 h,加入相应一抗(稀释度均为1∶500),4℃孵育过夜,用TBST溶液清洗5 min×3次;随后加入二抗(1∶1 000),室温孵育2 h,用TBST溶液清洗5 min×3次。经ECL显色后,使用Odyssey 9120双色红外激光成像系统仪器分析蛋白条带的灰度值,以目的蛋白与内参(β-actin或Histone 3)的灰度值比值表示目的蛋白的相对表达量。上述试验重复3次。
1.6.6 NF-κB p65与DNA结合活性检测 按“1.6.4”项下方法提取各组小鼠脊髓组织的核蛋白,参考Trans AMTM NF-κB p65活性检测试剂盒说明书,使用酶标仪于450 nm波长处检测吸光度值,其吸光度值越高,表示NF-κB p65与DNA结合活性越强。
1.7 统计学方法 采用SPSS 20.0软件对数据进行统计分析。计量资料以(±s)表示,多组间比较采用单因素方差分析或重复测量方差分析,两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠的一般情况 对照组小鼠生存状态良好,食量、活动和大小便均未见异常,造模前后的神经功能评分均为0分;模型组小鼠自造模后第10天起出现EAE症状,如疲惫、后肢无力、尾拖地等,其体质量(造模后第10~20天)明显减少,神经功能评分(造模后第10~20天)明显升高(P<0.05)。薯蓣皂苷低、高剂量组小鼠上述症状均有不同程度的改善,薯蓣皂苷高剂量组小鼠体质量(造模后第10~20天)明显增加,且薯蓣皂苷高剂量组明显高于薯蓣皂苷低剂量组;薯蓣皂苷低、高剂量组小鼠神经功能评分(造模后第10~20天)均明显降低,且薯蓣皂苷高剂量组明显低于薯蓣皂苷低剂量组(P<0.05)。(见表1~2、图1~2)
表1 各组小鼠体质量比较(±s,g)
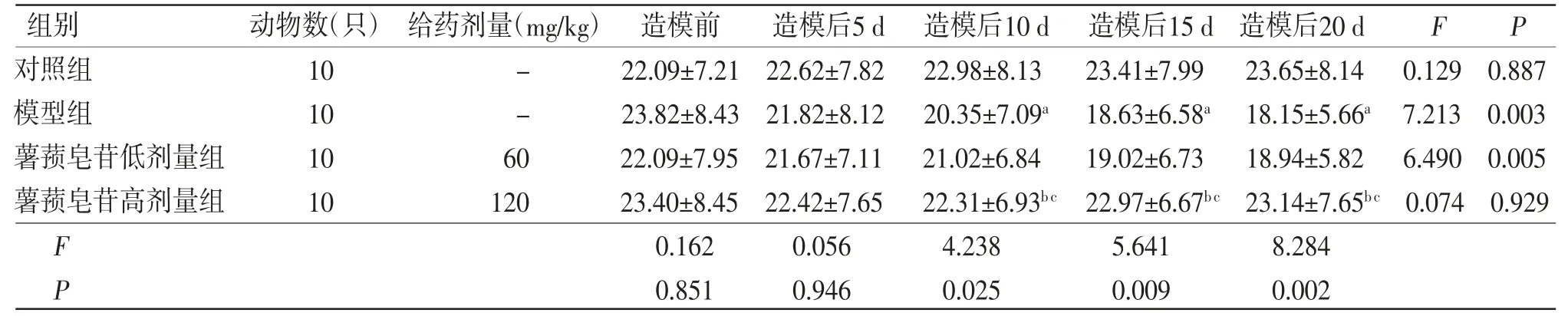
表1 各组小鼠体质量比较(±s,g)
注:F时间主效应=23.517,P时间主效应=0.000;F分组主效应=21.326,P分组主效应=0.000;F交互效应=17.218,P交互效应=0.000;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与薯蓣皂苷低剂量组比较,cP<0.05
组别 动物数(只)给药剂量(mg/kg) 造模前 造模后5 d造模后10 d造模后15 d造模后20 d F P对照组 10 - 22.09±7.21 22.62±7.82 22.98±8.13 23.41±7.99 23.65±8.14 0.129 0.887模型组 10 - 23.82±8.43 21.82±8.12 20.35±7.09a 18.63±6.58a 18.15±5.66a 7.213 0.003薯蓣皂苷低剂量组 10 60 22.09±7.95 21.67±7.11 21.02±6.84 19.02±6.73 18.94±5.82 6.490 0.005薯蓣皂苷高剂量组 10 120 23.40±8.45 22.42±7.65 22.31±6.93bc 22.97±6.67bc 23.14±7.65bc 0.074 0.929 F 0.162 0.056 4.238 5.641 8.284 P 0.851 0.946 0.025 0.009 0.002
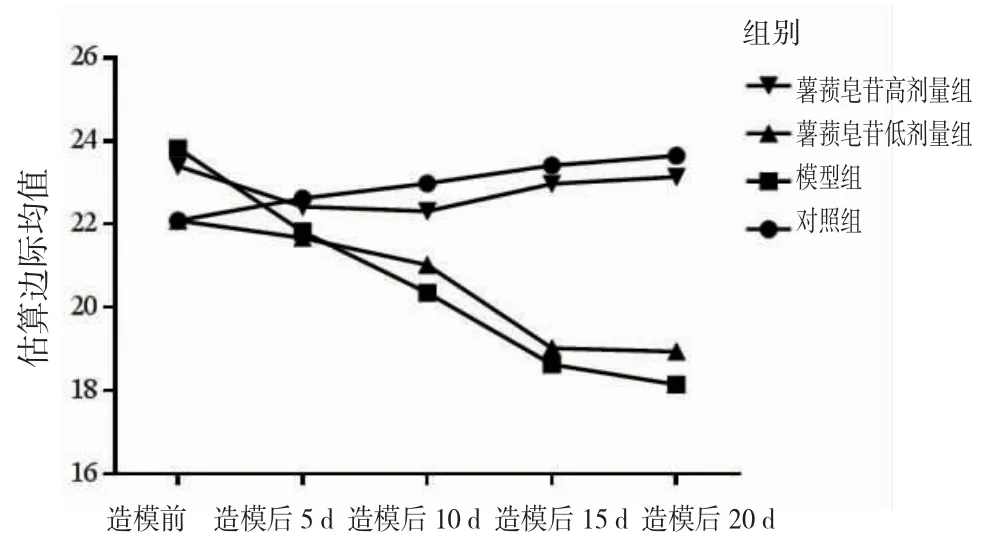
图1 各组小鼠体质量比较的交互效应轮廓图
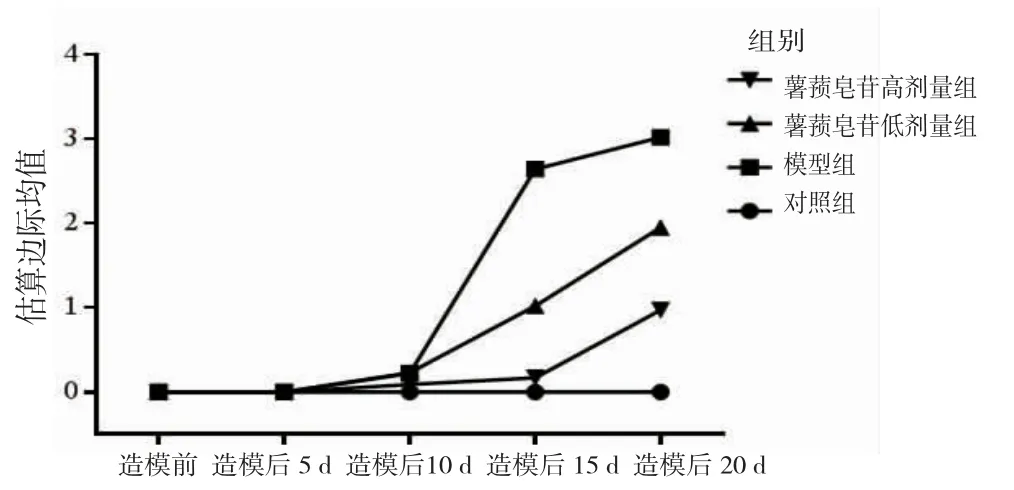
图2 各组小鼠神经功能评分比较的交互效应轮廓图
2.2 各组小鼠血清炎症因子水平比较 与对照组比较,模型组小鼠血清IFN-γ、IL-17、IL-22、NLRP3水平均明显升高(P<0.05),而IL-4水平明显降低(P<0.05);与模型组比较,薯蓣皂苷低、高剂量组小鼠血清IFN-γ、IL-17、IL-22、NLRP3水平均明显降低(P<0.05),且薯蓣皂苷高剂量组血清IFN-γ、IL-17、NLRP3明显低于薯蓣皂苷低剂量组(P<0.05);薯蓣皂苷低、高剂量组血清IL-4水平均明显升高(P<0.05),且薯蓣皂苷高剂量组明显高于薯蓣皂苷低剂量组(P<0.05)。(见表3)
表3 各组小鼠血清炎症因子水平比较(±s,pg/mL)

表3 各组小鼠血清炎症因子水平比较(±s,pg/mL)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与薯蓣皂苷低剂量组比较,cP<0.05
组别 动物数(只)给药剂量(mg/kg) IFN-γ IL-4 IL-17 IL-22 NLRP-3对照组 10 - 11.23±1.09 36.92±2.77 16.73±2.26 17.58±4.36 19.75±2.46模型组 10 - 33.73±4.81a 19.83±1.25a 31.22±2.47a 65.73±7.33a 31.25±3.41a薯蓣皂苷低剂量组 10 60 21.73±2.35b 26.48±2.24b 21.36±1.97b 21.09±5.13b 23.47±3.59b薯蓣皂苷高剂量组 10 120 15.72±3.11b c 30.91±2.47b c 15.09±2.48b c 22.15±5.22b c 20.93±2.44b c
2.3 各组小鼠脊髓组织形态学变化 对照组未见明显的单核细胞浸润,模型组可见大量的单核细胞浸润,薯蓣皂苷低、高剂量组单核细胞浸润明显减少。LFB染色结果显示,对照组未见明显的脊髓脱髓鞘变化,模?型组可见明显的脱髓鞘改变,薯蓣皂苷低、高剂量组脱髓鞘改变明显减少。(见图3)

图3 各组小鼠脊髓组织形态学
表2 各组小鼠神经功能评分比较(±s,分)
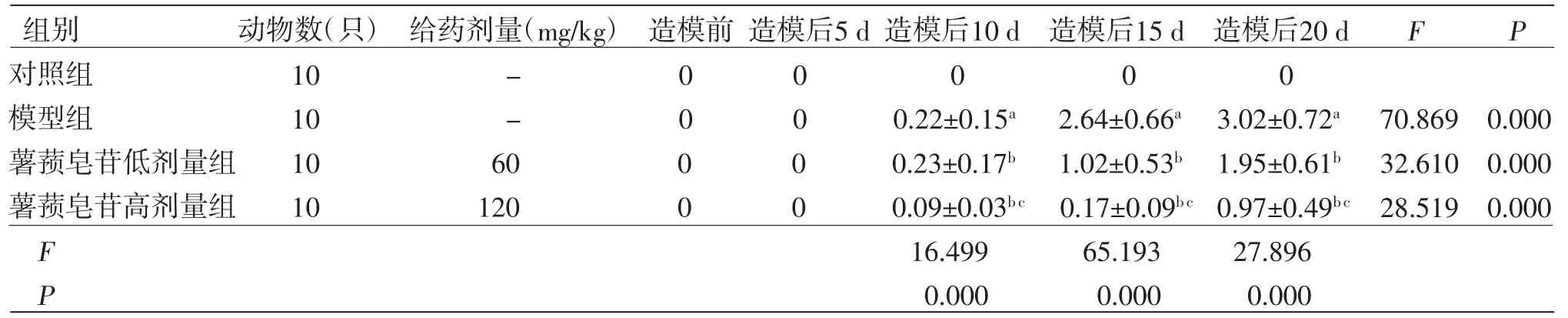
表2 各组小鼠神经功能评分比较(±s,分)
注:F时间主效应=32.471,P时间主效应=0.000;F分组主效应=42.362,P分组主效应=0.000;F交互效应=36.283,P交互效应=0.000;与对照组比较,aP<0.05;与模型组比较,bP<0.05;与薯蓣皂苷低剂量组比较,cP<0.05
组别 动物数(只) 给药剂量(mg/kg)造模前 造模后5 d造模后10 d造模后15 d造模后20 d F P对照组 10 - 0 0 0 0 0模型组 10 - 0 0 0.22±0.15a 2.64±0.66a 3.02±0.72a 70.869 0.000薯蓣皂苷低剂量组 10 60 0 0 0.23±0.17b 1.02±0.53b 1.95±0.61b 32.610 0.000薯蓣皂苷高剂量组 10 120 0 0 0.09±0.03b c 0.17±0.09b c 0.97±0.49b c 28.519 0.000 F 16.499 65.193 27.896 P 0.000 0.000 0.000
2.4各组小鼠脊髓组织中CD4、F4/80、GFAP、IBA-1蛋白表达比较 与对照组比较,模型组小鼠脊髓组织中CD4、F4/80、GFAP、IBA-1蛋白表达均明显增加;与模型组比较,薯蓣皂苷低、高剂量组小鼠脊髓组织中CD4、F4/80、GFAP、IBA-1蛋白表达均有不同程度的减少。(见图4)
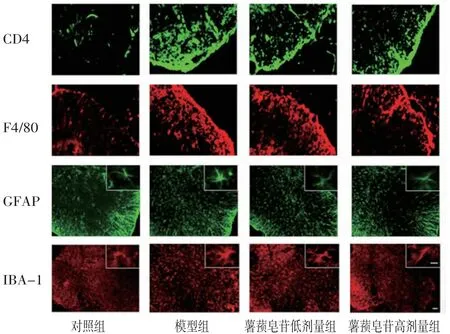
图4 各组小鼠脊髓组织中CD4、F4/80、GFAP、IBA-1表达比较(×20,小方格中为×200,比例尺为50μm)
2.5 各组小鼠脊髓组织中炎症蛋白表达比较 与对照组比较,模型组小鼠脊髓组织中IFN-γ、IL-17、IL-22、NLRP3蛋白的相对表达量均明显升高(P<0.05),而IL-4的相对表达量明显降低(P<0.05)。与模型组比较,薯蓣皂苷低、高剂量组小鼠脊髓组织中IFN-γ、IL-17、IL-22、NLRP3的相对表达量均明显降低(P<0.05),且薯蓣皂苷高剂量组低于薯蓣皂苷低剂量组(P<0.05);而IL-4的相对表达量均明显升高(P<0.05),且薯蓣皂苷高剂量组高于薯蓣皂苷低剂量组(P<0.05)。(见图5、表4)
表4 各组小鼠脊髓组织中IFN-γ、IL-17、IL-22、NLRP3蛋白表达比较(±s)
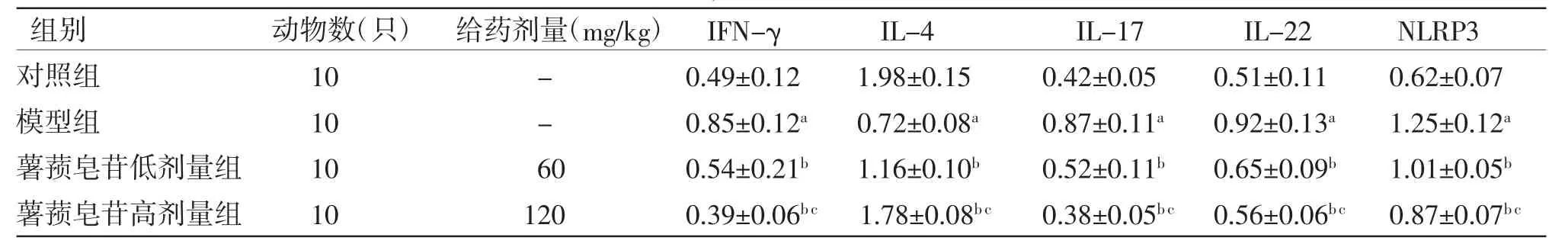
表4 各组小鼠脊髓组织中IFN-γ、IL-17、IL-22、NLRP3蛋白表达比较(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05
组别 动物数(只) 给药剂量(mg/kg)IFN-γ IL-4 IL-17 IL-22 NLRP3对照组 10 - 0.49±0.12 1.98±0.15 0.42±0.05 0.51±0.11 0.62±0.07模型组 10 - 0.85±0.12a 0.72±0.08a 0.87±0.11a 0.92±0.13a 1.25±0.12a薯蓣皂苷低剂量组 10 60 0.54±0.21b 1.16±0.10b 0.52±0.11b 0.65±0.09b 1.01±0.05b薯蓣皂苷高剂量组 10 120 0.39±0.06b c 1.78±0.08b c 0.38±0.05b c 0.56±0.06b c 0.87±0.07b c
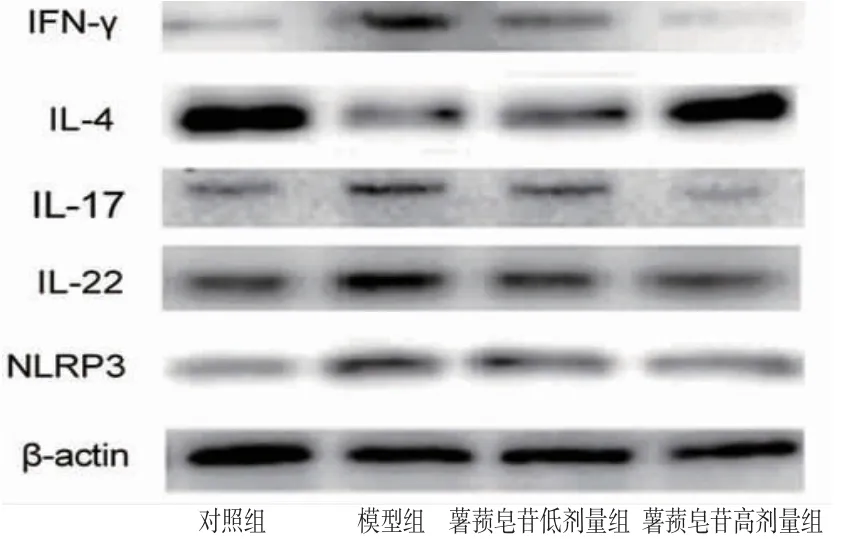
图5 各组小鼠脊髓组织中IFN-γ、IL-17、IL-22、NLRP3蛋白表达电泳图
2.6 各组小鼠脊髓组织中NF-κB表达比较 与对照组比较,模型组小鼠脊髓组织细胞核中NF-κB的相对表达量明显升高(P<0.05),细胞质中NF-κB的相对表达量明显降低(P<0.05)。与模型组比较,薯蓣皂苷低、高剂量组小鼠脊髓组织细胞核中NF-κB的相对表达量均明显升高(P<0.05),且薯蓣皂苷高剂量组明显高于薯蓣皂苷低剂量组(P<0.05);细胞质中NF-κB的相对表达量均明显降低(P<0.05),且薯蓣皂苷高剂量组明显低于薯蓣皂苷低剂量组(P<0.05)。(见图6、表5)

图6 各组小鼠脊髓组织中NF-κB蛋白表达电泳图
表5 各组小鼠脊髓组织中NF-κB蛋白表达及DNA结合活性比较(±s)
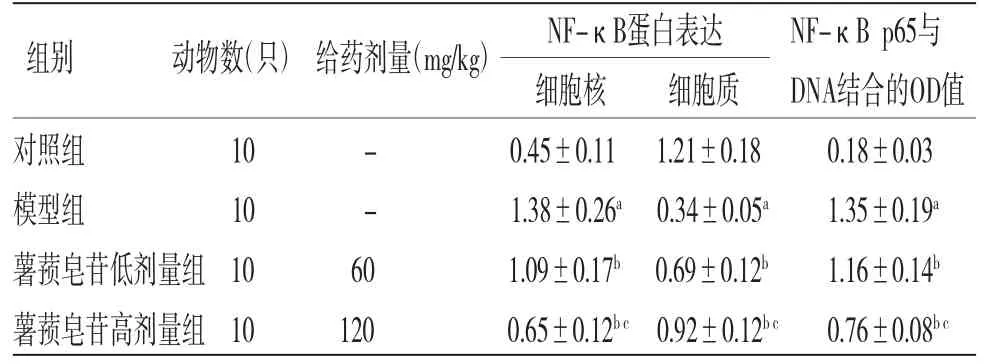
表5 各组小鼠脊髓组织中NF-κB蛋白表达及DNA结合活性比较(±s)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与低剂量组比较,cP<0.05
NF-κB蛋白表达 NF-κB p65与细胞核 细胞质 DNA结合的OD值对照组 10 - 0.45±0.11 1.21±0.18 0.18±0.03模型组 10 - 1.38±0.26a 0.34±0.05a 1.35±0.19a薯蓣皂苷低剂量组10 60 1.09±0.17b 0.69±0.12b 1.16±0.14b薯蓣皂苷高剂量组10 120 0.65±0.12b c 0.92±0.12b c 0.76±0.08b c组别 动物数(只) 给药剂量(mg/kg)
2.7 各组小鼠脊髓组织中NF-κB p65与DNA结合活性比较 与对照组比较,模型组小鼠脊髓组织细胞核中NF-κB p65与DNA结合的活性显著增加(P<0.05)。与模型组比较,薯蓣皂苷低、高剂量组小鼠NF-κB p65与DNA结合的活性均明显降低(P<0.05),且薯蓣皂苷高剂量组明显低于薯蓣皂苷低剂量组(P<0.05)。(见表5)
3 讨 论
MS是一种慢性自身免疫性中枢炎性疾病,伴有大脑神经细胞大量损伤和死亡[10]。NF-κB是一种转录因子,与免疫炎症、氧化应激、细胞增殖和分化等密切相关[11]。NF-κB激活在MS发病中有重要意义,阻断NF-κB功能可能是防治MS的有效手段。IFN-γ、IL-17、IL-22属于促炎细胞因子,而IL-4为抗炎细胞因子,有研究发现MS患者血清中IFN-γ、IL-17、IL-22表达水平升高,而IL-4水平下降[12-13]。NF-κB可以调控IFN-γ、IL-17、IL-22、IL-4的表达[14-15]。NLRP3是炎症小体,NF-κB可以靶向NLRP3而调节机体免疫炎症[16]。胶质细胞激活后可引起炎症反应,使组织中炎症因子水平升高,促进MS的发生发展。
本研究建立了EAE小鼠模型对MS进行研究。EAE是以特异性致敏的CD4+T细胞介导为主的,以及以中枢神经系统内小血管周围出现单个核细胞浸润及髓鞘脱失为特征的自身免疫性疾病,是模拟MS的理想动物模型。本研究采用MBP+CFA对小鼠进行免疫,约10 d后小鼠出现明显的EAE症状,如精神疲惫、后肢无力、尾拖地和体质量下降等,且模型组神经功能评分及体质量均明显低于对照组,且小鼠脊髓出现了典型的脊髓损伤的病理改变,脊髓损伤区域出现大量免疫细胞,且星形胶质细胞标志物GFAP和小胶质细胞标志物IBA-1明显激活,提示造模成功,这与既往报道类似[4]。同时,与对照组比较,模型组小鼠血清IFN-γ、IL-17、IL-22、NLRP3水平均明显升高,而IL-4水平明显降低。HE染色结果显示,模型组可见大量的单核细胞浸润。LFB染色结果显示,模型组可见明显的脱髓鞘改变,同时,可见脊髓组织中CD4、F4/80、IBA-1、GFAP,IFN-γ、IL-17、IL-22、NLRP3蛋白的相对表达量均明显升高,IL-4的相对表达量明显降低;模型组脊髓组织细胞核中NF-κB的相对表达量明显升高,细胞质中NF-κB的相对表达量明显降低,NF-κB p65与DNA结合的活性明显增加。进一步验证了MS脊髓组织中出现了典型的自身免疫炎症反应,而这一过程与NF-κB的激活,并促进炎症因子的大量释放有关。
薯蓣皂苷属于甾体皂苷,具有调节免疫、抗氧化、抗肿瘤和抗凋亡等活性[17-18]。既往研究显示,薯蓣皂苷可以通过抑制NF-κB而改善酒精性肝纤维化、缺血性脑卒中、肝脏缺血再灌注损伤等病理改变。本研究发现,薯蓣皂苷可显著改善MS小鼠的一般情况和神经功能评分,且可以减少脊髓损伤区域单核细胞浸润和脊髓脱髓鞘的发生。中枢免疫炎症性损伤是MS的重要发病机制之一[19],本研究发现薯蓣皂苷干预后脊髓组织中活化的T细胞和巨噬细胞明显减少,并且星形胶质细胞和小胶质细胞的活化受到抑制,提示薯蓣皂苷可以通过改善中枢免疫炎症损伤而发挥治疗MS的作用。
本研究中薯蓣皂苷干预后实验性变态反性脑脊髓炎模型小鼠血清及脊髓组织中相关炎症因子水平明显降低,且NF-κB向胞核转移明显减弱,故我们推测薯蓣皂苷可能是通过阻断NF-κB的胞核转移途径来影响炎症蛋白表达,从而发挥保护EAE小鼠的作用。
综上所述,薯蓣皂苷可以改善EAE小鼠脊髓病理损伤,并且能够改善外周血和脊髓组织中炎症因子表达,其机制可能是抑制NF-κB从细胞质移位至细胞核,进而抑制NF-κB激活。本实验属于初步研究,存在一定不足,如未设立阳性对照药物组,在后续实验中将进一步开展研究。
