瞬时管电压切换单源双能CT物质分离技术定量评估肝脏脂肪变的体模研究
2021-11-22谢婷婷黎永滨严帅何冠勇郭英成官迅
谢婷婷,黎永滨,严帅,何冠勇,郭英,成官迅
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的定义是影像学和肝组织学证实肝脂肪变,并除外导致肝脂肪变的其他原因,如大量饮酒、长期应用促脂肪形成药物或单基因遗传紊乱等[1]。目前NAFLD已成为全球最常见慢性肝病,发病率28.01/1000人年~52.34/1000人年[2],年均9%进展为肝纤维化,最终发展至肝硬化、肝病相关死亡[3]。
影像学能直接反映肝脏脂肪变状态,是无创性肝脏脂肪定量评估的主要方法和发展方向,在NAFLD的诊断、严重程度分级、新疗法疗效评估方面起关键作用[4]。MRI被认为是无创性肝脏脂肪定量评估的重要方法,但MR检查预约时间长、图像采集时间长、运动伪影影响测量准确性等因素降低了其临床应用范围[5]。CT预约时间短、成像快速,双能CT可通过不同X射线能量下物质的不同衰减特征来反映组织学特性、提供定量信息,基于双能CT物质分离技术的碘、钙、尿酸盐晶体等物质的定量评估已被用于肺栓塞、肾结石、痛风的临床试验中[6-8],其在肝脏脂肪变定量评估具有巨大应用潜力。故本研究采用单源双能CT对肝脏脂肪变体模进行扫描,探讨双能CT物质分离技术定量评估肝脏脂肪变的准确性,旨在为临床无创性评估肝脏脂肪变提供新思路。
材料与方法
1.体外模型的制作
本研究经本院实验动物伦理委员会批准。取20只健康SD大鼠,由广东省医学实验动物中心提供、并经病理组织学检查证实肝脏无脂肪变,周龄为20周,体重200~225 g,均为雌性。解剖并分离大鼠肝脏,冲洗后剪碎、分装,置于4 mL聚氯乙烯(polyvinychlorid,PVC)管中,在匀浆机中匀浆。重复匀浆操作,直至新鲜肝组织全部制成匀浆液,备用。将肝匀浆与脂肪(橄榄油,商品名Olivoil,脂肪含量100.0 g/100 g)、右旋糖酐铁溶液(丹麦Pharmacosmos公司,铁浓度100 mg Fe/2 mL)充分混合,建立肝脏脂肪变模型A(不含铁)、B(含铁)。模型A脂肪体积分数分别为0%、10%、20%、30%、40%和50%(模拟正常人肝脏和临床范围内的轻、中、重度脂肪肝),共6个PVC管;模型B脂肪体积分数为0%、10%、20%、30%,根据铁浓度的不同分3组,各组铁浓度分别为5 mg/mL、20 mg/mL、25 mg/mL,共12个PVC管。保持每管总体积为4 mL,制成肝脏铁沉积伴轻、中、重度脂肪变性的模型(共18个PVC管)[7]。用悬浮震荡仪充分震荡,使样本呈均匀外观,上述样本静置6 h以上不分层则认为模型制作成功。模型A中脂肪体积分数为50%的PVC管出现分层,其相应测量数据不纳入统计学分析。
2.扫描方法
采用GE Revolution 256 CT扫描仪。按照脂肪体积分数从低到高的顺序依次将混合液置于标准体模中,即4 mL的PVC管置入体模的圆柱体凹槽内,体模为直径20 cm的圆柱体,内有9个圆柱体凹槽,每个PVC管置入后都位于凹槽的最上方,扫描时各PVC管保持同一水平。管电压80、140 kVp瞬时切换,管电流分别为200 mA、320 mA、485 mA,转速为2 s/周,DFOV(显示野,display field-of-view)25 mm×25 mm,重建层厚、间距均为0.625 mm,螺距0.984,重建算法为STND(标准算法),ASiR-V(全模型迭代重建算法,adaptive statistical iterative reconstruction-V)为50%。
3.数据测量
所有原始数据传至ADW 4.6工作站,采用GSI General MD分析软件进行后处理,重建脂肪(水)基物质对图像。于CT图像上各PVC管中心区勾画与PVC管同心圆的ROI,各放置3个直径为8 mm、面积为28.26 mm2的圆形ROI,记录后取其平均值为虚拟脂肪浓度值(virtual fat concentration,VFC),纳入数据库。
4.统计学方法
采用SPSS 21.0软件进行数据分析。对3组管电流(200、320、485 mA)下相应VFC进行单因素方差分析,具有方差齐性后再对VFC与肝脏脂肪体积分数(liver fat volume fraction,FVF)进行Spearmen相关性分析,并拟合线性方程。P<0.05为差异有统计学意义。
结 果
肝脏脂肪变模型A(不含铁):在3组管电流(200、320、485 mA)下,模型A的VFC值分别为:(36.77、-235.45、-140.45、-41.28、132.06 mg/cm3)、(94.52、-251.64、-144.17、18.35、101.31 mg/cm3)、(108.20、 -71.89、-30.12、106.60、198.65 mg/cm3)。采用三组管电流扫描体模,共获得三组共15个数据。实际脂肪体积分数10%~40% 相应的VFC与FVF均呈线性正相关(r=0.885,P<0.001),拟合线性方程为y=0.072x+27.138 (y为FVF、x为VFC,P<0.001,F值为41.37,调整R2为0.786),而实际脂肪体积分数0%~40% 相应的VFC与FVF无相关性(r=0.371,P=0.173,图1),扫描结果见图2。
肝脏脂肪变模型B(含铁,模型B内三组样本脂肪体积分数FVF均为0%、10%、20%、30%):管电流为320 mA条件下,肝脏脂肪变模型B(含铁)的VFC值分为(合并5 mg/mL肝脏铁沉积组:-895.29、-660.87、 -618.09、-606.96 mg/cm3)、(合并20 mg/mL肝脏铁沉积组:-1448.85、-1390.78、-1109.27、-997.91 mg/cm3)、(合并25 mg/mL肝脏铁沉积组:-3098.14、-2958.63、-2972.25、-2585.88 mg/cm3)。以模型A(铁浓度为0 mg/mL)为对照,在同一FVF值水平,随着铁浓度的升高、VFC值逐渐减低(图3),提示铁的合并存在影响脂肪定量评估,表现为铁导致VFC值降低,铁浓度越高、VFC低估脂肪体积分数的程度越重。
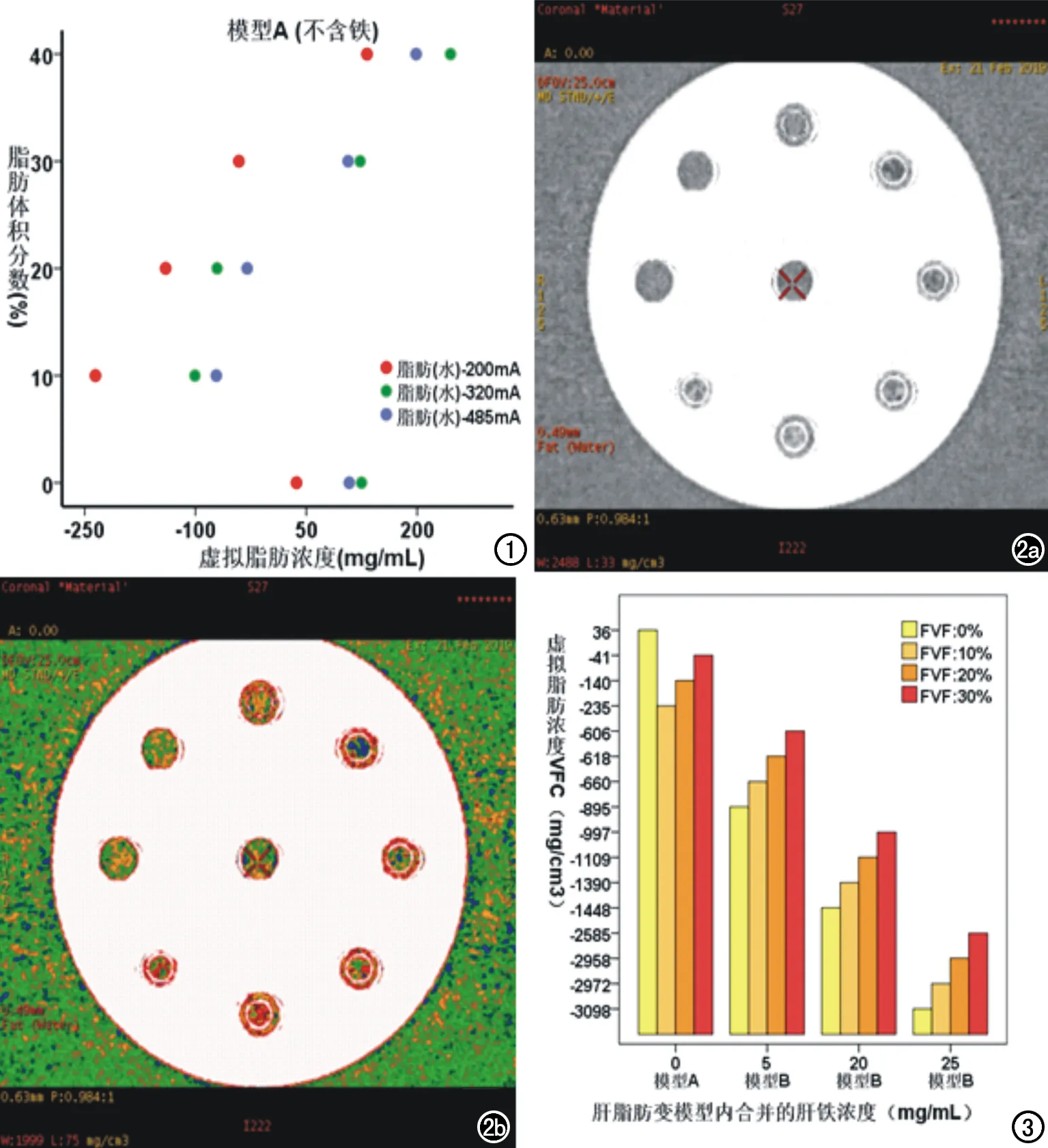
图1 在不同管电流下,肝脏脂肪变模型A(不含铁)内实际脂肪体积分数10%~40%相应的虚拟脂肪浓度与脂肪体积分数呈线性正相关,而实际脂肪体积分数0%~40% 相应的虚拟脂肪浓度与脂肪体积分数无相关性。 图2 肝脏脂肪变模型A的CT扫描冠状面图像,显示类圆形体模内共9个管、其中6个PVC管内含不同含量的大鼠肝匀浆和脂肪,自12点方位开始沿顺时针方向至8点方位,PVC管内所含脂肪体积分数依次为50%、40%、30%、20%、10%、0%。a)40%~10%相应PVC管内的密度呈逐渐升高趋势;b)伪彩图示40%~10%相应PVC管内的伪彩随着脂肪体积分数的改变而改变。 图3 肝脏脂肪变模型A铁浓度为0 mg/mL,根据铁浓度的不同将肝脏脂肪变模型B(含铁)分为三组、铁浓度分别为5 mg/mL、20 mg/mL、25 mg/mL。以模型A为对照,在同一FVF值水平,随着铁浓度的升高、虚拟脂肪浓度值逐渐下降,铁浓度越高、虚拟脂肪浓度值越低。
讨 论
NAFLD包括全部的脂肪性肝病疾病谱,非酒精性单纯性脂肪肝(NAFL)、脂肪性肝炎(NASH)、脂肪性肝炎肝硬化(NASH肝硬化),为全球最常见的慢性、进展性肝脏疾病[9]。已证实NAFLD的主要病因有肥胖、2型糖尿病、胰岛素抵抗、血脂异常和遗传性疾病[9],新近研究发现的危险因素包括睡眠呼吸暂停、结直肠癌、骨质疏松等[10]。NAFLD具有家族聚集性和遗传倾向,18%的NASH一级亲属有患病风险[11]。目前,尚没有FDA批准用于治疗NASH的药物,减重和改变生活方式仍是改善NAFLD的唯一方式[12]。
NAFLD为进展性疾病,肝脏的改变始于简单的肝细胞脂肪变性,很容易发展到更严重的NASH、肝纤维化和肝硬化,最终导致终末期肝病、肝细胞癌;而从NAFL进展到NASH、肝纤维化通常无症状[12],故大部分患者往往到终末期肝病、出现临床症状时才引起重视,而此时唯一的治疗方法只有肝移植。故无创性筛查、早期诊断并监测NAFLD进展至关重要。
肝组织活检是诊断NAFLD的金标准,但其有创、成本高、存在取样误差及相关并发症,不适用于作为NAFLD的筛查和监测手段[13]。MRI质子密度脂肪分数(MRI-proton-density fat fraction,MRI-PDFF)被认为是最可能取代肝脏活检的无创性定量手段[5]。CT因存在电离辐射、并不推荐将CT作为NAFLD的主要筛查手段,但CT在腹部疾病影像诊断中起核心作用、仍是腹部疾病最常用的影像学检查方式[14],鉴于脂肪肝疾病的高发病率和CT在腹部检查的广泛应用,双能CT有潜力为因其它原因而接受扫描的NAFLD患者提供检查目的之外的肝脏脂肪变定量信息。因此,探究DECT定量评估肝脏脂肪变的准确性具有临床意义。
常规CT平扫,肝细胞内脂肪的沉积导致肝脏CT值下降,当肝脏CT值≤40 HU、或肝脏CT低于脾脏10 HU以上即可诊断脂肪肝,敏感性度、特异度分别为46%~72%、88%~95%[15]。但肝脏CT值的降低并不是肝脏脂肪变的特异性表现、血红蛋白的下降同样导致肝脏CT值降低,且通过CT值降低来反映肝脏脂肪变并不准确,因为其结果易受肝内铁、铜、糖原沉积和贫血等因素的影响[16]。双能CT同时或几乎同时采集不同组织在高低两种不同能量(80 kVp和140 kVp)下的光子能量的衰减特性。当入射光子能量的增加,大多数组织的衰减率降低。在常规CT成像的光子范围内,脂肪优先衰减高能光子而非低能光子,在较低的光子能量下,光电效应占主导地位,由于脂肪比其他软组织含有更多的氢原子(较低的有效原子数),而且光电效应的大小与有效原子数相关,所以脂肪在较低的光子能量下引起的衰减比其他组织小;在较高的光子能量下,散射入射光束的康普顿效应起主导作用,由于康普顿效应与电子密度相关,脂肪的电子密度相对于其他组织大,因此与其他组织不同,脂肪会优先减弱高能光子[14,17-18]。这样,双能CT在无需对比剂、不增加扫描流程的前提下,通过识别脂肪独特的衰减曲线、来提供比常规CT更多的组织能量学范畴信息,提供诸多反映组织本质特征的量化指标,进而实现对脂肪的分离和量化。
本研究首先建立2个肝脏脂肪变体外模型(模型A不含铁、模型B含铁),模型A模拟人体正常肝组织、轻、中、重度肝脏脂肪变,模型B模拟肝脏脂肪变合并肝脏铁沉积,采用双能CT能谱扫描模式扫描,获取VFC;结果发现模型A肝脂肪体积分数10%~40%相应VFC与FVF呈线性正相关、但肝脂肪体积分数0~40%相应VFC与FVF无相关性,提示双能CT物质分离技术可用于脂肪体积分数10%~40%范围内的肝脂肪定量评估,其在脂肪体积分数0~40%范围内的准确性并未得到验证。Hyoodo等采用双源双能CT多物质分离(multimaterial decomposition,MMD)技术体外模型探讨VFC与FVF(0~30%)的相关性,发现VFC与FVF呈明显正相关(ρ=0.97,P<0.001)[19],与本研究结果不同,可能与二者所用设备(单源与双源的差别)、物质分离算法(基物质对分离算法与多物质分离算法的差别)相关,且目前国内MMD软件尚未商业化、一定程度上限制了其临床应用范围。Artz等[14]采用单源双能CT扫描体外模型(原料为水、花生油、凝胶、琼脂、十二烷基硫酸钠、叠氮化钠和氯化钠),发现VFC值与滴定的甘油三脂含量(0%~50%)呈明显正相关(r=0.98,P≤0.001),但在临床试验上VFC与MRS脂肪分数只呈中度相关(r=0.423,P≤0.001)[17]。故基于单源双能CT物质分离技术定量肝脏脂肪变的准确性、尤其是在评估脂肪体积分数0~10%范围内(因为脂肪体积分数5%作为诊断肝脏脂肪变的阈值)的准确性需要更详细的体膜实验、动物实验或临床试验验证。
探讨单源双能CT物质分离技术定量肝脏脂肪变的准确性,需包括探讨肝脏铁沉积对肝脏脂肪变定量评估的影响。肝内铁沉积和脂肪沉积同时存在为临床常见现象,在常规CT上,铁的同时存在导致肝脏CT值升高、从而低估肝脏脂肪变严重程度[20]。本研究模型B结果显示,在同一FVF值水平,随着铁浓度的升高、虚拟脂肪浓度值呈下降趋势,铁浓度越高、虚拟脂肪浓度值越低。即铁的存在可能影响单源双能CT物质分离技术定量评估肝脏脂肪变的准确性,这与以往研究所得的结果相似[19,21]。
本研究存在以下不足。首先,本研究为体模研究,尽管试验结论基于虚拟脂肪浓度与金标准(组织甘油三脂浓度)的相关性,但其在临床应用中的推广仍需要进一步的临床试验数据进行验证;其次,本研究采用大鼠肝匀浆与脂肪充分混合的方法建立肝脏脂肪变模型,虽然大部分无创性肝脏脂肪定量评估文献均采用相似的建模方法[8,14,16,18-19]、但建立的模型属于肝细胞外脂质沉积,无法完全模拟人体肝细胞脂质沉积,未来将通过动物实验、临床试验对瞬时管电压切换单源双能CT物质分离技术定量评估肝脏脂肪变的准确性进一步探讨。最后,本研究模型B样本数较少,虽然既往关于肝脏脂肪定量的体外研究通过较少的样本量得出类似结论[18],但增加样本量以加大检验效能仍然是必要的,未来将细化滴定脂肪浓度、增加样本量,以进一步推断、验证铁对单源双能CT物质分离技术定量评估肝脏脂肪变准确性的影响。
综上所述,瞬时管电压切换单源双能CT物质分离技术可用于脂肪体积分数10%~40%范围内的肝脏脂肪变定量评估,铁的存在导致VFC测量值降低。
