热应激联合HBsAg刺激增强人树突状细胞免疫学特性
2021-11-22黄新亮余方流王凤各董博翰
黄新亮,余方流,王凤各,董博翰
(皖南医学院基础医学院,安徽 芜湖 241002)
据世界卫生组织报道,全球约有2.57亿乙型肝炎病毒(Hepatitis B Virus,HBV)慢性感染者,每年约有88.7万人死于HBV感染相关疾病。中国一般人群慢性HBV感染者约7 000万例,对中国社会造成沉重的经济负担[1]。研究者发现慢性乙型肝炎患者树突状细胞(dendritic cell,DC)的功能低下可导致患者体内T、B细胞的耐受状态[2]。如何制备DC疫苗、增强其免疫活性及抗HBV的细胞毒效应成为难题。
DC疫苗的安全性方面,德国美因茨大学(Mainz University)Jonuleit H等[3]发现TNF-a、IL-1b和IL-6 3种CK(细胞因子)组合后,在无牛血清培养体系中能够将未成熟DC诱导成完全成熟的DC,避免了动物血清培养DC对人产生的毒副作用。DC疫苗的有效性方面,Tomoko Ichiyanagi发现经42℃热应激后DC中的内源性热休克蛋白即HSP90对OVA抗原在抗原交叉呈递过程中也起着至关重要的作用[4];也有研究者在Nature期刊发文指出外来的HSP亦能促进DC成熟[5]。
本研究基于DC的安全应用技术和热休克蛋白增强疫苗有效性的理论,进一步探讨热应激和HBsAg刺激的树突状细胞的免疫特性(成熟度、HSP90的表达及功能、激活CTL的能力)及其诱导的特异性CTL的细胞毒效应。
1 材料与方法
1.1 材料
1.1.1 对象 选择健康志愿者,纳入标准:年龄均为20岁,经健康体检HBV为阴性且无乙型肝炎发病史。
1.1.2 主要试剂 静脉血中分离的人淋巴细胞。HBsAg、无血清AIM-V培液、HepG2.2.15(转染HBV的DNA)、荧光素标记抗人CD3单克隆抗体和抗人CD8单克隆抗体、IL-2、TNF-α、IL-4、IL-1b、IL-6和GM-CSF(Biolegend公司);HSP90的ELISA 试剂盒(上海森雄科技有限公司进口分装)。
1.2 方法
1.2.1 制备DC疫苗 实验细胞分4组,每组7例。热应激联合HBsAg组:即HBsAg联合42℃加热刺激DC。利用密度梯度离心法分离人外周血单个核细胞(peripheral blood mononuclear cell,PBMC),将分离的PBMC置于4孔板中,在37℃、含5% CO2的培养箱中培养2 h; 4孔板中贴壁的为DC(收集未贴壁的细胞并且冻存,以便后期和DC共培养)。向4孔板中加入3毫升/孔无血清AIM-V培液和100 ng/ml GM-CSF、100 ng/ml IL-4。第4天DC中加入HBsAg(10 ng/ml)并经过42℃培养30 min。加入CK后显微镜观察细胞形态的变化,CK按照文献常规加入:TNF-a 10 ng/ml、IL-1b 10 ng/ml、IL-6 1000 U/ml,收集第8天实验组和对照组的DC准备鉴定[3]。热应激组:DC经过 42℃培养30 min,不负载HBsAg,其余和热应激联合HBsAg组相同。HBsAg组:DC负载HBsAg,不用42℃温度处理,其余和热应激联合HBsAg组相同。对照组:DC不负载HBsAg、也不经42℃温度处理,其余和热应激联合HBsAg组相同。
1.2.2 流式细胞仪鉴定 DC培养过程中,倒置显微镜观察细胞形态学变化;采用流式细胞仪检测各组DC表面标志分子CD80、CD40及HLA-DR的变化。
1.2.3 ELISA法检测HSP90 按照热休克蛋白90(HSP-90)ELISA检测试剂盒说明书检测,于波长450 nm的酶标仪上读取各孔的A值,以吸光度A值为纵坐标(Y),相应的HSP-90标准品浓度为横坐标(X),做得相应的曲线,样品的HSP-90含量可根据其A值由标准曲线换算出相应的浓度。
1.2.4 DC刺激自身淋巴细胞反应与鉴定的方法 各组DC疫苗刺激自身淋巴细胞:收集第8天实验组和对照组的DC,计数以1×106个/毫升作为刺激细胞,加入到4孔板中(实验组和对照组DC数相同)。复苏冻存的初始T细胞,计数,按T细胞:DC=20∶1的比例往DC中加入初始T淋巴细胞。加入500 IU/ml IL-2,置于37℃、含5% CO2的培养箱中培养,4 d后收集活化的T细胞。台盼蓝染色后显微镜观察细胞形态和活性。检测CD8+T细胞:每孔100 μl PBMC细胞悬液中加入5 μl PE标记的抗人CD3克隆抗体、5 μl FITC标记抗人CD8单克隆抗体,4℃避光染色30 min,用3%FBS-PBS洗细胞1次,悬浮于500 μl 3%FBS-PBS中,4℃避光保存,荧光抗体染色后,用流式细胞仪C6检测,获取细胞数不少于100 000个。
1.2.5 LDH法检测DC诱导的特异性 CTL细胞毒效应检测细胞毒性T细胞(cytotoxic T lymphocyte,CTL)杀伤活性以乳酸脱氢酶(lactate dehydrogenase,LDH)法,靶细胞为HepG2.2.15(转染HBV的DNA),效靶比为1∶25。CTL杀伤活性=(效靶混合细胞释放A值-自然释放A值)/(最大释放A值-自然释放A值)。

2 结果
2.1 各组DC中表达CD80、CD40、HLA-DR的比率比较 热应激联合HBsAg组(heat stress combined with HBsAg组)DC中表达CD80、CD40、HLA-DR分子的比率显著高于热应激组(heat stress组)、HBsAg组和对照组(P<0.05),见图1。

注:A为CD80表达;B为CD40表达;C为HLA-DR表达;与control组比较,*P<0.05;与heat stress组比较,#P<0.05;与HBsAg组比较,△P<0.05。
2.2 各组DC中表达HSP90水平比较 热应激联合HBsAg组DC中表达HSP90水平显著高于热应激组、HBsAg组和对照组(P<0.05),见图2。
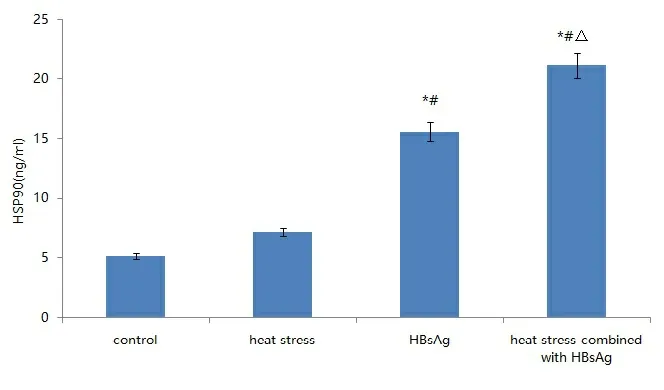
注:与control组比较,*P<0.05;与heat stress组比较,#P<0.05;与HBsAg组比较,△P<0.05。
2.3 各组DC中HSP90水平与表达CD80、CD40及HLA-DR的比率的线性相关分析 热应激联合HBsAg组HSP90水平与DC中表达CD80、CD40及HLA-DR的比率呈现正相关(见图3),相关系数r分别是0.73、0.69、0.78;热应激组、HBsAg组、对照组HSP90水平与该组DC中表达CD80、CD40及HLA-DR的比率呈现无相关(相关系数=0)。
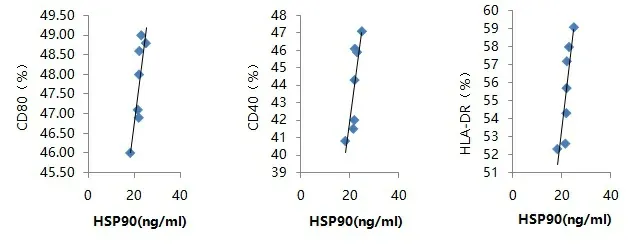
图3 热应激联合HBsAg组HSP90与CD80、CD40、HLA-DR的比率的线性相关分析
2.4 各组DC刺激自身淋巴细胞增殖的比率 热应激联合HBsAg组DC刺激自身淋巴细胞增殖,T细胞中CD3+CD8+T的比率显著高于热应激组、HBsAg组和对照组(P<0.05),见图4。
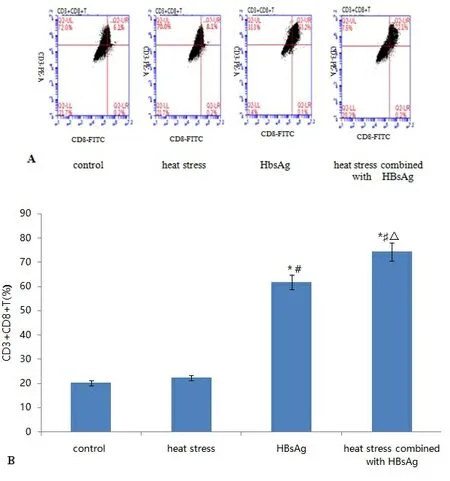
注:与control组比较,*P<0.05;与heat stress组比较,#P<0.05;与HBsAg组比较,△P<0.05。
2.5 各组DC诱导的特异性CTL细胞毒效应 热应激联合HBsAg组CTL杀伤活性的百分率明显高于热应激组、HBsAg组和对照组(P<0.05),见表1。

表1 各组DC诱导的CTL对靶细胞的细胞毒效应
3 讨论
本研究为探索DC免疫活性的增强提供了新思路。Ichiyanagi T等[4]发现经42℃热应激后DC中的内源性HSP90对OVA抗原在抗原交叉呈递过程起着至关重要的作用;也有研究者发现DC之外的外源性HSP与CD91受体结合进入树突状细胞,亦能促进DC成熟[5]。HSP70/HBxAg复合物促进DC的成熟、HSP通过MHCI和Ⅱ类分子将肿瘤相关抗原呈递给抗肿瘤CD8+T和CD4+T细胞并使之活化,这将会促进针对癌症和传染病的新一代预防和治疗候选DC疫苗的产生[6-8]。而本研究发现热应激联合HBsAg刺激的DC比HBsAg和热应激分别刺激的DC抗原提呈活性更强,且能诱导自身淋巴细胞增殖、产生更多特异性CTL。这些发现为探索DC免疫活性的增强提供了新途径。
本研究为提高CTL抗HBV的细胞毒效应提供新佐证。已有研究表明,慢性HBV感染者发生免疫耐受的重要原因是HBsAg特异性细胞毒性T细胞数量缺乏和(或)功能不足[9]。因而选择合适的易受HBV感染的人群进行免疫治疗,才能体现治疗性疫苗的功效[10]。本研究发现热应激联合HBsAg刺激的DC诱导的特异性CTL具有更强的细胞毒效应,这一发现为探究抗HBV的细胞毒效应提供新佐证。
本研究亦为开发治疗慢性乙肝的安全、有效的DC疫苗提供新的实验依据。一方面,本研究从临床前期研究出发,以人外周血单个核细胞制备DC,在无动物血清培养体系中将未成熟DC诱导成完全成熟的DC;从而避免疫苗中动物血清成分对人体的毒副作用。另一方面,世界卫生组织提出了2030年消除病毒性肝炎的目标[11-12],这给有效治疗慢性乙型肝炎带来挑战。而本研究发现热应激联合HBsAg刺激的树突状细胞具有良好的抗原提呈能力,其能诱导更明显的特异性CTL细胞毒效应。这为临床研发有效地治疗慢性肝炎的DC疫苗提供依据,有望成为治疗慢性肝炎的新的候选疫苗。从本研究的结果可知,与热应激、HBsAg分别刺激DC比较,热应激联合HBsAg刺激的DC成熟度、HSP90的表达水平及激活CTL的能力均提升,且能诱导更明显的特异性CTL细胞毒效应。但HSP90以何种信号转导机制促进DC的免疫活性,有待深入研究。另外受条件限制,未进行研究对象的性别和不同年龄段的分类研究,因而研究结果有一定的局限性。
