愈风宁心滴丸预防性治疗血管痉挛性偏头痛的作用及机制研究
2021-11-21蒋晓萌杨代刚高永耀邹庭峰施存元段亚君杨潇潇
蒋晓萌,杨代刚,高永耀,邹庭峰,施存元,江 宏,段亚君,杨潇潇*
愈风宁心滴丸预防性治疗血管痉挛性偏头痛的作用及机制研究
蒋晓萌1,杨代刚2,高永耀2,邹庭峰2,施存元1,江 宏1,段亚君2,杨潇潇2*
1.浙江尖峰药业有限公司,浙江 金华 321000 2.合肥工业大学,安徽 合肥 230001
观察愈风宁心滴丸对硝酸甘油诱导的偏头痛小鼠的影响,探索愈风宁心滴丸预防性治疗血管痉挛性偏头痛的作用及机制。采用脂多糖(lipopolysaccharide,LPS)刺激BV2神经小胶质细胞,以愈风宁心滴丸(10、50、100 μmol/L)及葛根素(50 μmol/L)进行干预,收集细胞。将野生型C57BL/6J小鼠随机分成照组、模型组以及愈风宁心滴丸低、中、高剂量(200、360、600 mg/kg)组和葛根素组(37.8 mg/kg),给予药物进行干预,于第3、5、7、9、11天ip硝酸甘油溶液(10 mg/kg)建立小鼠偏头痛模型,第3天开始进行痛觉敏感(机械压痛和热敏耐受)行为学实验;实验结束后,取小鼠血清和脑组织。检测各组BV2细胞活性氧含量;采用Western blotting法检测各组细胞超氧化物歧化酶1(superoxide dismutase 1,SOD1)、SOD2蛋白表达以及各组小鼠三叉神经脊束尾核(trigeminal nucleus caudalis,TNC)区降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、c-Fos、磷酸化细胞外信号调节激酶(phosphorylated extracellular regulated protein kinases,p-ERK)及促炎细胞因子白细胞介素-6(interleukin-6,IL-6)蛋白表达;采用qRT-PCR法检测各组细胞、、、肿瘤坏死因子-α(tumor necrosis factor-α,)mRNA表达以及小鼠TNC区、mRNA表达;采用免疫荧光检测各组小鼠TNC区CGRP、c-Fos表达;采用生化分析仪检测各组小鼠血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和碱性磷酸酶(alkaline phosphatase,ALP)活性。愈风宁心滴丸显著上调BV2细胞抗氧化酶、mRNA和蛋白表达水平(<0.05、0.01、0.001),降低活性氧水平(<0.01、0.001),抑制炎症因子和mRNA表达(<0.001)。与对照组相比,模型组小鼠基础痛阈值显著降低(<0.05、0.001),TNC区中CGRP、c-Fos、p-ERK蛋白表达水平显著升高(<0.01、0.001),TNC区、mRNA和IL-6蛋白表达水平显著升高(<0.01);与模型组相比,各给药组小鼠基础痛阈值显著升高(<0.05、0.01、0.001),TNC区中CGRP、c-Fos、p-ERK蛋白表达水平显著降低(<0.05、0.01、0.001),TNC区、mRNA和IL-6蛋白表达水平显著降低(<0.05、0.01、0.001),且呈剂量相关性;愈风宁心滴丸对偏头痛小鼠血清中ALT、AST和ALP活性无显著性影响。愈风宁心滴丸可能通过抑制血管扩张、抑制炎症反应、促进抗氧化酶表达等多重途径发挥预防性治疗血管痉挛性偏头痛的作用。
愈风宁心滴丸;偏头痛;神经小胶质细胞;血管扩张;神经炎症
脑血管的舒缩功能受阻会导致偏头痛[1]。当颅内血管收缩时,引起偏头痛先兆症状的产生,随后出现颅内外血管扩张。这一过程使得血管周围组织持续产生血管活性多肽,进一步造成颅内外血管过度扩张,引起搏动性的头痛[2]。具有收缩血管作用的药物麦角胺能够缓解偏头痛为此提供了有力证明[3]。此外,有临床研究报道,发作性神经-血管功能障碍引起的阵发性血管痉挛是偏头痛发生的主要机制[4]。目前较多研究表明中枢敏化增加了偏头痛患者的发病频率,即逐渐演变为慢性偏头痛,表现出患者头面部、肢体或其他皮肤部位的痛觉过敏[5]。偏头痛中枢敏化的主要区域为痛觉通路中三叉神经脊束尾核部位(trigeminal nucleus caudalis,TNC),该区域异常神经元信号调控引起中枢敏化[6]。随着人们对小胶质细胞研究的深入,发现小胶质细胞及其分泌的炎症因子参与了慢性偏头痛中枢敏化的调节[7-8]。
愈风宁心滴丸是根据中医传统理论,采用现代医学新技术,以葛根为原料研制而成的一种高效、速效的纯中药滴丸剂。大量实验证明,葛根及其提取物葛根素能改善微循环,增加脑和冠状动脉血流量,改善缺铁新机代谢,对高血压、头痛、项强症状、冠心病、心绞痛等均有显著疗效[9]。此外,相关研究表明葛根素具有治疗慢性神经性疼痛的作用,但其具体机制尚不清晰[10]。葛根素作为愈风宁心滴丸的重要成分,表明愈风宁心滴丸具有治疗血管痉挛性偏头痛的潜在作用。本研究旨在通过动物和细胞水平的研究,确定愈风宁心滴丸对血管痉挛性偏头痛的作用,并阐明可能的作用机制,为其临床推广提供理论依据。
1 材料
1.1 动物
SPF级雄性野生型C57BL/6J小鼠,8周龄,购自江苏集萃药康生物科技股份有限公司,动物许可证号SCXK(苏)2018-0008。小鼠分笼饲养于合肥工业大学实验动物中心,自然光照,温度(22±2)℃,湿度(50±5)%,自由进食饮水。在开始动物实验之前,小鼠于实验中心适应1周。动物实验操作均严格按照实验动物伦理学相关规定进行(动物实验伦理批准号HFUT20200901005)。在治疗期间,每日记录小鼠体质量,没有观察到因实验操作产生的不良影响。
1.2 细胞
BV2神经小胶质细胞购自美国ATCC。
1.3 药品与试剂
愈风宁心滴丸(批号200303)由浙江尖峰药业有限公司提供,每丸含葛根素6.3 mg;葛根素(质量分数≥99%)购自中国食品药品检定研究院;脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司;DMEM培养基(批号2114090)购自美国Corning公司;降钙素基因相关肽(calcitonin gene-related peptide,CGRP)单克隆抗体(批号A5328)、c-Fos单克隆抗体(批号A0236)、细胞外信号调节激酶(extracellular regulated protein kinases,ERK)单克隆抗体(批号A4782)、白细胞介素-6(interleukin-6,IL-6)单克隆抗体(批号A17361)、超氧化物歧化酶1(superoxide dismutase 1,SOD1)单克隆抗体(批号A0274)、SOD2单克隆抗体(批号A1340)购自武汉爱博泰克生物科技有限公司;磷酸化ERK(p-ERK)单克隆抗体(批号A80031-1-RR)、热休克蛋白90(heat shock protein 90,HSP90)单克隆抗体(批号13171-1-AP)、HRP标记的α-Tubulin抗体(批号HRP-66031)购自美国Proteintech公司;HRP标记的山羊抗兔二抗(批号LK2001)购自天津三箭生物技术有限公司;ECL化学发光液(批号RL241930)购自美国Thermo Fisher Scientific公司;活性氧(reactive oxygen species,ROS)试剂盒(批号KFS344)购自北京百奥莱博科技有限公司;总RNA提取试剂(批号70087434)购自Biosharp公司;逆转录试剂盒(批号R123-01)购自南京维诺赞生物科技有限公司;丙氨酸转氨酶(alanine aminotransferase,ALT)检测试剂盒(批号200722103)、天冬氨酸转氨酶(aspartate aminotransferase,AST)检测试剂盒(批号200818101)、碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(批号201120101)购自美康生物科技股份有限公司。
1.4 仪器
电泳仪(美国Bio-Rad公司);微量高速冷冻离心机(美国Beckman公司);多功能酶标仪(美国BioTek公司);超纯水系统(德国Millipore公司);超微量检测仪(美国Pultton公司);qRT-PCR仪(瑞士Roche公司);冰冻切片机、激光共聚焦显微镜(德国Leica公司);全自动生化分析仪(日本Hitachi公司);YLS-12S型鼠尾光照测痛仪、YLS-3E型电子压痛仪(济南益延科技发展有限公司)。
2 方法
2.1 MTT法检测细胞活性
基于文献中葛根素对神经胶质细胞的相关研究报道[11],确定体外实验中葛根素浓度为10~100 μmol/L。将BV2细胞的培养基更换为无血清培养基,分别加入葛根素(50 μmol/L)以及愈风宁心滴丸(10、50、100 μmol/L)预处理1 h,随后加入LPS(1 μg/mL)共同处理18 h,最后加入MTT溶液(0.5 mg/mL),孵育4 h,加入DMSO溶解后,采用酶标仪测定550 nm处的吸光度()值。
2.2 细胞ROS检测
用不同浓度的愈风宁心滴丸(10、50、100 μmol/L)及葛根素(50 μmol/L)处理BV2细胞1 h,然后加入LPS(1 μg/mL)共同处理18 h,最后加入10mmol/L DCFH-DA探针进行反应,并于激发波长488 nm及发射波长525 nm处检测荧光强度。
2.3 动物造模、分组与给药
根据愈风宁心滴丸说明书的指导,基于成人1 d内用药剂量,利用体表面积法换算成小鼠1 d用药剂量约为360 mg/kg(以此剂量作为中剂量组);在整体动物实验中小鼠给药剂量一般按照2倍左右剂量差(约200 mg/kg)进行递增/减,因此选择200 mg/kg作为低剂量组给药剂量;在此基础上,为避免给药剂量过大,以200 mg/kg剂量差设计了高剂量组给药剂量(600 mg/kg);本研究所用愈风宁心滴丸中葛根素质量分数为10.5%,因此设计了与中剂量组剂量相应的葛根素组给药剂量为37.8 mg/kg。
综上,将小鼠随机分成对照组、模型组以及愈风宁心滴丸低、中、高剂量(200、360、600 mg/kg)组和葛根素(37.8 mg/kg)组,每组8只。造模组及给药组于第3、5、7、9、11天ip硝酸甘油溶液(10 mg/kg)建立小鼠偏头痛模型[12],ip硝酸甘油溶液几分钟后,可观察到小鼠耳朵发红、镇静、不定时有挠头现象;对照组ip等体积0.9%氯化钠溶液。各给药组小鼠每日喂食含相应剂量药物的食物,对照组和模型组正常饮食。
2.4 痛觉敏感行为学实验
头痛是偏头痛的一个特征,异常皮肤疼痛是超敏反应的一种表现。对小鼠进行痛觉敏感性实验(机械压痛实验和热敏耐受实验),能够初步判断愈风宁心滴丸是否具有治疗偏头疼的作用。在实验的第3、5、7、9、11天进行痛觉敏感行为学测定,即在每次ip硝酸甘油溶液当天测试小鼠痛阈值,作为基线痛阈值,以此反映出随着硝酸甘油溶液注射次数以及给药次数的增加,各给药组小鼠基础超敏反应的差异。
2.4.1 机械压痛实验 采用电子压痛仪对小鼠尾根部1~2 cm处施加逐渐增大的压力,待小鼠因为压痛而尖叫或者挣扎时,记录此时的压力值,每次记录3次取平均值,以此数值作为小鼠的压痛阈值。
2.4.2 热敏耐受实验 采用鼠尾光照测痛仪对小鼠尾根部1~2 cm处给予一定的光照,待小鼠因为热痛而弹开尾巴时,仪器自动记录小鼠开始接近光源至尾巴弹开时的时间,每次记录3次取平均值,以此数值作为小鼠的热痛阈值。
2.5 Western blotting检测BV2细胞和偏头痛小鼠TNC区组织蛋白表达
用不同浓度的愈风宁心滴丸(10、50、100 μmol/L)及葛根素(50 μmol/L)处理BV2细胞1 h,然后加入LPS(1 μg/mL)共同处理18 h,收集细胞,加入裂解液提取蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶于室温封闭1 h,分别加入SOD1、SOD2、HSP90和α-Tubulin抗体,4 ℃孵育过夜;加入相应二抗,常温孵育1 h,加入ECL化学发光试剂,采用成像设备显影。
最后1次ip硝酸甘油溶液24 h后,小鼠安乐死,取小鼠脑TNC区组织,同裂解液研磨后,4 ℃、12 000 r/min离心10 min,取上清液。采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶于室温封闭1 h,分别加入CGRP、c-Fos、p-ERK、ERK、IL-6、HSP90抗体,4 ℃孵育过夜;加入相应二抗,常温孵育1 h,加入ECL化学发光试剂,采用成像设备显影。
2.6 qRT-PCR检测BV2细胞和偏头痛小鼠TNC区组织相关基因表达
用不同浓度的愈风宁心滴丸(10、50、100mmol/L)及葛根素(50 μmol/L)处理BV2细胞1 h,然后加入LPS(1 μg/mL)共同处理18 h,收集细胞。按照试剂盒说明书分别提取细胞和偏头痛小鼠TNC区组织总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。

表1 引物序列
2.7 免疫荧光染色检测偏头痛小鼠TNC区CGRP和c-Fos蛋白表达
麻醉小鼠后,依次用PBS溶液和多聚甲醛对小鼠经心灌流处理,分离脑组织,干冰速冻,于多聚甲醛固定24 h,再依次用20%、30%的蔗糖溶液充分脱水,直至组织沉陷。OCT包埋组织后,切取10mm组织切片,于−40 ℃冻存。染色时,取出组织片于室温放置30 min挥发OCT,经破膜、2%BSA封闭、抗体孵育、DAPI染核、封片等步骤后使用激光共聚焦显微镜拍照。
2.8 生化分析仪检测偏头痛小鼠血清中AST、ALT和ALP活性
实验结束后,获取小鼠全血,静止2 h后,于2000×条件下离心20 min,得血清。采用PBS稀释3倍后,按照试剂盒说明书指示,通过生化分析仪检测血清中AST、ALT和ALP活性。
2.9 统计学分析
3 结果
3.1 愈风宁心滴丸抑制BV2细胞中炎症因子和活性氧水平
TNC区小胶质细胞的氧化应激反应可激活小胶质细胞,从而引发炎症,导致神经元细胞激活,增加痛觉敏感。如图1-A所示,各组细胞存活率均无显著差异,表明本研究所用该药物浓度对BV2细胞细胞活性没有影响。如图1-B所示,与对照组比较,模型组细胞ROS水平显著升高(<0.001);与模型组比较,各给药组ROS水平显著降低(<0.01、0.001)。
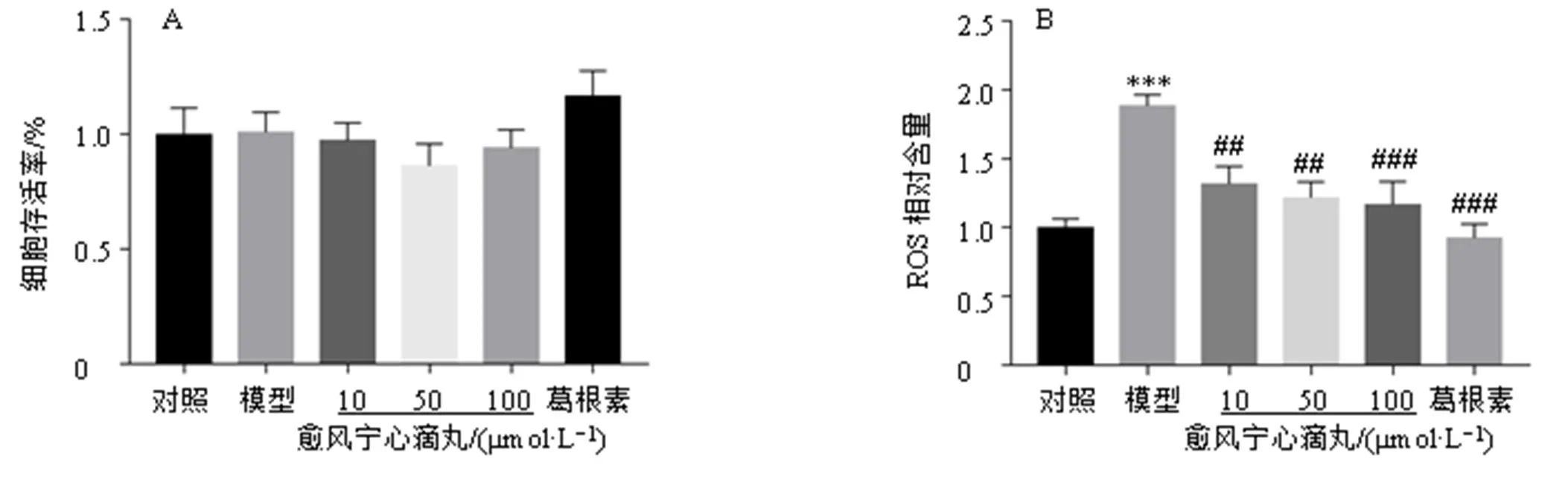
与对照组比较:**P<0.01 ***P<0.001;与模型组比较:#P<0.05 ##P<0.01 ###P<0.001,图2~5、7、8同
如图2所示,与对照组比较,模型组细胞、mRNA和蛋白表达水平显著降低(<0.01、0.001);与模型组比较,各给药组、mRNA和蛋白表达水平显著升高(<0.05、0.01、0.001)。表明愈风宁心滴丸能够通过调控抗氧化物酶的表达发挥抑制ROS的作用。
此外,炎症也是诱导神经元激活的另一个重要因素。如图3所示,与对照组比较,模型组细胞、mRNA表达水平显著升高(<0.001);与模型组比较,各给药组、mRNA表达水平显著降低(<0.001)。上述结果表明,愈风宁心滴丸对BV2细胞具有很好的抗氧化、抗炎作用,提示其在体内可能也具有较好的保护作用。
3.2 愈风宁心滴丸改善偏头痛小鼠的痛觉敏感
通过电子压痛仪及光照测痛仪对小鼠尾部进行痛觉耐受检测,即痛觉敏感性实验(机械压痛实验和热敏耐受实验)。痛觉敏感性实验能够初步判断愈风宁心滴丸是否具有治疗偏头疼的作用。如图4所示,各组小鼠给药前的基础痛阈值无显著差异,第1次ip硝酸甘油溶液后,与对照组对比,模型组的基础痛阈值开始降低,并且在反复ip硝酸甘油溶液后小鼠基础热痛阈值以及压痛阈值显著降低(<0.05、0.001),提示痛觉过敏的产生。给予愈风宁心滴丸及葛根素治疗后,小鼠的热痛阈值以及压痛阈值显著升高(<0.05、0.01、0.001),表明愈风宁心滴丸可以改善偏头痛小鼠表现出的痛觉敏感。

图2 愈风宁心滴丸上调BV2细胞抗氧化酶SOD1和SOD2的表达(, n = 3)
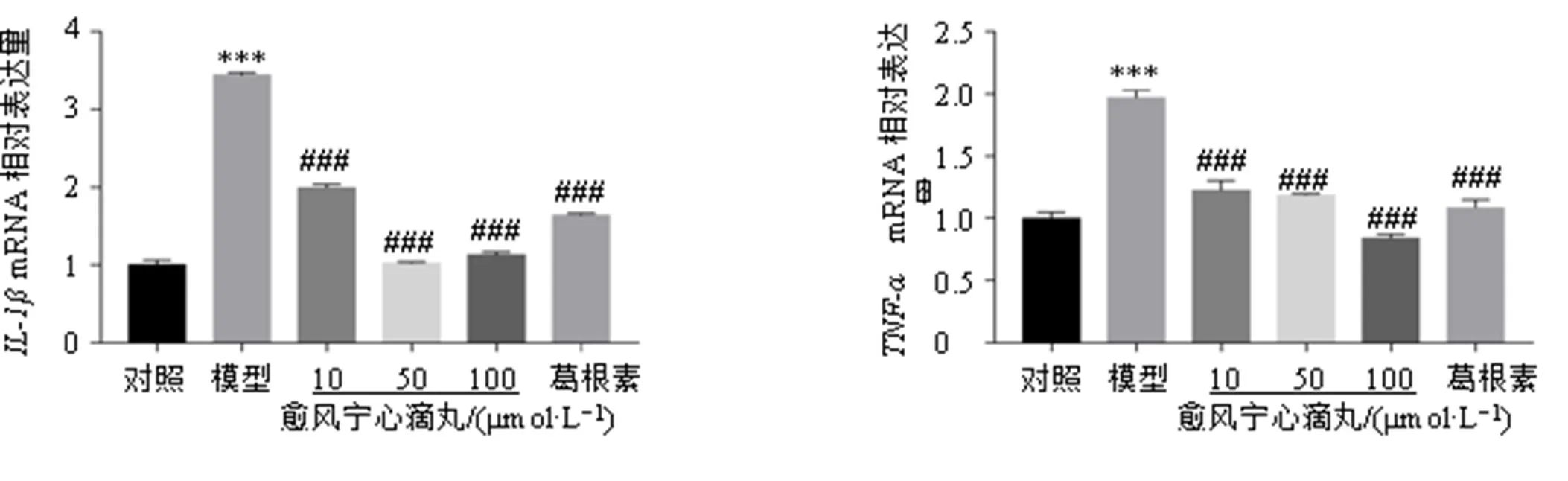
图3 愈风宁心滴丸抑制BV2细胞IL-1β和TNF-αmRNA表达(, n = 3)
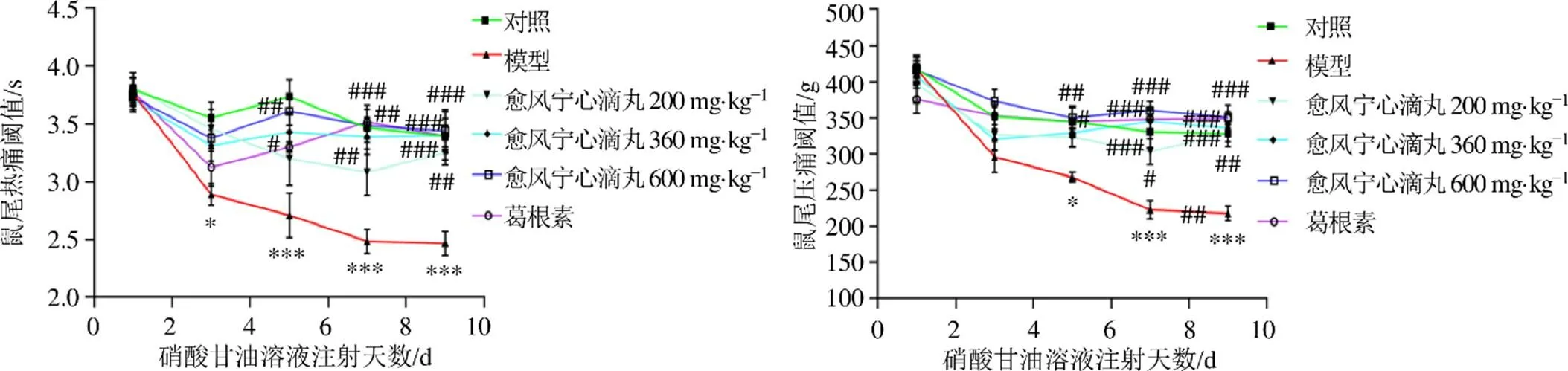
图4 愈风宁心滴丸改善偏头痛小鼠的热痛阈值(A) 及压痛阈值(B)(, n = 6)
3.3 愈风宁心滴丸通过降低偏头痛小鼠TNC区CGRP、c-Fos、p-ERK蛋白表达改善中枢敏化
血管舒张肽CGRP是神经源性炎症发生的主要因素之一,与c-Fos及p-ERK蛋白一样,被认为是中枢敏化的分子标记物。如图5所示,与对照组比较,模型组TNC区中CGRP、c-Fos、p-ERK蛋白表达水平显著升高(<0.01、0.001);与模型组相比,各给药组TNC区中CGRP、c-Fos、p-ERK蛋白表达水平显著降低(<0.05、0.01、0.001)。
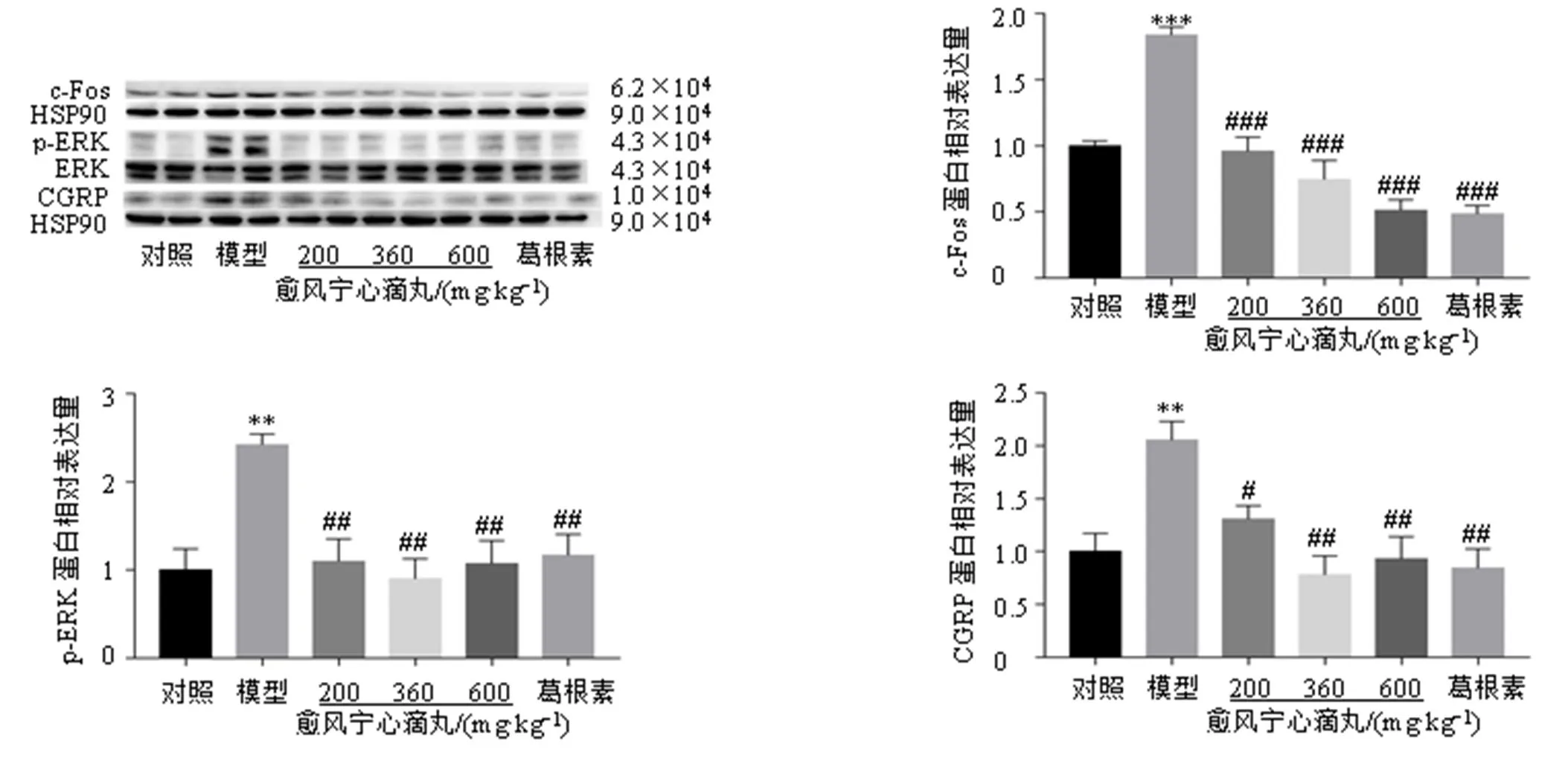
图5 愈风宁心滴丸抑制偏头痛小鼠TNC区CGRP、c-Fos和p-ERK蛋白表达 (, n = 6)
如图6所示,与对照组相比,模型组TNC区中CGRP、c-Fos免疫反应的细胞数量增加,给予愈风宁心滴丸及葛根素干预后,CGRP、c-Fos阳性细胞数量减少。以上结果表明,愈风宁心滴丸可能通过降低偏头痛小鼠TNC区CGRP、c-Fos、p-ERK蛋白表达改善小鼠中枢敏化,降低偏头痛模型小鼠的痛觉敏感。
3.4 愈风宁心滴丸降低偏头痛小鼠TNC区炎症因子的表达
如图7、8所示,与对照组比较,模型组小鼠TNC区、mRNA和IL-6蛋白表达水平显著升高(<0.01);与模型组比较,各给药组小鼠TNC区、mRNA和IL-6蛋白表达水平显著降低(<0.05、0.01、0.001)。表明愈风宁心滴丸可能通过降低偏头痛小鼠TNC区炎症因子的表达改善偏头痛。
3.5 愈风宁心滴丸对偏头痛小鼠血清中AST、ALT和ALP活性的影响
如图9所示,各组小鼠血清AST、ALT、APL活性均无显著差异,且均处于正常水平,表明愈风宁心滴丸不会对小鼠造成肝毒性,提示其使用具有安全性。

图6 愈风宁心滴丸抑制偏头痛小鼠TNC区CGRP和c-Fos蛋白表达(, n = 6)
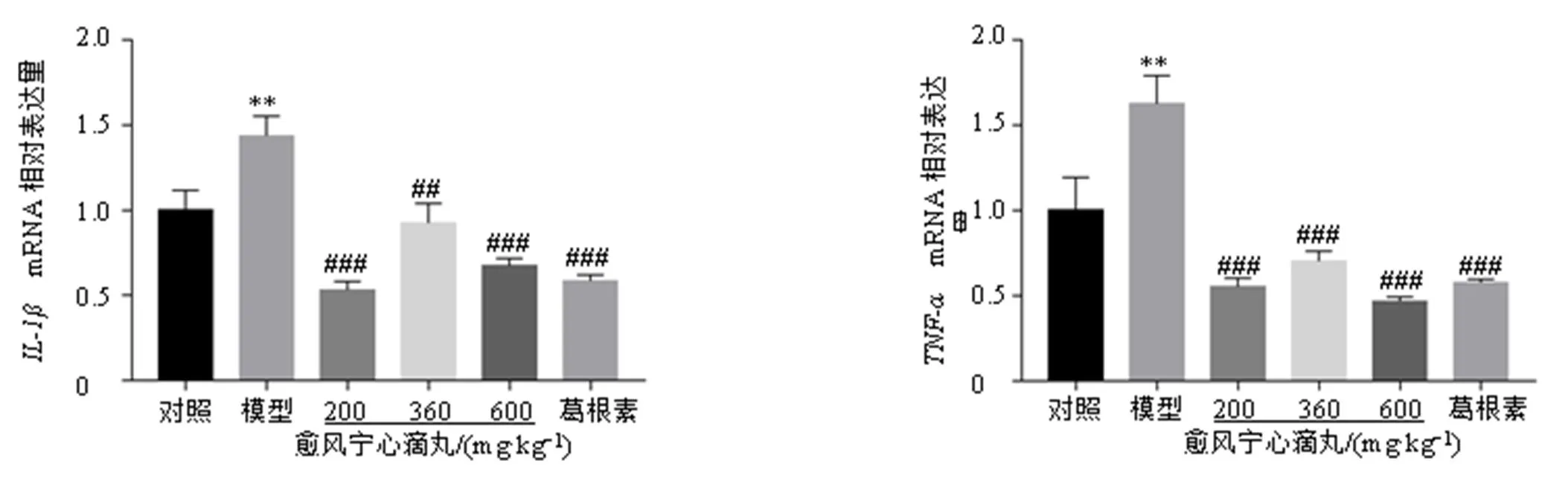
图7 愈风宁心滴丸抑制偏头痛小鼠TNC区IL-1β和TNF-αmRNA的表达(, n = 6)
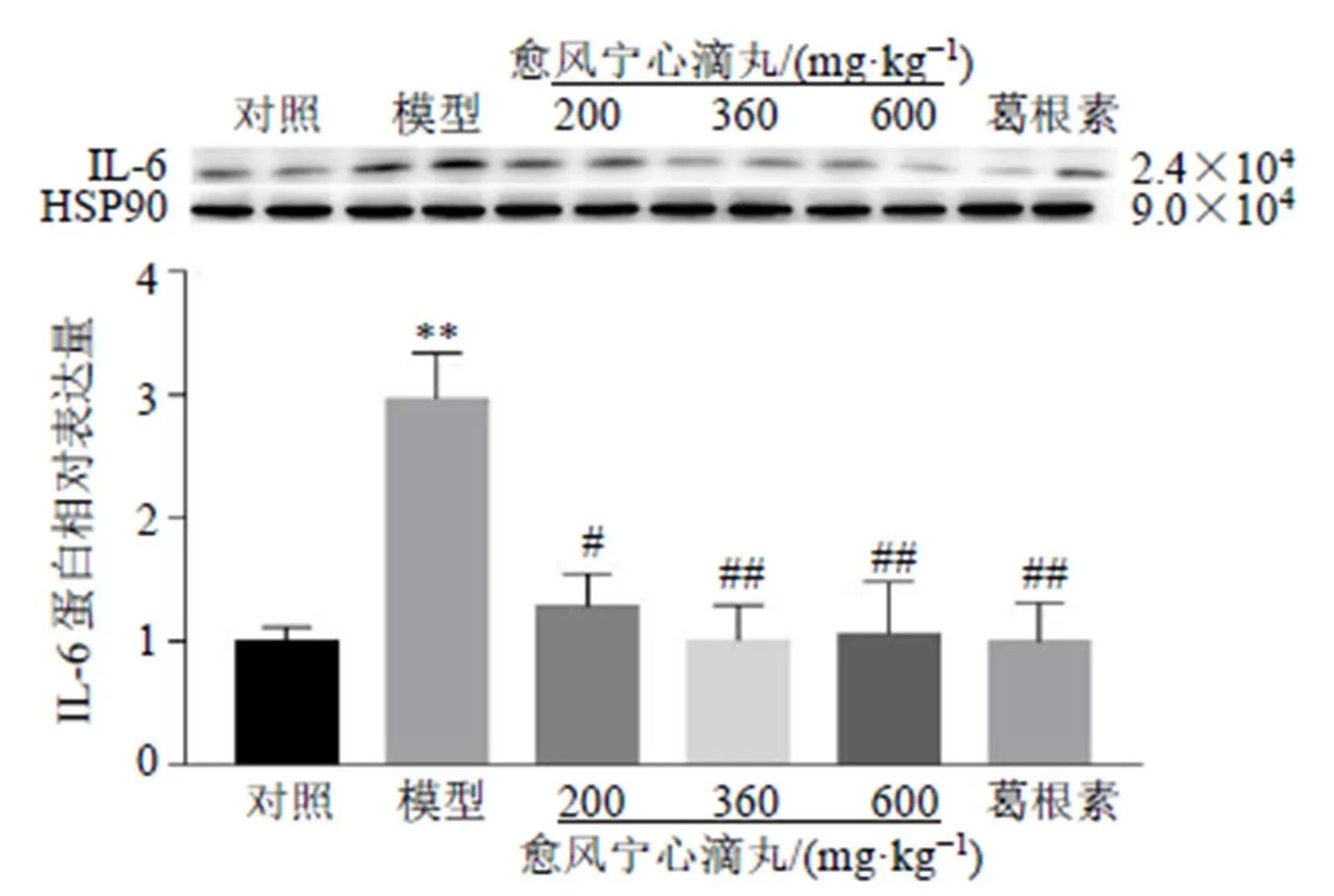
图8 愈风宁心滴丸抑制偏头痛小鼠TNC区IL-6蛋白表达(, n = 6)
4 讨论
偏头痛作为临床常见的原发性疾病,表现出反复发作、搏动样头痛,并可伴有恶心、呕吐、畏光、畏声等症状[12]。因其发作原因复杂多样且发病机制不明确,大多数偏头痛患者都不满于现有接受的治疗方案[13]。在对偏头痛发病机制的研究过程中,产生了神经源、血管源以及三叉神经血管反射等多种学说[14]。研究表明,脑部TNC区异常神经元信号调控引起中枢敏化,反复的中枢敏化促使偏头痛向慢性偏头痛的转换[6]。CGRP作为强大的血管舒张肽,主要表达于三叉神经的无髓神经纤维,当三叉神经兴奋时会释放大量的CGRP,促使硬脑膜血管扩张,进而引起神经源性炎症的发生,导致偏头痛的产生[14]。原癌基因的激活和ERK的磷酸化已被用作神经元激活和中枢敏化的可靠分子标志物[15]。研究发现,小胶质细胞-神经元细胞信号交互通路参与了偏头痛的病理生理机制,促炎因子IL-1β也参与偏头痛病理过程,提示小胶质细胞可通过其释放的促炎细胞因子影响中枢神经系统神经元的兴奋,参与偏头痛的发生与维持[16-17]。
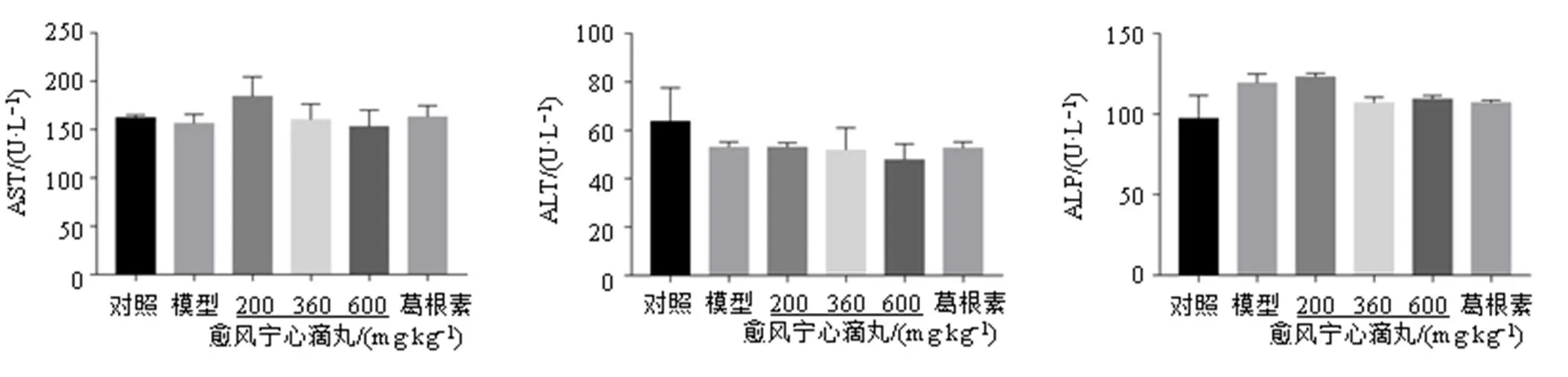
图9 愈风宁心滴丸对偏头痛小鼠血清中AST、ALT和ALP活性的影响(, n = 6)
愈风宁心滴丸是由结合中医传统理论和现代医学新技术由葛根提取加工而成的中药滴丸,临床上治疗心绞痛、冠心病等心血管疾病效果显著。其主要成分葛根素具有解痉升阳、增强脑及冠脉血流量、祛除患者头痛之功效[18]。葛根素可能通过抑制瞬时受体电位香草酸亚型1(transient receptor potential vanilloid type 1,TRPV1)、CGRP和P物质预防紫杉醇诱导的大鼠周围神经病理性疼痛[19]。以上研究为愈风宁心滴丸防治偏头痛提供了一定的科学依据。本研究考察了愈风宁心滴丸对LPS诱导的BV2细胞炎症及氧化应激状态的影响,发现愈风宁心滴丸及葛根素能够上调BV2细胞抗氧化酶、的mRNA及蛋白表达水平,抑制LPS引起的ROS水平异常升高,改善细胞中的高氧化压力状态,同时通过下调IL-1β、TNF-α等炎症因子的表达抑制炎症反应,提示愈风宁心滴丸具有改善偏头痛的潜力。
一氧化氮是偏头痛病理生理过程中的重要神经递质[20]。研究证明,硝酸甘油作为一氧化氮供体给药会导致健康受试者头痛,而偏头痛患者则会出现更严重的迟发性头痛[21]。本研究通过对小鼠进行反复ip硝酸甘油溶液诱导慢性偏头痛的产生,模拟临床慢性偏头痛症状,结果显示,模型组小鼠的痛阈值显著降低,表现出明显的痛觉敏感。与对照组比较,模型组小鼠脑部TNC区促炎因子IL-1β、TNF-α、IL-6以及疼痛相关蛋白CGRP、c-Fos、p-ERK的表达明显升高;与模型组比较,各给药组小鼠基础痛阈值明显升高,表现出对痛觉敏感的显著抑制;各给药组小鼠TNC区促炎细胞因子IL-1β、TNF-α、IL-6以及疼痛相关蛋白CGRP、c-Fos、p-ERK的表达显著降低,呈剂量相关性。
综上所述,愈风宁心滴丸可以降低偏头痛小鼠脑部TNC区疼痛相关蛋白CGRP、c-Fos、p-ERK以及促炎细胞因子IL-1β、TNF-α、IL-6的表达,进而降低痛觉敏感,缓解偏头痛。其机制可能为通过抑制血管扩张及炎症反应,进而起到防治血管痉挛性偏头痛的作用。本研究为愈风宁心滴丸防治偏头痛的研究提供了理论及实验基础,为中药在偏头痛的应用提供了重要依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Skyhøj Olsen T.Migraine with and without aura: The same disease due to cerebral vasospasm of different intensity.A hypothesis based on CBF studies during migraine [J]., 1990, 30(5): 269-272.
[2] 张宇叶, 赖小燕, 吴双, 等.针刺治疗偏头痛的血管源学说机制研究进展 [J].医学研究生学报, 2016, 29(3): 305-308.
[3] 董晗, 谷峰.头部刺血疗法联合麦角胺咖啡因治疗偏头痛随机平行对照研究 [J].实用中医内科杂志, 2013, 27(3): 130-132.
[4] 李永华.通窍活血汤治疗血瘀型血管痉挛性偏头痛 [J].中国社区医师, 2005, 21(16): 34.
[5] Tfelt-Hansen P, Olesen J.Taking the negative view of current migraine treatments: The unmet needs [J]., 2012, 26(5): 375-382.
[6] He W, Long T, Pan Q,.Microglial NLRP3 inflammasome activation mediates IL-1β release and contributes to central sensitization in a recurrent nitroglycerin-induced migraine model [J]., 2019, 16(1): 78.
[7] 郭永涛, 黄琳, 武茜, 等.小胶质细胞在偏头痛大鼠中枢敏化过程中的作用 [J].中华老年心脑血管病杂志, 2013, 15(4): 419-422.
[8] Long T, He W, Pan Q,.Microglia P2X4 receptor contributes to central sensitization following recurrent nitroglycerin stimulation [J]., 2018, 15(1): 245.
[9] 李智颖, 范红艳.葛根素药理作用的研究进展 [J].吉林医药学院学报, 2020, 41(5): 375-377.
[10] Xie H, Chen Y, Du K,.Puerarin alleviates vincristine- induced neuropathic pain and neuroinflammation via inhibition of nuclear factor-κB and activation of the TGF-β/Smad pathway in rats [J]., 2020, 89(Pt B): 107060.
[11] Zheng G M, Yu C, Yang Z.Puerarin suppresses production of nitric oxide and inducible nitric oxide synthase in lipopolysaccharide-induced N9 microglial cells through regulating MAPK phosphorylation,-GlcNAcylation and NF-κB translocation [J]., 2012, 40(5): 1610-1618.
[12] Pradhan A A, Smith M L, McGuire B,.Characterization of a novel model of chronic migraine [J]., 2014, 155(2): 269-274.
[13] 杨建梅, 邓海燕, 李坤, 等.复方藜芍片通过阻断JAK2/STAT3通路抑制皮层神经炎症改善硝酸甘油致大鼠慢性偏头痛 [J].世界科学技术—中医药现代化, 2018, 20(12): 2224-2230.
[14] Pradhan A A, Smith M L, McGuire B,.Characterization of a novel model of chronic migraine [J]., 2014, 155(2): 269-274.
[15] 王文慧, 沈燕.针刺预防性治疗偏头痛的机制研究进展 [J].中华中医药杂志, 2019, 34(1): 229-232.
[16] Bernstein C, Burstein R.Sensitization of the trigeminovascular pathway: Perspective and implications to migraine pathophysiology [J]., 2012, 8(2): 89-99.
[17] Gong Q, Lin Y, Lu Z,.Microglia-astrocyte cross talk through IL-18/IL-18R signaling modulates migraine-like behavior in experimental models of migraine [J]., 2020, 451: 207-215.
[18] Jing F, Zhang Y X, Long T,.P2Y12 receptor mediates microglial activation via RhoA/ROCK pathway in the trigeminal nucleus caudalis in a mouse model of chronic migraine [J]., 2019, 16(1): 217.
[19] 刘秀华, 刘华, 李秀英.葛根素的临床应用现状 [J].现代中西医结合杂志, 2008, 17(18): 2908-2909.
[20] Liu M, Liao K J, Yu C X,.Puerarin alleviates neuropathic pain by inhibiting neuroinflammation in spinal cord [J]., 2014, 2014: 485927.
[21] Pradhan A A, Bertels Z, Akerman S.Targeted nitric oxide synthase inhibitors for migraine [J]., 2018, 15(2): 391-401.
[22] 赵永烈, 王玉来, 高颖, 等.一氧化氮在偏头痛发病中的作用 [J].中国临床康复, 2006, 10(7): 138-139.
Effect and mechanism of Yufeng Ningxin Dropping Pills on preventive treatment of vasospasm migraine
JIANG Xiao-meng1, YANG Dai-gang2, GAO Yong-yao2, ZOU Ting-feng2, SHI Cun-yuan1, JIANG Hong1, DUAN Ya-jun2, YANG Xiao-xiao2
1.Zhejiang Jianfeng Pharmaceutical Co., Ltd., Jinhua 321000, China 2.Hefei University of Technology, Hefei 230001, China
To observe the effect of Yufeng Ningxin Dropping Pills (愈风宁心滴丸) on nitroglycerin-induced migraine mice, and explore the effect and mechanism of Yufeng Ningxin Dropping Pills on preventive treatment of vasospasm migraine.Lipopolysaccharide (LPS) was used to stimulate BV2 neuroglial cells, Yufeng Ningxin Dripping Pills (10, 50, 100 μmol/L) and puerarin (50 μmol/L) were used for intervention, and cells were collected.Wild-type C57BL/6J mice were randomly divided into control group, model group, low-, medium-, and high-dose (200, 360, 600 mg/kg) Yufeng Ningxin Dripping Pill group and puerarin (37.8 mg/kg) group, drugs were given for intervention, migraine model of mice was established with ip nitroglycerin solution (10 mg/kg) on 3rd, 5th, 7th, 9th and 11th day, hyperalgesia tolerance behavioral experiment (mechanical tenderness and heat sensitivity) were started on 3rd day; After experiment, the serum and brain tissue of mice were taken.The content of reactive oxygen species in BV2 cells of each group was detected; Western blotting was used to detect the expressions of superoxide dismutase 1 (SOD1) and SOD2 protein in BV2 cells and calcitonin gene-related peptide (CGRP), c-Fos, phosphorylated extracellular regulated protein kinases (p-ERK) and pro-inflammatory cytokine interleukin-6 (IL-6) protein expressions in trigeminal nucleus caudalis (TNC) region in mice of each group; qRT-PCR method was used to detect,,, tumor necrosis factor-α () mRNA expressions in BV2 cells andandmRNA expressions in TNC of mice; Immunofluorescence was used to detect the expressions of CGRP and c-Fos in TNC area of mice in each group; Automatic biochemical analyzer was used to detect the alanine aminotransferase (ALT), aspartate aminotransferase (AST) and alkaline phosphatase (ALP) activities in serum of mice.Yufeng Ningxin Dripping Pills significantly increased antioxidant enzymeandmRNA and protein expression levels in BV2 cells (< 0.05, 0.01, 0.001), reduced reactive oxygen species levels (< 0.01, 0.001), inhibited the inflammatory factorandmRNA expression (< 0.001).Compared with control group, basic pain threshold of mice in model group was significantly reduced (< 0.05, 0.001), expressions of CGRP, c-Fos and p-ERK proteins in TNC area were significantly increased (< 0.01, 0.001).The expressions of,mRNA and IL-6 protein in TNC area were significantly increased (< 0.01); Compared with model group, basic pain threshold of mice in each administration group were significantly increased (< 0.05, 0.01, 0.001), expressions of CGRP, c-Fos and p-ERK proteins in TNC area were significantly reduced (< 0.05, 0.01, 0.001), expressions of,mRNA and IL-6 proteins in TNC area were significantly reduced (< 0.05, 0.01, 0.001), and showed a dose-related relationship; Yufeng Ningxin Dripping Pills had no significant effect on activities of ALT, AST and ALP in serum of migraine mice.Yufeng Ningxin Dripping Pills may play a preventive effect on vasospasm migraine by inhibiting vasodilation, inhibiting inflammation and promoting the expression of antioxidant enzymes.
Yufeng Ningxin Dropping Pills; migraine; microglia; vasodilation; neuroinflammation
R285.5
A
0253 - 2670(2021)22 - 6881 - 09
10.7501/j.issn.0253-2670.2021.22.013
2021-05-20
安徽省重点研究和开发计划项目(201904a07020007);中国博士后科学基金资助项目(2020M681914)
蒋晓萌(1964—),男,硕士,浙江省有突出贡献中青年专家,主要从事新药研发。Tel: 17855867735 E-mail: Jxm@vip.163.com
通信作者:杨潇潇(1990—),女,副教授,硕士生导师,从事重大疾病(心脑血管疾病、肿瘤等)药理学研究。Tel: 13920087912 E-mail: yangxiaoxiao@hfut.edu.cn
[责任编辑 李亚楠]
