RGD环肽修饰的姜黄素/黄芩苷靶向共递送纳米脂质体的制备工艺优化及表征
2021-11-21吴斯宇曾盈蓉胡立志
吴斯宇,曾盈蓉,唐 聘,桂 卉*,胡立志
RGD环肽修饰的姜黄素/黄芩苷靶向共递送纳米脂质体的制备工艺优化及表征
吴斯宇1,曾盈蓉1,唐 聘1,桂 卉1*,胡立志2*
1.湖南中医药大学药学院湖南省中药现代化研究重点实验室,湖南 长沙 410208 2.湖南中医药大学第二附属医院,湖南 长沙 410005
优化RGD环肽修饰的姜黄素(curcumin,Cur)/黄芩苷(baicalin,Bai)共递送靶向纳米脂质体(RGD-Cur/Bai-Lip)的制备工艺并进行表征评价。采用乙醇注入法制备RGD-Cur/Bai-Lip,首先通过Plackett-Burman筛选实验确定超声时间、胆脂比、水合温度作为制备RGD-Cur/Bai-Lip的关键因素,然后采用Box-Behnken响应面法进行工艺优化,以姜黄素包封率、黄芩苷包封率、总载药量为考察指标,采用AHP-复相关系数法-拉开档次法进行多指标组合赋权以确定各指标权重系数并计算综合评分,从而确定RGD-Cur/Bai-Lip的最优处方及关键工艺参数。最后对其形态、粒径电位、稳定性、体外释放度及溶血性等进行表征评价。优选得到的最佳工艺为胆脂比1∶12,水合温度60 ℃,探头超声时间为10 min。RGD-Cur/Bai-Lip外观澄清透明,呈亮黄色,对光可视淡蓝色乳光,透射电子显微镜下观察形态圆整、分散均匀。平均粒径为(101.10±0.62)nm,多分散系数(PDI)为0.191 0±0.014 3,Zeta电位为(1.59±0.07)mV,姜黄素包封率为(94.28±4.51)%,黄芩苷包封率为(76.93±1.35)%,总载药量为(2.27±0.09)%。7 d内稳定性良好,无溶血性,并具有一定的缓释作用。优化处方后制备的RGD-Cur/Bai-Lip包封率高,粒径分布均匀,7 d内较稳定,无溶血性,并具有一定的缓释作用,为RGD-Cur/Bai-Lip的后续抗肝纤维化体内外研究提供了制剂基础。
脂质体;姜黄素;黄芩苷;RGD环肽;Plackett-Burman设计;Box-Behnken响应面法;AHP-复相关系数法-拉开档次法
近年来,肝纤维化的发病率逐年增高,引起了全社会的广泛关注和重视。肝纤维化是由于肝脏在病毒、自身免疫性疾病、药物等诸多因素的作用下,肝星状细胞(hepatic stellate cell,HSC)被激活,大量细胞外基质(extracellular matrix,ECM)在肝脏中过度堆积形成瘢痕组织而形成[1-2]。已有研究表明[3-4],姜黄素(curcumin,Cur)与黄芩苷(baicalin,Bai)可以通过不同途径和通路抑制肝纤维化,发挥协同作用,增强临床疗效。其中姜黄素通过抑制HSC中的Hedgehog(Hh)信号传导调节细胞代谢和衰老,促进HSC凋亡而逆转肝纤维化进程;黄芩苷通过抑制肝细胞膜的脂质过氧化,降低α-SMA的表达,抑制肝细胞氧化应激和HSC的活化,从而抑制肝纤维化。
姜黄素与黄芩苷虽具确切治疗肝纤维化的疗效,但制成普通制剂时存在口服吸收差、稳定性不高和低靶向性等缺点,限制了药效的充分发挥。脂质体(liposomes,Lip)系指将药物包封于类脂质双分子层内而形成的超微球形载体制剂,具有改善药物溶解性,提高药物稳定性、增强体内靶向性等优点[5]。此外,已有研究表明[6-7]HSC的激活和增生是肝纤维化发生的中心环节,各种致纤维化因素共同通过这一决定性途径启动肝纤维化的过程。RGD环肽[8]具有与HSC表面整合素结合的能力,是整合素与ECM结合识别最常见的位点,能够特异性地与HSC表面的整合素结合,抑制细胞与细胞、细胞与间质之间的黏附,阻止细胞的增殖、分化,从而逆转肝纤维化进程。因此本实验构建主动靶向于HSC的RGD环肽修饰的姜黄素/黄芩苷共递送靶向纳米脂质体(RGD-Cur/Bai-Lip)载药系统,采用AHP-复相关系数法-拉开档次法多指标综合评分以确定权重系数,通过Plackett-Burman筛选实验设计结合Box-Behnken响应面实验以确定RGD-Cur/Bai-Lip的最优工艺参数,并进一步进行表征评价,为RGD-Cur/Bai-Lip的后续抗肝纤维化体内外研究奠定制剂基础。
1 仪器与试药
1.1 仪器设备
Agilent Technologies 1200 Series高效液相色谱仪,Agilent ChemStation色谱工作站,美国安捷伦公司;Precisa XB 220A型分析天平,瑞士Precisa重量分析股份公司;01A418型超声细胞粉碎机、SCIENTZ-10N型冷冻干燥机、Zetasizer Nano-ZS90激光粒度分析仪,英国马尔文仪器有限公司;ZNCL-G型智能磁力搅拌器,巩义市予华仪器有限责任公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;SPX-250B型恒温培养箱,上海博泰实验设备有限公司;H3-20KR型台式高速冷冻离心机,湖南可成仪器设备有限公司。
1.2 材料与试剂
姜黄素原料药(批号R30A11S112330,BR,98%)、黄芩苷原料药(批号G07S11L123706,BR,90%)、姜黄素对照品(批号R08S8S43416,HPLC质量分数≥98%)、黄芩苷对照品(批号P16S8F44143,HPLC质量分数≥98%)、大豆卵磷脂(批号T7011F127302)均购于上海源叶生物有限公司;DSPE-PEG2K-cRGD(批号RMO211108),西安瑞禧生物有限公司;胆固醇(批号20181128),国药集团化学试剂有限公司;D36 mm透析袋(截留相对分子质量8000~14 000),北京鼎国昌盛生物技术有限公司;无菌脱纤维兔血(批号210624),广州鸿泉生物科技有限公司;乙腈、甲醇、磷酸、冰醋酸均为色谱纯;其余试剂均为分析纯。
2 方法与结果
2.1 RGD-Cur/Bai-Lip制备方法
采用乙醇注入法制备RGD-Cur/Bai-Lip。黄芩苷、RGD环肽溶于pH 6.4的磷酸盐缓冲液(PBS)中作为水相,大豆卵磷脂、胆固醇、姜黄素溶于无水乙醇中作为油相,将油相匀速滴入水相中,并置于恒温60 ℃水浴中水化1 h,减压旋蒸除去乙醇,用PBS定容至20 mL,探头超声10 min,分别过0.80、0.45、0.22 μm微孔滤膜,即得。
2.2 含量测定方法
2.2.1 色谱条件
(1)姜黄素:Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 µm);流动相为2%冰乙酸-乙腈溶液(45∶55);进样量为10 µL;体积流量为1.0 mL/min;柱温为25 ℃;检测波长为430 nm。
(2)黄芩苷:Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 µm);流动相为甲醇-0.4%磷酸溶液(47∶53);进样量10 μL;体积流量1.0 mL/min;柱温30 ℃;检测波长280 nm。
2.2.2 对照品溶液的制备
(1)姜黄素对照品溶液:精密称取称取姜黄素对照品2.12 mg,置于10 mL棕色量瓶中,以色谱甲醇溶解并定容至刻度线,得到质量浓度为0.212 mg/mL的姜黄素对照品母液,4 ℃冰箱避光密封储存,待用。
(2)黄芩苷对照品溶液:精密称取黄芩苷对照品1.17 mg,置10 mL棕色量瓶中,加色谱甲醇适量使全部溶解并定容至刻度线,摇匀,得质量浓度为0.117 mg/mL的对照品母液,4 ℃冰箱避光密封储存,待用。
2.2.3 供试品溶液的制备 量取RGD-Cur/Bai-Lip溶液2 mL,置于10 mL棕色量瓶中,加入适量甲醇与乙腈1∶1的混合溶剂破乳,混合溶剂定容至10 mL,超声1 h,静置24 h,过0.22 μm有机微孔滤膜,4 ℃冰箱避光密封储存,待用。
2.2.4 空白脂质体供试品溶液的制备 精密量取空白脂质体溶液2 mL,置于10 mL棕色量瓶中,按“2.2.3”项下相同方法处理空白脂质体样品。
2.2.5 专属性试验 分别取“2.2.2”~“2.2.4”项下姜黄素对照品溶液、黄芩苷对照品溶液、RGD-Cur/Bai-Lip供试品溶液、空白脂质体供试品溶液,按照“2.2.1”项下色谱条件各进样10 µL,结果见图1、2,空白脂质体供试品溶液色谱图未出现对照品对应峰,表明阴性无干扰。
2.2.6 线性关系考察
(1)姜黄素:精密吸取上述“2.2.2”项下姜黄素对照品母液0.25、0.50、0.75、1.00、1.25、1.75 mL分别置于10 mL量瓶中,用甲醇定容,摇匀,得到质量浓度分别为0.010、0.015、0.020、0.025、0.030、0.035 mg/mL系列对照品溶液。分别精密吸取各对照品溶液10 µL,按“2.2.1”项下姜黄素色谱条件进样测定,以进样质量浓度为横坐标(),相应的峰面积为纵坐标(),绘制标准曲线,得到回归方程=485.66+446.31,2=0.999 1,结果表明姜黄素在0.010~0.035 mg/mL呈良好线性关系。
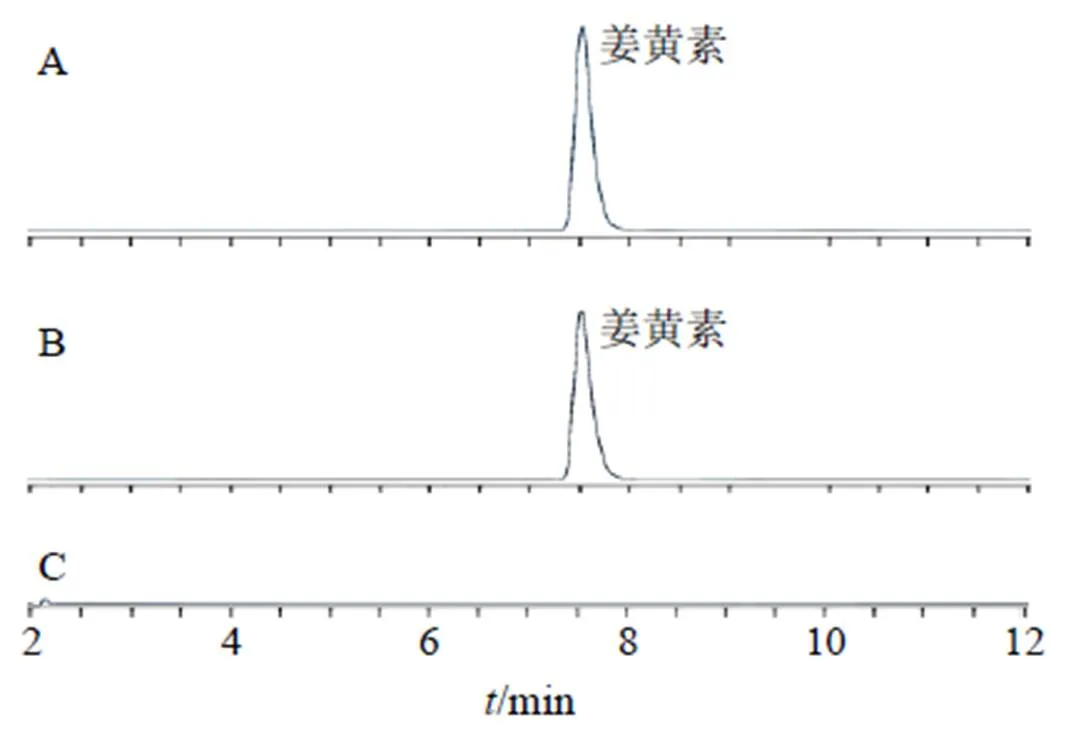
图1 姜黄素对照品(A)、RGD-Cur/Bai-Lip样品(B)及空白脂质体(C)HPLC图
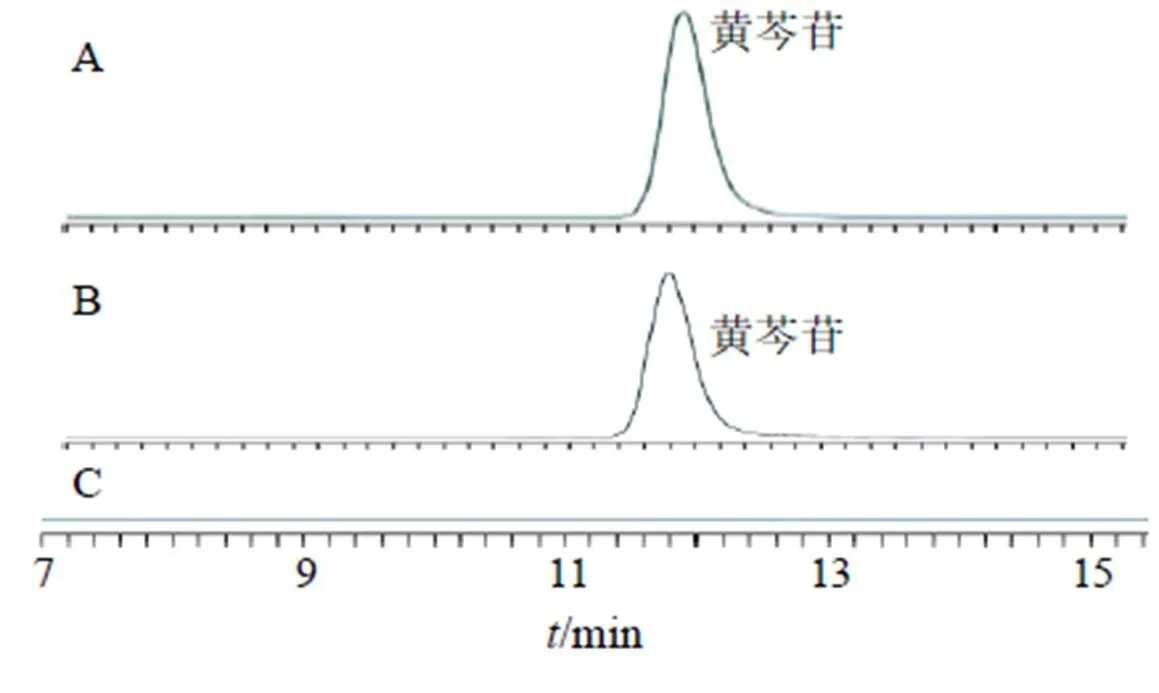
图2 黄芩苷对照品(A)、RGD-Cur/Bai-Lip样品(B)及空白脂质体(C)HPLC图
(2)黄芩苷:精密吸取上述“2.2.2”项下黄芩苷对照品母液0.01、0.25、0.50、0.75、1.00、1.25 mL分别置于10 mL量瓶中,用甲醇定容,摇匀,得到质量浓度分别为0.001、0.050、0.100、0.150、0.200、0.250 mg/mL系列对照品溶液。分别精密吸取各对照品溶液10 µL,按“2.2.1”项下黄芩苷色谱条件进样测定,以进样质量浓度为横坐标(),相应的峰面积为纵坐标(),绘制标准曲线,得到回归方程=37 410-54.361,2=0.999 7,结果表明姜黄素在0.001~0.250 mg/mL呈良好线性关系。
2.2.7 精密度考察 精密吸取按“2.2.2”项下方法制备的姜黄素对照品溶液和黄芩苷对照品溶液,在“2.2.1”项色谱条件下分别连续进样6次,每次进样10 μL,其中姜黄素峰面积的RSD为1.02%,黄芩苷峰面积的RSD为0.12%,表明仪器精密度良好。
2.2.8 重复性试验 制备6份RGD-Cur/Bai-Lip供试品溶液,按“2.2.1”项下色谱条件分别进样,结果姜黄素质量分数的RSD为0.32%,黄芩苷质量分数的RSD为0.18%,表明方法重复性良好。
2.2.9 稳定性试验 取RGD-Cur/Bai-Lip溶液分别于制备后0、3、6、9、12、24 h按“2.2.1”项下色谱条件分别进样测定,结果姜黄素峰面积的RSD为2.58%,黄芩苷峰面积的RSD为2.70%,表明RGD-Cur/Bai-Lip供试品溶液在24 h内稳定。
2.2.10 加样回收率试验 制备RGD-Cur/Bai-Lip供试品溶液9份,每份2 mL,分别精密加入低、中、高质量浓度的姜黄素对照品溶液和黄芩苷对照品溶液,按“2.2.1”项下色谱条件分别进样分析。结果显示,姜黄素低、中、高质量浓度的平均加样回收率分别为97.89%、97.75%、99.48%,RSD分别为0.83%、0.31%、1.11%;黄芩苷低、中、高质量浓度的平均加样回收率分别为96.49%、96.48%、96.99%,RSD分别为1.04%、0.68%、0.58%,说明本方法回收率良好。
2.3 包封率和载药量的测定
2.3.1 姜黄素包封率的测定 滤膜法[9]是根据脂溶性药物水溶性差,在水中易形成微粒沉淀的特性,将脂溶性药物脂质体挤压通过水系滤膜,而游离药物被截留在膜上,从而达到游离药物和脂质体分离的目的。姜黄素属于强脂溶性药物,在PBS中会形成较大的聚合物而无法通过水系滤膜,因此选择滤膜法测定姜黄素包封率。
(1)滤膜法分离效果的考察:按“2.1”项下方法制备2 mg/mL的姜黄素原料药混悬液,经探头超声处理后定容至20 mL量瓶中,取2 mL样品于10 mL量瓶中,用甲醇-乙腈1∶1混合溶液进行破乳;剩余样品经0.8、0.45、0.22 μm微孔滤膜滤过,然后用甲醇-乙腈1∶1混合溶液进行破乳,并用HPLC分别测定两者的含量。结果显示,过膜前的含量为(945.1±8.8)μg/mL,过膜后的含量仅为(41.2±4.2)μg/mL。上述结果说明姜黄素游离药物基本被滤膜截留,证明了滤膜法能有效分离脂质体和游离药物。
(2)滤膜法测定姜黄素包封率:将制备好的RGD-Cur/Bai-Lip样品依次过0.8、0.45、0.22 μm的水系滤膜,用甲醇-乙腈1∶1混合溶液破乳后得到质量浓度为包,未过膜的脂质体破乳后测得浓度为总。
包封率=包/总
总为药物总量,包为包进药物总量
2.3.2 黄芩苷包封率的测定 经过查阅文献和预实验发现,透析法[10]在测定黄芩苷包封率时具有简单快捷、准确性高等优点,因此本实验最终采取透析法测定黄芩苷包封率。
精密量取RGD-Cur/Bai-Lip样品5 mL,置于透析袋内作为内相,以50 mL 5%甲醇-水作为外相,将内置透析袋的烧杯置于25 ℃磁力搅拌器(300 r/min)计时。分别于15、30、45、60、75、120、150、180 min取透析液30 mL,于旋转蒸发仪上完全旋干,然后加入2 mL甲醇溶解,过膜,进样HPLC测定,以确定黄芩苷的透析平衡时间。由图3可知,随着透析时间的延长,透析介质中黄芩苷游离药物的峰面积呈上升趋势,而在45~60 min,峰面积出现平衡趋势,透析60 min后,峰面积呈大幅上升趋势,说明透析袋内被包封的脂质体开始被破坏,并通过透析袋进入透析介质中。因此最终确定透析平衡时间为60 min,并通过以下公式计算包封率。
包封率=(总-游)/总
总为药物总量,游为游离药物总量

图3 黄芩苷透析平衡图
2.3.3 载药量的测定 精密量取RGD-Cur/Bai-Lip样品2 mL置于已干燥至恒定质量的称量瓶中,冷冻干燥48 h,称定质量,计算供试品冻干粉净质量,将冻干粉加入甲醇-乙腈1∶1混合溶液破乳,并定容至10 mL,按照“2.2.1”项下色谱条件分别测定姜黄素和黄芩苷的含量。按照以下公式计算脂质体载药量。
载药量=总/冻干粉净质量
总为复溶后冻干粉总药量
2.4 多指标组合赋权
2.4.1 层次分析法(AHP)确定权重 AHP法[11]是指将与决策有关的复杂元素层次化和系统化,在此基础之上将定性和定量分析相结合的决策方法。运用层次分析软件YAAHP V12.4.7361,采用1~9标度法对姜黄素包封率(1)、黄芩苷包封率(2)、总载药量(3)这3个权重指标进行两两成对比较,构建指标成对判断优先矩阵,结果见表1。然后根据和积法计算各指标的权重W1,根据公式CR=CI/RI(CR:随机一致性比例因子,CI:一致性指标,RI:平均随机一致性指标),得到CR=0.027 9<0.10,说明指标成对判断优先矩阵具有很好的一致性,权重系数有效,得3个分权重[姜黄素包封率(AHP1)、黄芩苷包封率(AHP2)、总载药量(AHP3)]。
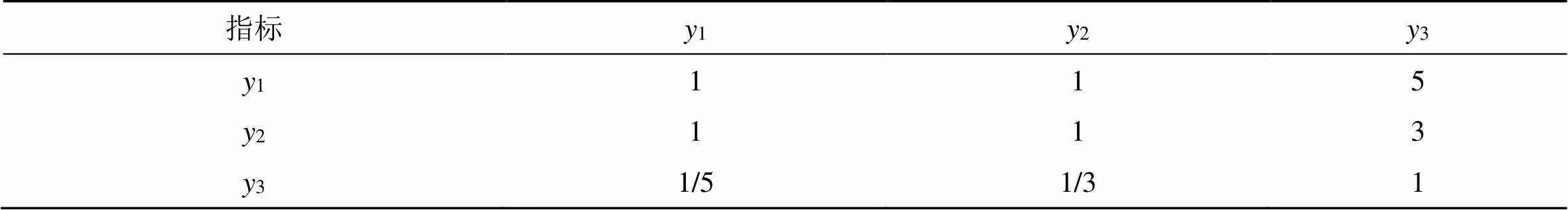
表1 指标成对比较判断优先矩阵
2.4.2 复相关系数法确定权重 复相关系数法[12]属于客观赋权法中的独立权数法,可以依据特征变量间信息的重复性大小赋权。由于选取的特征变量间存在一定的相关性,复相关系数法不仅能避免由于信息重复导致的某方面信息权数过大问题,而且能客观反映特征变量各个方面的情况。应用Eva Gear Version 2.1.7486软件计算RGD-Cur/Bai-Lip制备工艺的3个评价指标的权重系数W2,得3个分权重[姜黄素包封率(复相关系数法1)、黄芩苷包封率(复相关系数法2)、总载药量(复相关系数法3)]。
2.4.3 拉开档次法确定权重 拉开档次法提出的基本原则是在指标赋权的过程中尽可能的突出多个被评价对象之间的整体差异,以拉开各被评价对象的档次,有利于最终结果的排序[13]。应用Eva Gear Version 2.1.7486软件计算RGD-Cur/Bai-Lip制备工艺的3个评价指标的权重系数j3,得3个权重[姜黄素包封率(拉开档次法1)、黄芩苷包封率(拉开档次法2)、总载药量(拉开档次法3)]。
2.4.4 AHP-复相关系数法-拉开档次法组合权重的确定 由AHP得到主观权重AHPj,由复相关系数法、拉开档次法得到客观权重分别为复相关系数法j、拉开档次法j,则组合权重W按照下列公式计算[14]。
W=AHPj复相关系数法拉开档次法/∑(AHPj复相关系数法拉开档次法)
RGD-Cur/Bai-Lip制备工艺的各评价指标的权重值见表2。
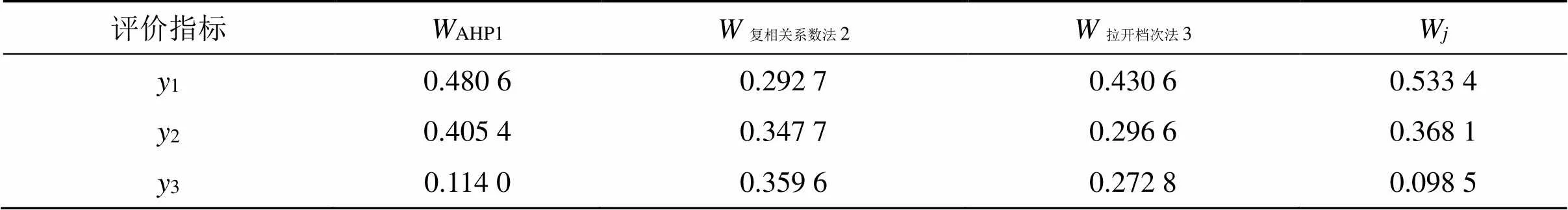
表2 RGD-Cur/Bai-Lip制备工艺评价指标的权重值
2.5 Plackett-Burman设计(PBD)筛选因素
PBD是一种在实验影响因素较多时,可以用较少的实验次数快速准确的找到显著影响因素,减小工作量的实验设计方法[15]。通过文献查阅和预实验结果的综合分析可知,影响RGD-Cur/Bai-Lip包封率和载药量的主要因素主要包括:胆脂比(1)、导脂比(2)、总投药量(3)、油水比(4)、水合温度(5)、超声时间(6)、磷酸盐缓冲液的pH值(7)。
采用Design-Expert.V8.0.6.1软件进行PBD设计,对上述主要影响因素进行考察,每个因素取最低(−1)和最高(+1)2个水平,并以1、2、33个指标的综合评分()为总评价指标,运用层次分析软件YAAHP V12.4.7361和Eva Gear Version 2.1.7486软件对3个分指标进行组合赋权。PBD设计因素与水平见表3,实验结果见表4。
采用Design-Expert.V 8.0.6.1软件进行数据处理和分析,得到其回归模型=85.07+4.301-0.392-1.903-1.154+2.735+5.556+0.967,通过对实验数据进行多元回归分析,结果见表5,回归模型值为0.018 9<0.05,值为10.61,说明差异有统计学意义。=0.948 9,说明模型合理,拟合良好。

表3 PBD因素与水平

表4 PBD实验考察结果
由图4可知,1、5、6具有显著性差异(<0.01),2、3、4、7则无显著性影响(>0.05),显著性排列顺序为6>1>5>3>4>7>2。其中超声时间是最大的影响因素,超声时间太短,达不到降低脂质体粒径和层数的效果,而探头超声时间太长,则可能破坏脂质体结构,使脂质体中的药物泄漏,出现包封率和载药量下降的现象。胆固醇是脂质体中的稳定剂,当胆脂比较小时,会使脂质体的稳定性下降,出现沉淀现象,而包封率和载药量也会随之降低。水合温度也是一个重要影响因素,当水合温度过高时,由于磷脂材料的热不稳定性,会影响脂质体的包封率和载药量,但水合温度过低则又达不到相变温度,难以形成脂质体。
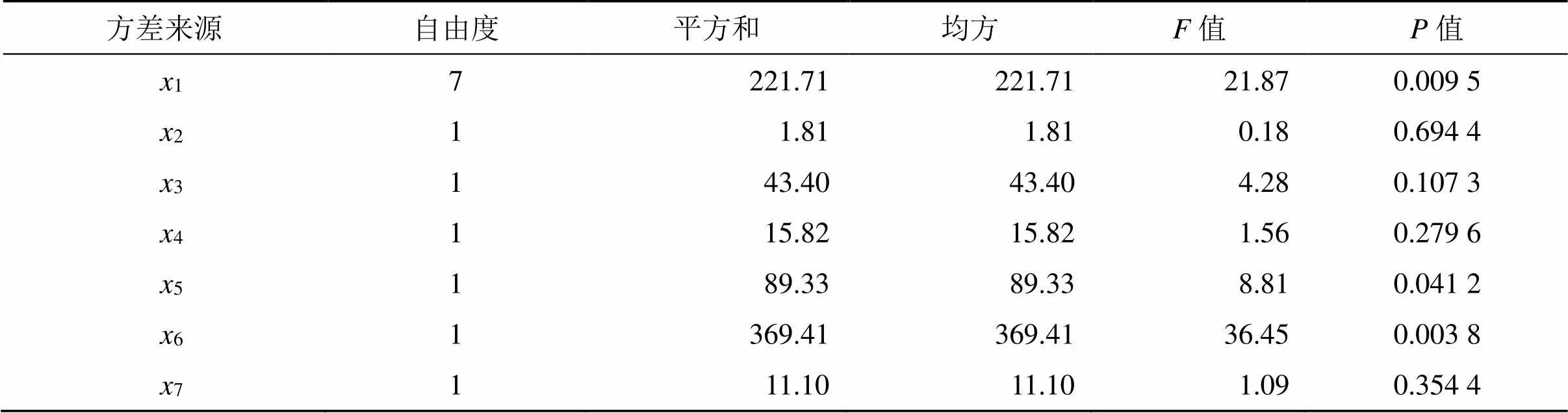
表5 PBD方差分析结果
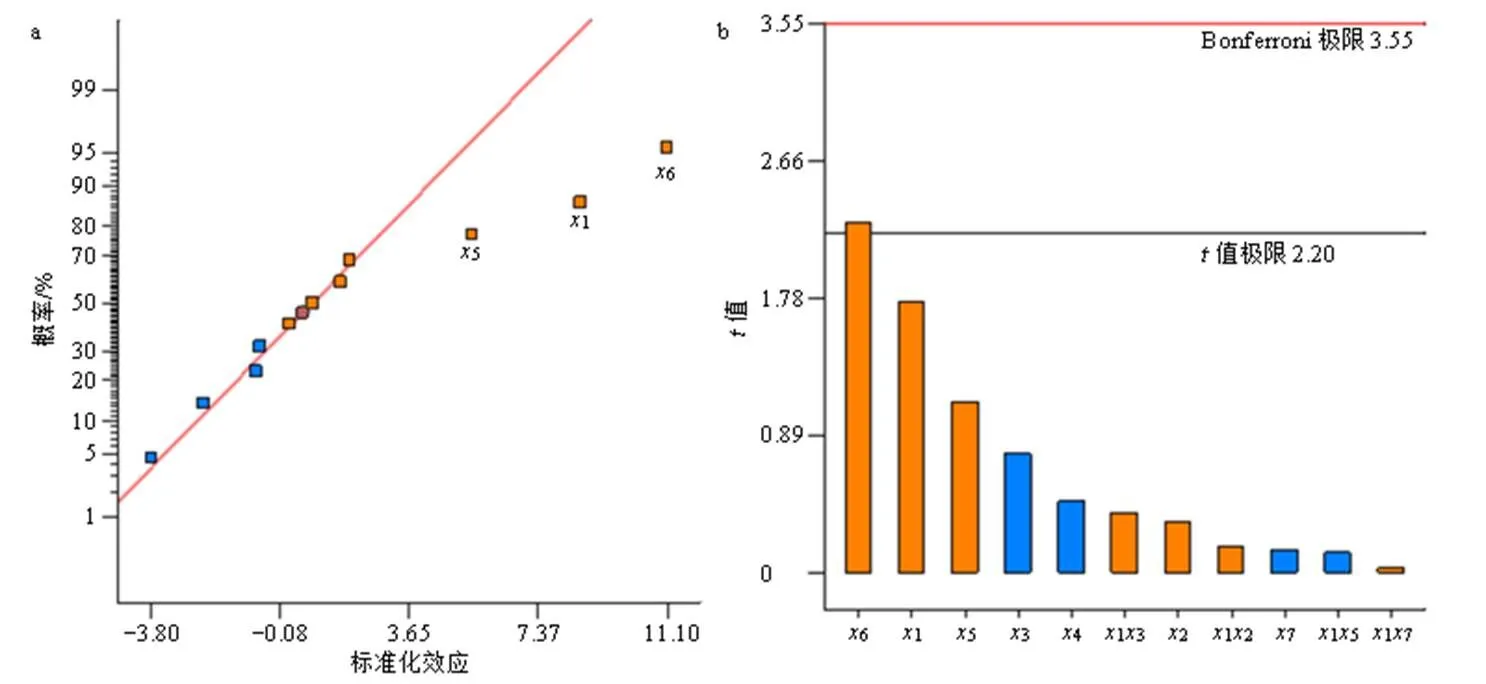
图4 标准化效应的正态图(a)和Pareto图(b)
2.6 Box-Behnken设计优化实验
Box-Behnken响应面设计(BBD)是一种寻找多因素系统中最优条件的数理统计方法,是指通过一定数量的实验次数对各个影响因素及其相互作用进行分析,最终得到直观三维曲面模型以进行实验优化[16-17]。通过PBD实验结果,最终确定超声时间(6)、胆脂比(1)、水浴温度(5)作为Box-Behnken响应面设计的3个主要影响因素,每个因素取低(−1)、中(0)、高水平(+1),实验设计因素与水平见表6,以1、2和3的综合评分为响应值,运用AHP法-复相关系数法-拉开档次法对3个分指标进行组合赋权。实验结果见表7。

表6 BBD因素与水平
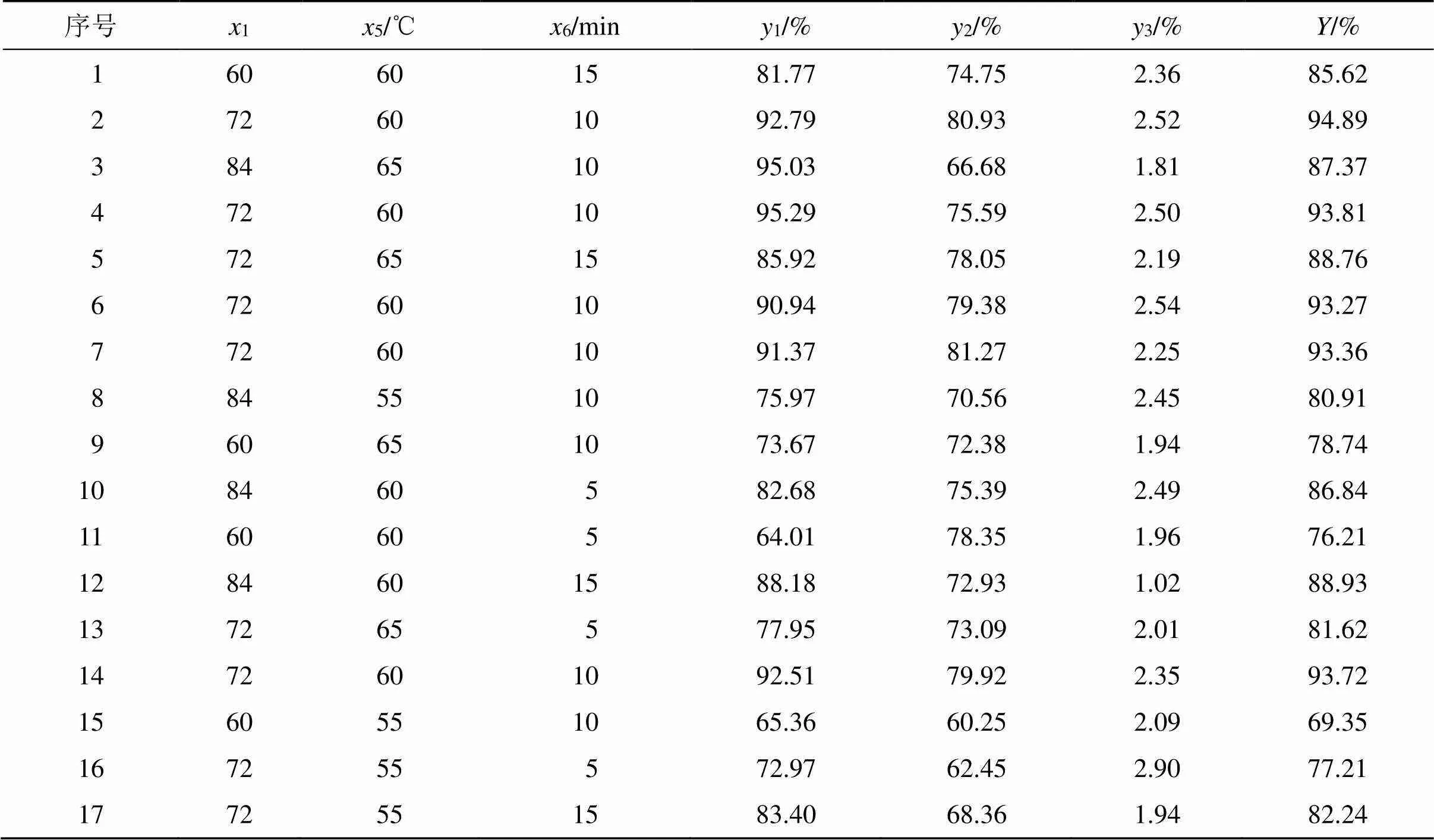
表7 BBD实验考察结果
通过Design-Expert.V8.0.6.1软件进行多元线性回归和二次多项式回归,并以拟合优度(2)和置信度()作为模型判定标准,结果见表8。通过模型拟合得到的二次多项式回归方程为=93.81+4.271+3.355+2.966-0.7315-1.8316+0.5356-6.3912-8.3352-3.0262。由方差分析结果可知,回归模型值<0.000 1,失拟度检验值为6.36,值为0.052 9>0.05,表明其失拟项水平不显著,模型拟合较好;回归方程的决定系数2=0.975 1>0.95,说明方程拟合程度良好,可以解释在97.51%范围内响应值的变异;信噪比值为 25.634>4,表明模型合理,可用于进行实验分析。
根据模型拟合结果,将其中一个因素固定,进行综合评分对其他两个因素的拟合,以为评价指标对交互因素的等高线与3D效应曲面图见图5。优化后最终确定的处方结果为胆脂比1∶12,水合温度为60 ℃,超声时间为10 min。
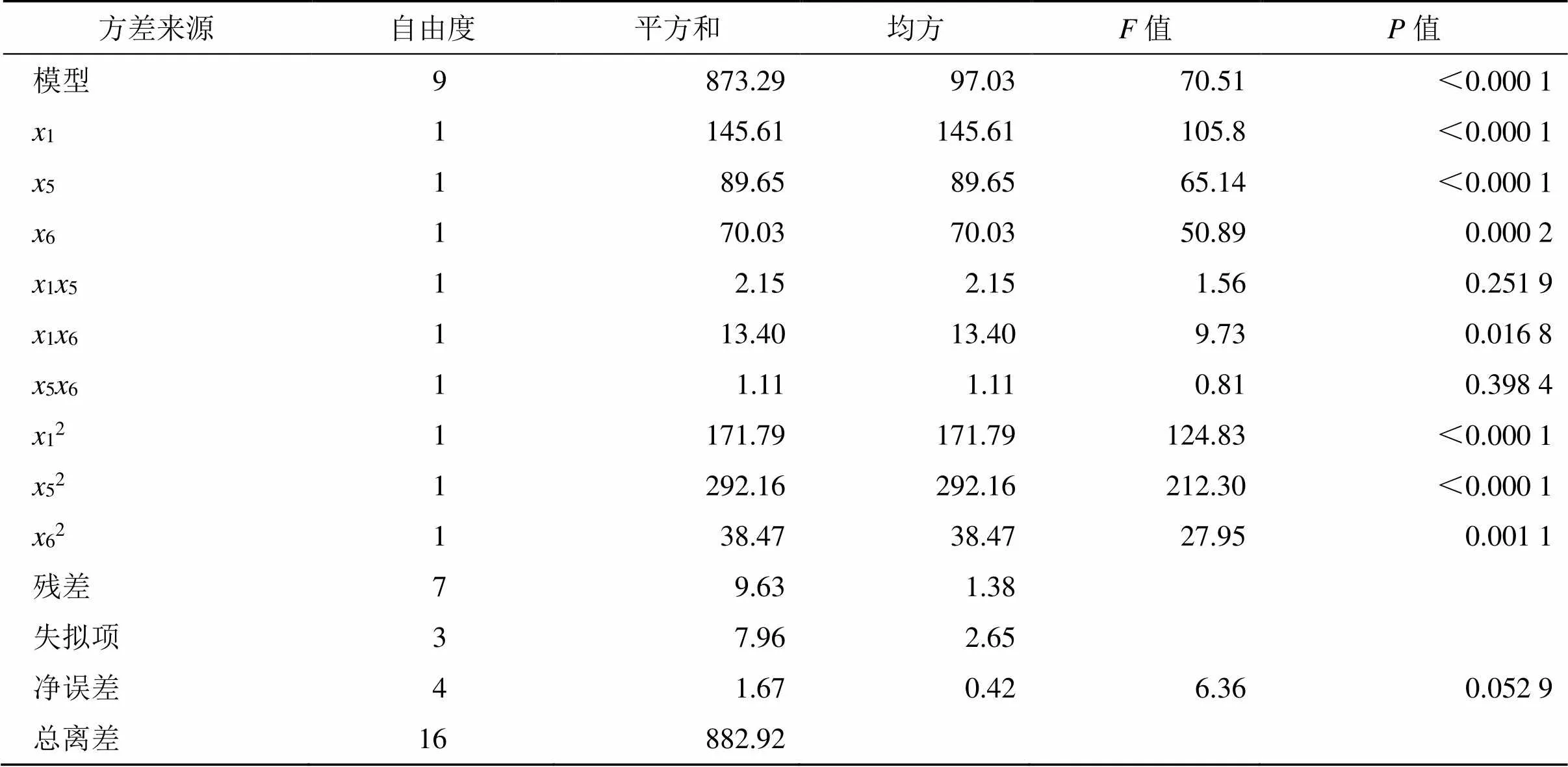
表8 BBD方差分析结果
2.7 验证性实验
对响应面实验得到的最优工艺处方进行验证性实验,即在胆脂比1∶12,水合温度60 ℃,超声时间10 min的工艺条件下进行验证,结果发现实际值与预测值较为接近,相对偏差较小,预测性良好,说明RGD-Cur/Bai-Lip的制备工艺稳定可靠,具体见表9。
2.8 RGD-Cur/Bai-Lip的表征
2.8.1 脂质体的形态观察 由图6可见,制备的RGD-Cur/Bai-Lip外观呈亮黄色,澄清透明,无沉淀,对光透视可见淡蓝色乳光,稳定性较好。置于透射电镜下观察,RGD-Cur/Bai-Lip形态圆整,呈类球形,分散均匀。
2.8.2 粒径分布与Zeta电位 根据实验优化的的最优工艺条件制备RGD-Cur/Bai-Lip,采用激光粒度分析仪测定其粒径及Zeta电位,结果见图7。RGD-Cur/Bai-Lip的平均粒径为(101.10±0.62)nm,分散系数(PDI)为0.191 0±0.014 3,Zeta电位为(1.59±0.07)mV,说明RGD-Cur/Bai-Lip粒径分布较均匀,分散性好,不易发生絮凝。
2.8.3 稳定性考察 常温放置RGD-Cur/Bai-Lip,并对其粒径、Zeta电位以及包封率连续7 d进行测定,考察其稳定性。如表10所示,粒径、电位和包封率均变化不大,第7天测定的平均粒径为(117.30±0.56)nm,Zeta电位为(0.95±0.96)mV,姜黄素包封率为93.37%,黄芩苷包封率为75.63%,表明RGD-Cur/Bai-Lip在7 d内稳定性较好。
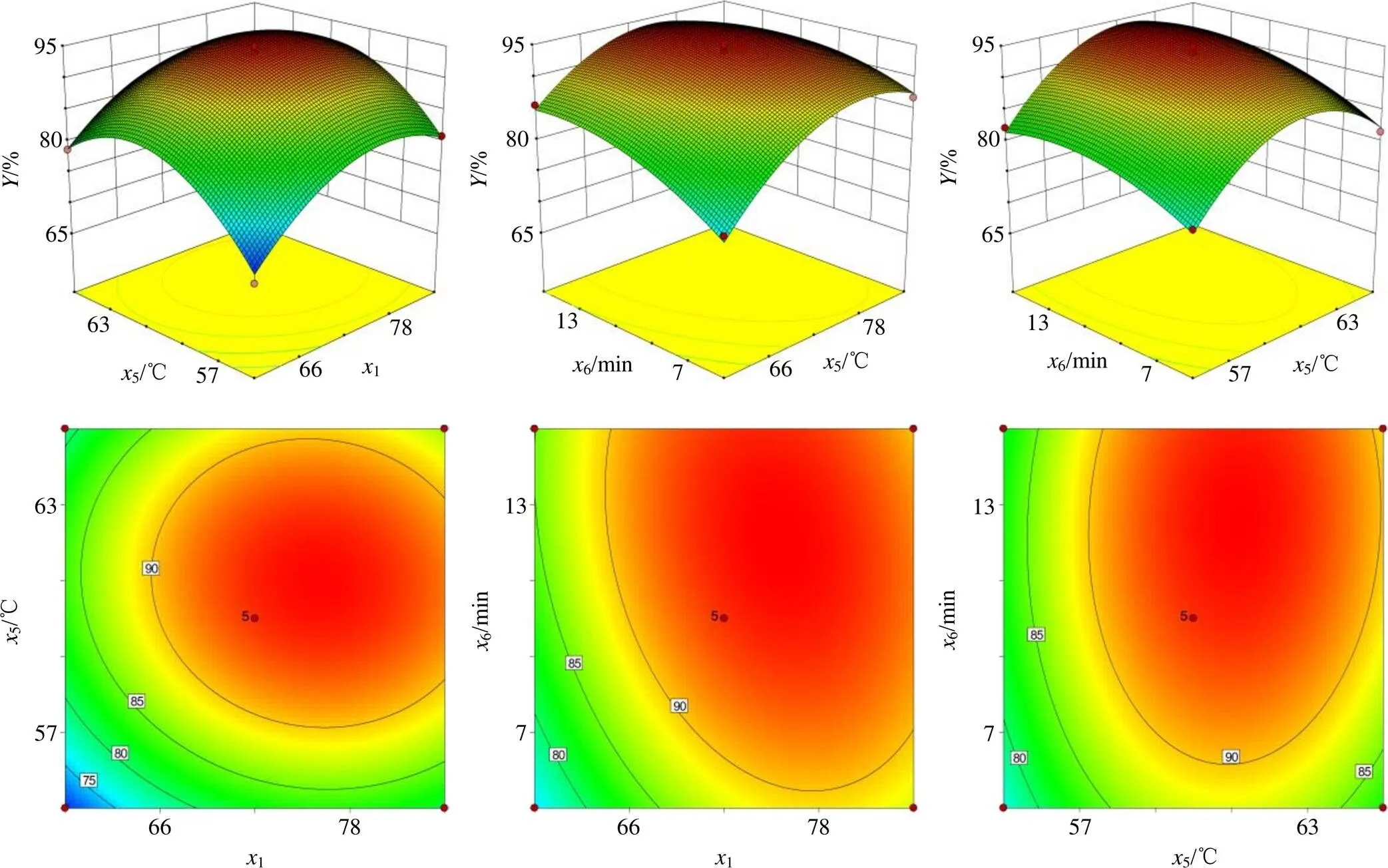
图5 各因素间交互作用的3D效应曲面图及等高线图
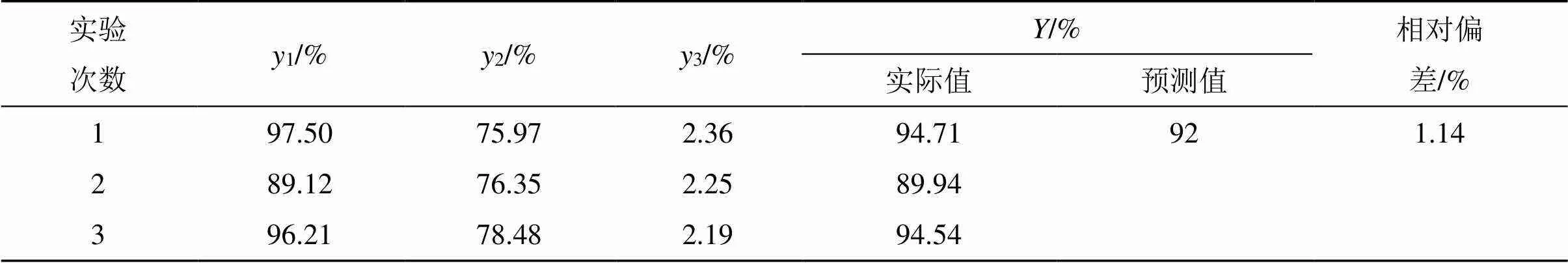
表9 验证性实验结果
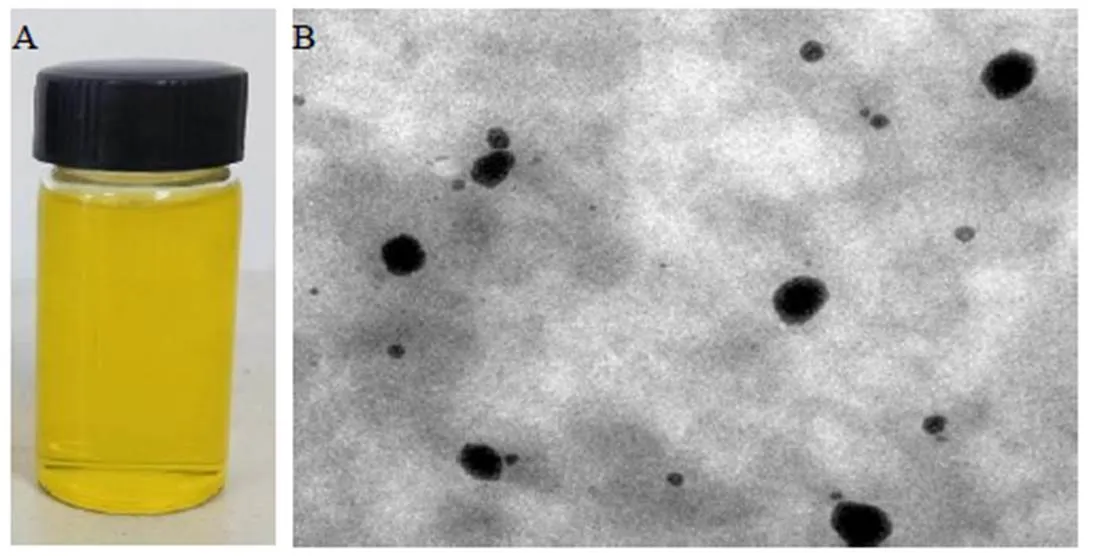
图6 RGD-Cur/Bai-Lip的外观形态(A) 和显微形态(B)
2.8.4 体外释放度考察 基于文献查阅和前期预实验摸索,最终选择以含有30%乙醇的PBS溶液[18]作为释放介质,对RGD-Cur/Bai-Lip进行体外释放度研究,分别精密吸取3 mL的RGD-Cur/Bai-Lip溶液、姜黄素原料药混悬液、黄芩苷原料药混悬液装入透析袋,在释放介质中于37 ℃水浴,150 r/min动态透析,分别在0.5、2、4、6、8、10、12、24 h吸取2 mL,然后分别补入同等体积的释放介质,分别测定样品中的姜黄素和黄芩苷的含量,根据下列公式[19]计算脂质体的累积释放度并绘制释放曲线,结果见图8。

图7 RGD-Cur/Bai-Lip的粒径(A)及Zeta电位(B)分布
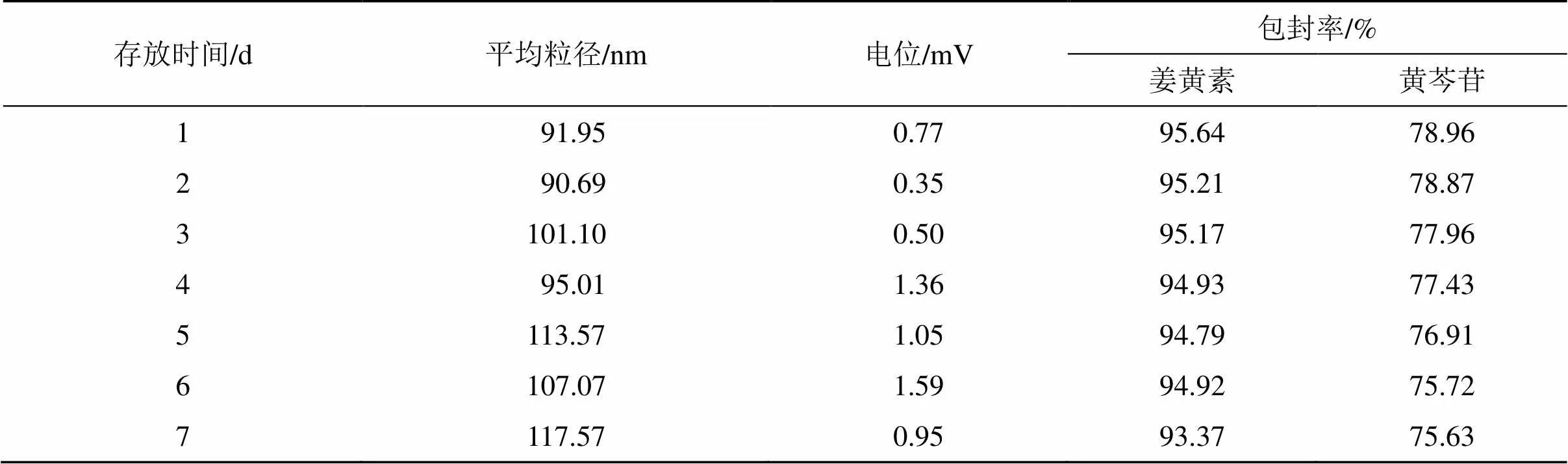
表10 稳定性测定结果(n= 3)
=(补C+总C)/
指累积释放度,补指释放介质的补入体积,C指第次取样时释放的药物浓度,总指释放介质的总体积,C指第次取样时的药物浓度,指脂质体样品中的药物含量
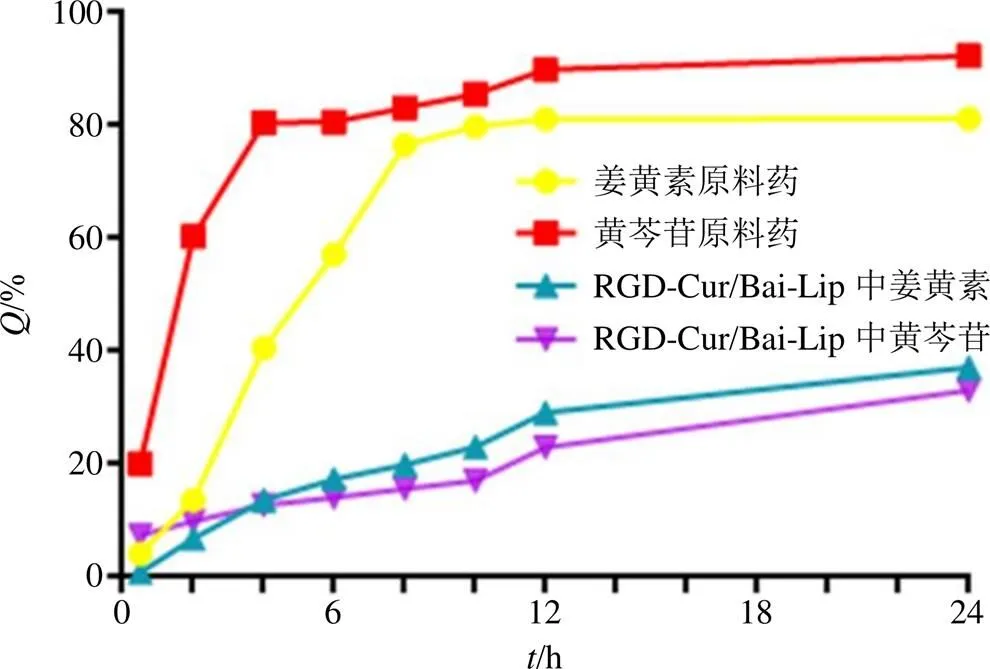
图8 姜黄素原料药、黄芩苷原料药及RGD-Cur/Bai-Lip的体外释放曲线
结果表明,姜黄素原料药混悬液、黄芩苷原料药混悬液在12 h时Q均达到了80%以上,而RGD-Cur-Lip和RGD-Bai-Lip的Q仅为29%和23%左右,在24 h时,Q达到了37%和33%左右。通过Origin 2019b软件,分别应用零级方程、一级方程、Higuchi方程对RGD-Cur/Bai-Lip进行曲线拟合,拟合结果见表11。根据拟合相关系数2可知,RGD-Cur/Bai-Lip均符合Higuchi方程,表明RGD-Cur/ Bai-Lip具有良好的缓释作用。
2.8.5 溶血性考察 根据《中国药典》2020年版规定对RGD-Cur/Bai-Lip的溶血性进行评估。取EP管27只,分为3组,分别为空白Lip组、Cur/Bai-Lip组、RGD-Cur/Bai-Lip组,每组9只,对其进行编号(各组中1~6号管为供试品管,7号管为阴性对照管,8号管为阳性对照管,9号管为供试品对照管)。按表12所示依次加入2%红细胞混悬液、生理盐水、去离子水,混匀后,立即置于(37.0±0.5)℃的恒温箱中进行温浴。3 h后观察溶血和凝聚反应,结果见图9。结果可见所有组别均无溶血现象,表明RGD-Cur/Bai-Lip无溶血性,可以用于后续动物实验的静脉给药。

表11 RGD-Cur/Bai-Lip中姜黄素和黄芩苷的体外释放拟合结果
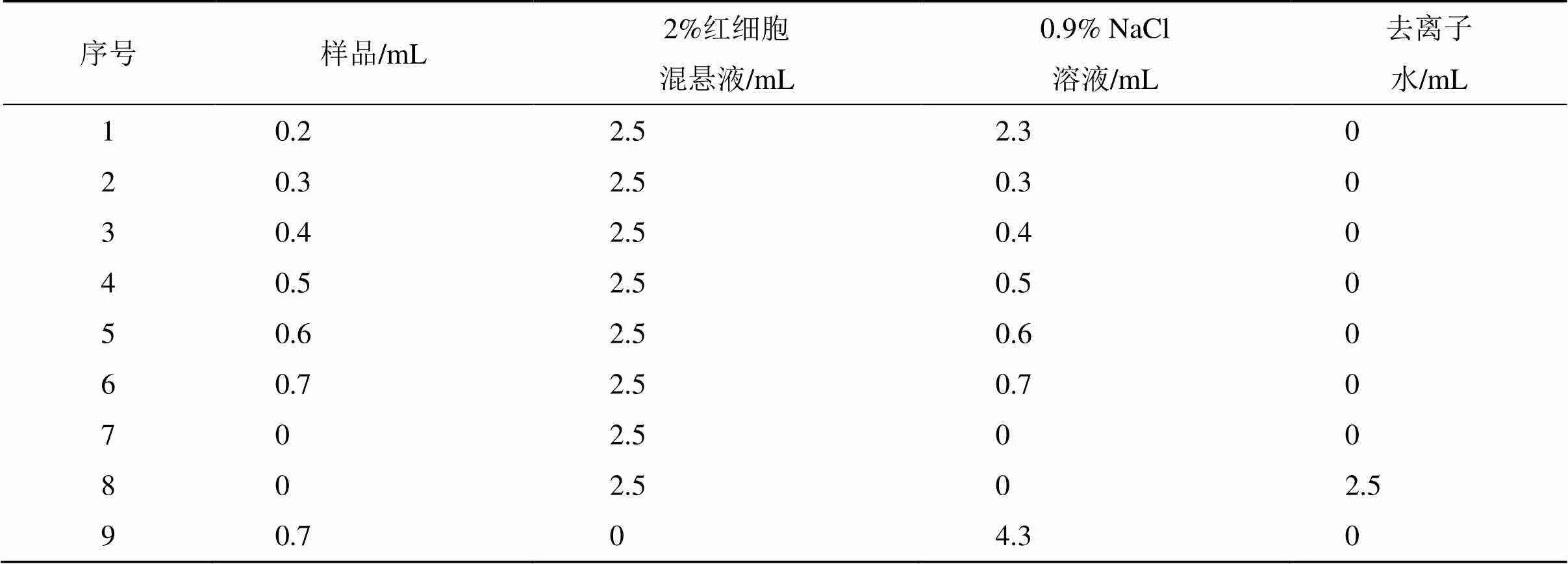
表12 溶血实验设计方案
3 讨论
本实验通过Plackett-Burman筛选实验设计结合Box-Behnken响应面实验对处方进行了优化,确定的最优工艺条件为胆脂比1∶12,水合温度60 ℃,探头超声时间为10 min。工艺优化后得到的RGD-Cur/Bai-Lip包封率较高,平均粒径在110 nm以下,粒径分布均匀,满足肝靶向脂质体预期的粒径要求。此外,通过溶血性实验和体外释放度考察,发现RGD-Cur/Bai-Lip无溶血反应,并具有良好的缓释作用。

图9 溶血性评估图
RGD-Cur/Bai-Lip的Zeta电位较小,代表其静电斥力不足以将粒子与粒子排斥开来,理论上易发生聚集,但稳定性实验却发现RGD-Cur/Bai-Lip在7 d内粒径、电位及包封率均无较大变化,原因可能在于RGD环肽表面修饰了含有亲水的DSPE-PEG链,其亲水性与空间效应减少了粒子之间的聚集或吸附现象,可以增强其稳定性。此外,存在RGD-Cur/Bai-Lip包封率较高,但总载药量较低的现象。有研究表明[20],当投药量达到脂质体辅料负载能力的上限时,随着投药量的增加,载药量反而会下降。由于制备脂质体的主要辅料大多都是磷脂和胆固醇等天然成分,对药物的负载能力有限,因此脂质体等纳米制剂大多存在载药量不高的问题。将在后续实验中对提高载药量作进一步的研究。
将姜黄素或黄芩苷包载于脂质体中用于治疗肝纤维化的研究已有报道,但肝纤维化病因及机制复杂,多条途径和通路都可引起肝纤维化,姜黄素和黄芩苷可通过不同的途径和通路抑制肝纤维化:姜黄素抑制HSC活化、增殖以抗肝纤维化;黄芩苷通过抗氧化应激作用来逆转肝纤维化。通过构建姜黄素/黄芩苷共递送纳米脂质体,使两药合用,通过多途径抑制肝纤维化,发挥协同作用,疗效更佳。HSC的激活和增生是肝纤维化发生发展过程中的关键环节,抑制HSC的活化可有效抗肝纤维化。RGD环肽能够特异性地与HSC表面的整合素结合,阻止细胞的增殖分化。用RGD环肽对姜黄素/黄芩苷共递送纳米脂质体进行修饰,构建靶向于HSC的RGD-Cur/Bai-Lip载药系统,可以最大限度地将姜黄素和黄芩苷运送至HSC,实现精准靶向给药,更好地发挥其协同抗肝纤维化作用。但其对HSC的靶向作用还需通过体内外研究得到进一步的证实。本实验主要研究了RGD-Cur/Bai-Lip的制备工艺及表征,为其后续抗肝纤维化体内外药效学评价和靶向性研究提供了制剂基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Rockey D C, Bell P D, Hill J A.Fibrosis: A common pathway to organ injury and failure [J]., 2015, 372(12): 1138-1149.
[2] 周新刚, 刘红刚.Hedgehog信号通路在肝脏疾病中的研究进展 [J].中国肝脏病杂志: 电子版, 2017, 9(3): 30-35.
[3] 连娜琦.姜黄素抑制肝星状细胞Hedgehog信号通路抗肝纤维化作用研究 [D].南京: 南京中医药大学, 2015.
[4] 常虹, 郭凯, 孟洪宇, 等.中药有效成分作用于肝星状细胞抗肝纤维化分子机制研究进展 [J].中国现代中药, 2017, 19(1): 148-153.
[5] Bhavsar D, Subramanian K, Sethuraman S,.‘Nano-in-nano’ hybrid liposomes increase target specificity and gene silencing efficiency in breast cancer induced SCID mice [J]., 2017, 119: 96-106.
[6] 喻雪琴, 张诗婉, 陈芳, 等.趋化因子在肝纤维化发生发展中作用的研究进展 [J].山东医药, 2020, 60(25): 92-95.
[7] Li L J, Wang H Y, Ong Z Y,.Polymer- and lipid-based nanoparticle therapeutics for the treatment of liver diseases [J]., 2010, 5(4): 296-312.
[8] 杨建宏.RGD修饰的氧化苦参碱聚合物泡囊抗肝纤维化作用的研究 [D].广州: 南方医科大学, 2013.
[9] 柯学, 王长江, 严菲.滤膜法测定多西紫杉醇脂质体的包封率 [J].中国现代应用药学, 2008, 25(4): 314-316.
[10] 董博宇.β-榄香烯-姜黄素复方脂质体的制备与联用多西他赛抗肺癌作用的研究 [D].北京: 北京中医药大学, 2017.
[11] 刘淑兰, 周艺林, 林鹏, 等.Box-behnken响应面法优化紫红生肌软膏的醇提工艺 [J].湖南中医药大学学报, 2021, 41(4): 528-535.
[12] 谭馨, 邓光明.基于GRC-MCC的-类SVM分类算法 [J].统计与决策, 2020, 36(22): 10-14.
[13] 郭亚军, 阮泰学, 宫诚举.基于主客观信息综合判断的非线性拉开档次法 [J].运筹与管理, 2017, 26(6): 149-154.
[14] 于亚田, 王智群, 冯建安, 等.基于Box-Behnken及PCA-G1-熵权法优选青香乳康颗粒中挥发油的提取及包合工艺 [J].中草药, 2019, 50(15): 3631-3636.
[15] 马秉智, 李丽, 赫军, 等.Plackett-Burman设计结合响应面法优化苦豆子效应成分的提取工艺 [J].中国药学杂志, 2019, 54(12): 953-959.
[16] 张小雯, 孙敬蒙, 汪卓明, 等.Plackett-Burman联用Box-Behnken响应面法优化马来酸桂哌齐特脂质体的制备及表征 [J].医药导报, 2021, 40(2): 240-247.
[17] 宁双成, 周莉莉, 王敏, 等.星点设计-效应面法优化斑蝥素纳米结构脂质载体处方工艺 [J].中草药, 2019, 50(17): 4114-4122.
[18] Li R, Deng L, Cai Z,.Liposomes coated with thiolated chitosan as drug carriers of curcumin [J]., 2017, 80: 156-164.
[19] 冯宇飞, 常书源, 秦国昭, 等.星点设计-效应面法优化pH值响应及线粒体靶向双功能金丝桃苷脂质体的处方及其体外评价 [J].中草药, 2020, 51(23): 5934-5942.
[20] 任婧, 张丹参, 侯文书, 等.姜黄素长循环脂质体的制备及表征 [J].河北科技大学学报, 2018, 39(6): 532-539.
Preparation process optimization and characterization of RGD cyclopeptide modified curcumin/baicalin co-delivery targeted liposomes
WU Si-yu1, ZENG Ying-rong1, TANG Pin1, GUI Hui1, HU Li-zhi2
1.Hunan Key Laboratory of ModernizationResearch of Traditional Chinese Medicine, School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China 2.The Second Affiliated Hospital of Hunan University of Chinese Medicine, Changsha 410005, China
To optimize the preparation and characterization of curcumin/baicalin co-delivery targeting nanoliposomes (RGD-Cur/Bai-Lip) modified by RGD cyclopeptide.RGD-Cur/Bai-Lip was prepared by ethanol injection.Ultrasonic time, bile-fat ratio and hydration temperature were determined by Plackett-Burman screening experiment as the key factors for the preparation of RGD-Cur/Bai-Lip.Then the process was optimized by Box-Behnken response surface method, with curcumin entrapment efficiency, baicalin entrapment efficiency and total drug loading as indexes.The AHP-multiple correlation coefficient method-open grade method was used to determine the weight coefficient of each index and calculate the comprehensive score, so as to determine the optimal prescription and key process parameters of RGD-Cur/Bai-Lip.Finally, its morphology, particle size potential, stability,release and hemolysis were characterized and evaluated.The optimum conditions were as follows: the ratio of bile to lipid was 1∶12, the hydration temperature was 60 ℃, and the ultrasonic time of the probe was 10 min.The appearance of RGD-Cur/Bai-Lip was clear and transparent, bright yellow, light blue opalescent light.Under transmission electron microscope, RGD-Cur/Bai-Lip dispersed evenly with round shape.The average particle size was (101.10 ± 0.62) nm, the dispersion coefficient (PDI) was 0.191 0 ± 0.014 3, the Zeta potential was (1.59 ± 0.07) mV, the entrapment efficiency of curcumin was (94.28 ± 4.51)%, the entrapment efficiency of baicalin was (76.93 ± 1.35)%, and the total drug loading was (2.27 ± 0.09)%.It had good stability and no hemolysis within 7 d, and had a certain sustained release effect.This method can effectively and reliably optimize the preparation process of RGD-Cur/Bai-Lip.After optimizing the prescription, the prepared RGD-Cur/Bai-Lip has high entrapment efficiency, uniform particle size distribution and good stability without hemolysis, which provides a preparation basis for the follow-up study of anti-hepatic fibrosis of RGD-Cur/Bai-Lipand.
liposome; curcumin; baicalin; RGD cyclopeptide; Plackett-Burman design; Box-Behnken response surface method; AHP-complex correlation coefficient-open level weight method
R283.6
A
0253 - 2670(2021)22 - 6834 - 11
10.7501/j.issn.0253-2670.2021.22.008
2021-06-08
湖南中医药大学中药学一流学科开放基金项目(2020ZYX09)
吴斯宇,女,土家族,硕士研究生,中药学专业。Tel: 15508979610 E-mail: 2464423265@qq.com
通信作者:桂 卉,女,教授,硕士生导师,从事中药新剂型与新技术研究。Tel: 13707488252 E-mail: 1302985572@qq.com
胡立志,男,硕士,主管中药师。Tel: 15116424878
[责任编辑 郑礼胜]
