具有MELF浸润的低级别子宫内膜样癌的临床病理特征及分子分型相关蛋白表达
2021-11-20冯晓敏汤永峰徐娟李惠可飞韩梅
冯晓敏 汤永峰 徐娟 李惠 可飞 韩梅
1南京医科大学附属妇产医院南京市妇幼保健院病理科,江苏 210029;2南京中医药大学附属医院江苏省中医院病理科 210029
子宫内膜癌是发生在子宫内膜的一组恶性上皮性肿瘤,是仅次于宫颈癌的第2 常见妇科恶性肿瘤。子宫内膜样癌作为Ⅰ型子宫内膜癌的一种,预后好,5 年生存率约90%[1],然而,患者生存率的高低除了与组织学分级相关之外,还与子宫深肌层浸润(>1/2)、淋巴结转移、脉管癌栓及宫颈间质浸润有关[2-3]。Murray等[4]在2003年第1次描述了低级别子宫内膜样癌一种特别的肌层浸润模式:微囊性、拉长及碎片状(MELF)的浸润模式,镜下可见到微囊状、拉长及碎片状的腺体,表面被覆嗜酸性胞浆、扁平的细胞,局部可见到肿瘤细胞簇状及单个胞浆淡染的细胞;周围可见疏松的、黏液样的间质。相关研究发现,MELF 浸润多发生在低级别子宫内膜样癌中,与子宫深肌层浸润、脉管癌栓及淋巴结转移等预后不良因素有关[5-7]。本研究回顾性研究183 例低级别子宫内膜样癌患者,对比分析具有MELF 浸润与无MELF 浸润的低级别子宫内膜样癌的临床病理学特征及相关分子表达,并对患者进行随访,希望对具有MELF 浸润模式的低级别子宫内膜样癌的临床处理及预后评估提供更多证据。
1 资料与方法
1.1 临床资料 收集2016 年4 月至2020 年12 月于江苏省中医院及南京市妇幼保健院进行全子宫切除、双侧附件切除和盆腔(或加腹主动脉旁)淋巴结清扫手术的183 例低级别子宫内膜样癌病例,通过具有MELF 浸润与无MELF浸润筛选出研究组和对照组,对比分析其临床病理学特征及相关分子特征。
1.2 方法及试剂 将低级别子宫内膜样癌标本常规4%中性甲醛固定,上机、脱水、浸蜡、包埋,切片之后进行HE 染色。 使用罗氏全自动免疫组织化学仪(VentanaBenchMark XT)进行免疫组化标记。细胞角蛋白(CK)抗体自福州迈新生物技术开发有限公司购买,D2-40、CD34、抗体则来自北京中杉金桥生物技术有限公司,p53 蛋和MMR 蛋白(MLH1、MSH2、MSH6、PMS2)抗体购自福州迈新公司。每个抗体均设有阳性对照,为已确定表达阳性的组织,阴性对照用PBS 代替一抗进行染色。CK 以细胞内出现棕黄色颗粒为阳性,阳性表达定位于细胞膜或细胞质,D2-40 和 CD34 阳性可显示脉管,p53 和 MMR 蛋白表达定位于细胞核,p53 判读阳性标准为细胞核中出现棕褐色颗粒。p53 弥漫强阳性(>70%)或全部阴性时,判为p53 突变型,反之判为p53 野生型,MLH1、MSH2、MSH6、PMS2 蛋白细胞核均呈棕褐色为表达正常,如果有1 种及以上MMR 蛋白核无着色为表达缺失。
1.3 统计学分析 数据采用SPSS 23.0软件进行分析,符合正态分布的计量资料以()表示,组间比较采用独立样本t检验,计数资料以例(%)表示分类变量,比较采用Pearson 卡方及Fisher 精确概率检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 临床病理学特征 患者年龄为(57.6±6.2)岁(48~69 岁)。按照2014 版国际妇产科联盟(FIGO)分期标准,Ⅰ期+Ⅱ期患者170例,Ⅲ期+Ⅳ期患者13例。术后同时进行放化疗者有79 例,只行化疗者有104 例。统计结果显示,伴MELF 浸润的研究组与无MELF 浸润的对照组相比,浸润子宫肌层深度、淋巴结转移、脉管癌栓方面的差异均有统计学意义(均P<0.01),见表1。
2.2 病理学检查
2.2.1 巨检 183 例低级别子宫内膜样癌标本中,134 例表现为宫腔内肿物,49 例表现为内膜轻度不规则增厚。研究组24 例标本中,18 例宫腔内可见大小不等的质脆肿物,易碎伴/不伴出血坏死,切面呈灰白灰黄色,肿瘤侵及肌层,肿物最大径1.5~12.0 cm;6 例肿块不明显,仅表现为内膜轻度不规则增厚。研究组与对照组的低级别子宫内膜样癌标本巨检情况差异无统计学意义。
2.2.2 镜下 经典型低级别子宫内膜样癌肌层内可见腺泡状或乳头状生长的肿瘤性腺体,可伴有少量实性成分。MELF 浸润模式除了上述组织学特征之外,还可见微囊性、拉长的裂隙样及碎片状腺体,上皮细胞呈立方或扁平状,细胞浆呈淡染、嗜酸性(图1A、B、D)。MELF 浸润模式一般出现在肿瘤浸润的前沿部分;MELF浸润腺体周围可出现疏松的黏液样、水肿的纤维间质(图1B);部分病例可见到单个细胞或嗜酸性的肿瘤细胞簇,这些细胞与泡沫样组织细胞相似,在细胞内及细胞间可见到淋巴细胞及中性粒细胞的浸润(图1A、B)。部分病例可见脉管内癌栓(图1C、E、F);部分病例可见淋巴结转移,大多数转移淋巴结中可见被膜下窦内单个细胞、嗜酸性肿瘤细胞簇或微囊性、拉长型腺体(图2);而无MELF 浸润的低级别子宫内膜样癌淋巴结转移灶癌细胞多呈巢团状分布,少见单个细胞转移。
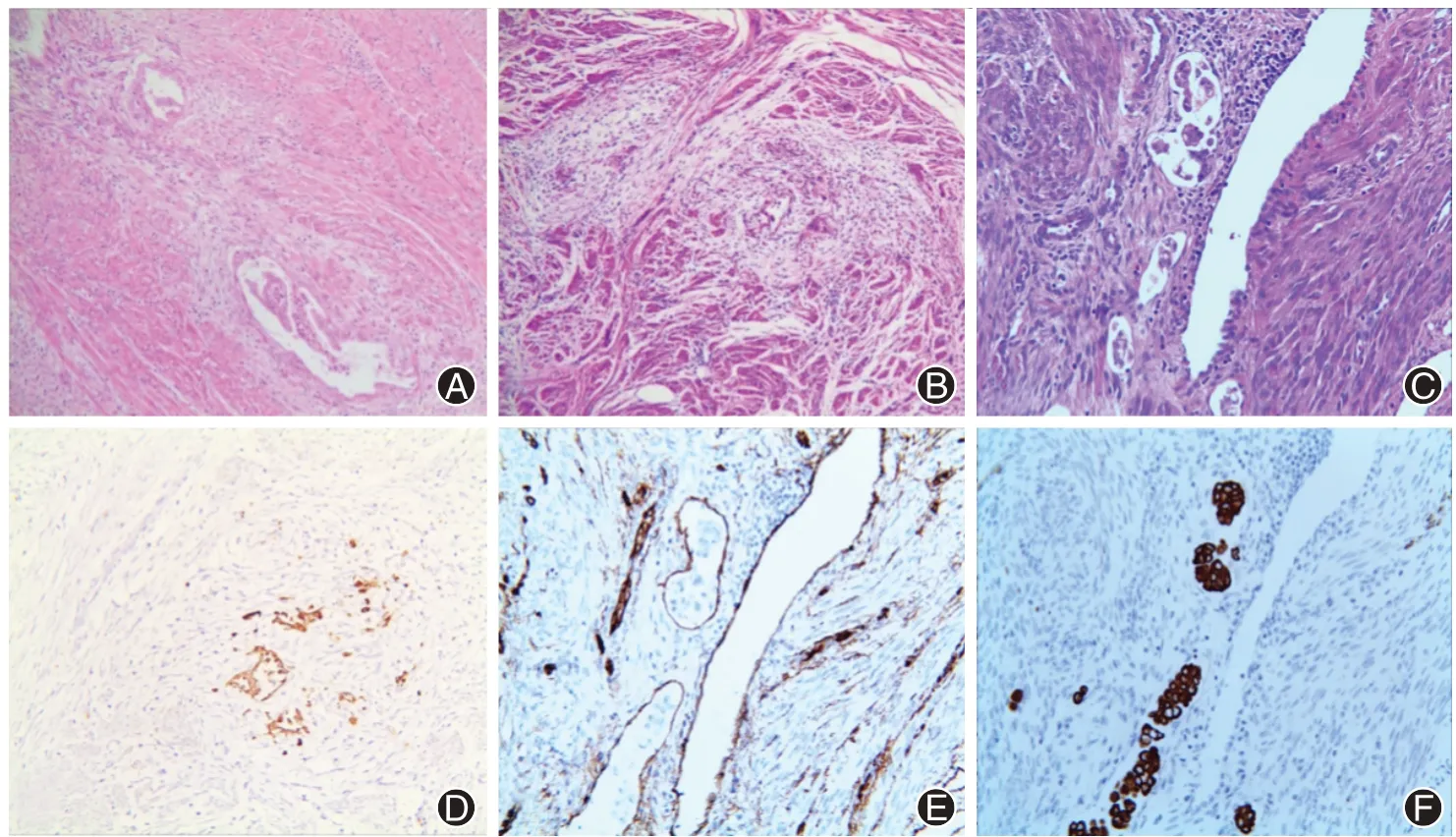
图1 具有微囊性、拉长及碎片状(MELF)肌层浸润特征的低级别子宫内膜样癌的镜下情况。A、B 为疏松的黏液及炎细胞背景中可见到微囊性、拉长(A)及碎片状(B)的腺体,被覆上皮呈立方、扁平状(HE ×200),C 为脉管内可见到嗜酸性的肿瘤细胞及肿瘤细胞簇(HE ×200),D 为CK 显示MELF 腺体及细胞阳性(EnVision法 ×200),E为CD34标记脉管(EnVision法 ×200),F为CK标记脉管内癌栓(EnVision法 ×200)
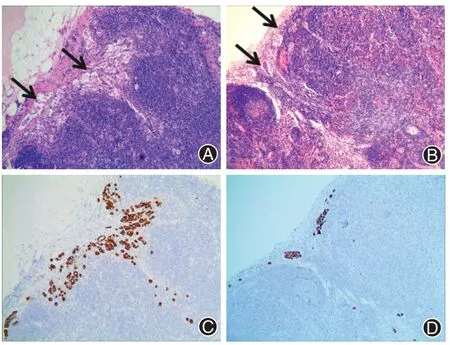
图2 淋巴结转移表现。A、B 为淋巴结被膜下窦内可见细胞浆呈嗜酸性的单个肿瘤细胞及肿瘤细胞簇,黑色箭头所指(HE ×200),C、D为细胞角蛋白显示被膜下阳性的肿瘤细胞及腺体(EnVision法 ×200)
2.3 免疫组织化学结果 CK 免疫标记可显示不易分辨的MELF 型腺体、单个细胞及淋巴结转移灶。CK、D2-40、CD34 同时阳性可显示脉管内癌栓。研究组24 例低级别子宫内膜样癌中,21 例可见脉管癌栓,15 例可见淋巴结转移,其中6 例可见腹主动脉旁淋巴结转移。对照组159 例低级别子宫内膜样癌中,39 例可见脉管癌栓,4 例可见淋巴结转移,其中2 例可见腹主动脉旁淋巴结转移。研究组和对照组的突变型p53 表达率分别为16.7%(4/24)和6.3%(10/159)。研究组和对照组的MSH2-MSH6 缺失率分别为8.3%(2/24)和1.3%(2/159),MLH1-PMS2 缺失率分别为 4.2%(1/24)和 7.5%(12/159),PMS2 缺失率分别为 0 和9.4%(15/159),MSH6 缺失率分别为 4.2%(1/24)和 3.1%(5/159)。见表1。
2.4 随访结果 183例患者随访时间为(32.2±6.5)个月(7~56个月)。随访期间内,研究组有2例复发,1例失访。对照组有1例复发,3例失访,其余未见进展。去掉失访病例和无进展病例,两组对比差异有统计学意义(P<0.05)。见表1。

表1 两组低级别子宫内膜样癌的临床病理特征及分子分型相关蛋白表达[例(%)]
3 讨 论
具有MELF 浸润模式的子宫内膜样癌是一类比较特殊的子宫内膜样癌,由 Murray 等[4]在 2003 年首次提出。此类肿瘤主要表现为子宫肌层内可见MELF 的腺体及单个肿瘤细胞,周围可见纤维水肿的黏液样间质以及大量的炎细胞。研究表明,MELF浸润模式通常发生在低级别子宫内膜样癌中,且脉管癌栓及淋巴结转移较常出现。Hertel 等[8]也发现,MELF 型肌层浸润的存在与淋巴结转移呈正相关,但是大多数形态学不典型,低倍镜很难识别。国外关于MELF浸润模式的子宫内膜样癌的发生率在10%~20%之间[8],国内相关报道较少,我们观察了2 家三甲医院的近5 年MELF型子宫内膜样癌的病理报告检出率均小于5%。本文回顾性分析低级别子宫内膜样癌183例,检出24例伴MELF浸润的低级别子宫内膜样癌(发生率为13.1%)。
本研究中,研究组患者临床表现多为阴道不规则出血、月经紊乱或绝经后出血,巨检有18 例子宫内膜可见大小不一的肿物,6 例表现为子宫内膜不同程度的增厚。其中3 例合并子宫腺肌症,5 例合并子宫平滑肌瘤,以上临床特征与对照组比较,差异均无统计学意义。其他相关研究也证实,单纯子宫内膜样癌患者与同时合并子宫腺肌症的子宫内膜癌患者的无病生存率和总生存率差异均无统计学意义[9]。
镜下可见MELF 浸润模式大多数发生在低级别子宫内膜样癌中,多位于肿瘤浸润的最前面,以微囊性、裂隙样腺体及碎片状、单个肿瘤细胞在肌层中浸润为特征,腺体被浆呈淡染、嗜酸性;最具有特征的是其周围间质呈疏松黏液、水肿样,并见到不同种类的炎性细胞浸润。具有MELF 结构的低级别子宫内膜样癌常伴有淋巴结转移,镜下多表现为淋巴结被膜下窦内单个肿瘤细胞、肿瘤细胞簇或微囊性腺体,胞浆丰富且呈嗜酸性。CK、D2-40、CD34 共同表达可显示脉管癌栓和淋巴结内的转移灶。目前尚无识别MELF 结构的特异性指标,主要依靠形态学诊断,上述形态学特征和肿瘤的间质背景可以帮助识别MELF 形态。越来越多的研究表明,与普通型低级别子宫内膜样癌相比,MELF形态特征的肿瘤细胞周围间质炎细胞中T 淋巴细胞和CD68 阳性的巨噬细胞较少,而间质富于T 淋巴细胞才是预后良好的指标[10],肿瘤周围浸润灶中巨噬细胞的减少也通常与预后不良有关[11]。
有文献统计,在464 例子宫内膜样癌中,其中伴MELF浸润的子宫内膜样癌60 例(60/464,12.9%),对比有与无MELF 浸润的子宫内膜样癌时,发现有MELF 浸润者更易发生淋巴结转移(18.3%比1.2%)[6]。也有研究证实淋巴结转移是子宫内膜癌的独立危险因素[12],合并腹主动脉旁淋巴结转移的患者比盆腔淋巴结转移的患者预后更差[13]。本研究183 例低级别子宫内膜样癌中,研究组患者在深肌层浸润发生率、脉管癌栓阳性率、淋巴结转移率方面明显高于对照组(分别为 91.6% 比 17.6%、87.5% 比 3.1%、62.5% 比2.5%),与Joehlin 等[6]的研究结果相似。本研究同时发现,研究组的腹主动脉旁淋巴结转移率亦明显高于对照组(25.0%比1.3%)。有研究发现,合并盆腔淋巴结或腹主动脉旁淋巴结转移的子宫内膜癌患者的5 年生存为44%~52%[14],而具有MELF浸润的子宫内膜样癌通常伴有更高的淋巴结转移率。Mariani等[15-16]研究认为出现深肌层浸润是患者发生肺、肝等远处转移的主要预测指标,也是低级别子宫内膜癌患者出现复发和死亡的重要因素,建议临床医生对深肌层浸润患者进行积极的术后辅助治疗。
2020 年第5 版世界卫生组织分类依据子宫内膜样癌的分子特征将其分为4 型:POLE(polymerase epsilon)-超突变型、MMR(mismatch repair)-缺失型、p53 突变型和无特异性分子特征型。近年来,对于具有MELF 浸润模式的子宫内膜样癌的分子研究也取得了一定的进展。
众所周知,子宫内膜癌是遗传性非息肉病性大肠癌(hereditary nonpolyposis colortal cancer,HNPCC)家族中最常见的肠外肿瘤之一,HNPCC 是一种由错配修复基因MMR突变引起的常染色体显性遗传病,又称林奇综合征。MMR蛋白主要有4 种(MLH1、MSH2、MSH6 和PMS2),林奇综合征中最常见的突变基因为MLH1 和MSH2,4 个蛋白质只有两两配对(MLH1-PMS2 和MSH2-MSH6)后才可以有效的发挥生物学功能,MSH2 突变可导致MSH2-MSH6 的表达缺失,MSH6突变一般只导致MSH6表达缺失;MLH1突变可导致 MLH1-PMS2 表达缺失,PMS2 突变一般只导致PMS2 表达缺失[17]。有研究对4 种MMR 蛋白进行免疫组化检测发现,具有MELF 浸润模式的肿瘤中MSH2-MSH6缺失发生率比无MELF 浸润的子宫内膜癌更高(MELF 型为7.14%,无MELF型为3.96%),而无MELF浸润模式的肿瘤中更容易发生 MLH1-PMS2 表达缺失(无 MELF 型为 32.67%,MELF 型为21.43%),表明它们可能具有不同的分子特征,会有不同的临床处理[18]。本研究中,研究组MSH2-MSH6 缺失率和MSH6 单独缺失率均高于对照组,而研究组的MLH1-PMS2缺失率及PMS2单独缺失率均低于对照组,与上述研究结果有相似的倾向性,同时也发现研究组中由MSH2 突变导致的MSH2-MSH6 缺失发生率较高。有研究表明,MSH2 突变导致女性患癌的风险最高[19]。但本研究中,研究组与对照组中的MSH2-MSH6 的缺失发生率比较,差异无统计学意义(P>0.05),而MMR 基因突变是否会影响预后及个体化的临床治疗,还有待于更大样本量的研究进一步证实。
p53为肿瘤抑制基因,是人类恶性肿瘤中最容易发生改变的基因,目前在子宫内膜癌中被广泛研究,p53 突变约占所有低级别子宫内膜样癌的10%,多见于高级别子宫内膜样癌,约50%的高级别子宫内膜样癌可发生p53 突变,而低级别子宫内膜样癌突变比率较少。本研究对象均为低级别子宫内膜样癌,发现研究组比对照组更容易发生p53 突变,突变型 p53 表达率分别为 16.7%(4/24)和 6.3%(10/159)。突变型p53 属于转录因子,它能调节细胞周期,促进细胞的增殖和恶化。p53 突变是子宫内膜癌患者预后不良的重要因素之一,也和子宫内膜癌患者生存期的长短有着直接关系[20]。
子宫内膜癌是目前已知POLE 基因突变比例最高的恶性肿瘤[21]。许多研究表明POLE 突变型子宫内膜癌可能会有更好的预后,但并不是所有的研究都证明这种情况的存在[22-24]。He 等[25]的研究表明 POLE 突变型肿瘤并不总是有良好的预后,特别是当POLE 突变型与MELF 浸润模式同时存在时,MELF 型浸润增加了15.1 倍的肿瘤进展风险,而这种现象在POLE 野生型亚组中并不存在。因此推测MELF浸润模式可能是POLE 突变型肿瘤复发或进展风险的一个可能的预测因子,但是连接MELF 和POLE 突变的生物学机制仍然是未知的。本研究POLE 基因的相关实验正在进行中,结果尚不完整,后续结果我们会进一步报道。
总之,子宫内膜样癌的分子分型对于确定患者治疗方案、评估预后及筛查林奇综合征有着很重要的意义,掌握MELF型子宫内膜样癌特殊的分子学特征,有望为患者的个体化治疗及预后评估提供新思路。
本研究对183 例低级别子宫内膜样癌患者进行了随访,随访时间为(32.2±6.5)个月(7~56 个月),随访期间内,研究组中有2例复发,对照组中有1例复发,两组对比,差异有统计学意义(P<0.05)。研究组中2 例患者分别在术后36 个月和39 个月复发,对照组中1 例患者在术后54 个月复发,也有研究发现MELF 浸润型子宫内膜样癌患者的复发间隔时间较短[26]。另外本研究中,研究组与对照组的深肌层浸润、淋巴结转移、脉管癌栓及随访结果方面,差异均有统计学意义(均P<0.05),提示MELF 浸润模式可能为低级别子宫内膜样癌的不良预后因子。MELF 浸润模式是否能够成为子宫内膜样癌的独立预后因素尚有争议。Hertel等[8]研究证实,MELF 浸润模式是子宫内膜样癌的独立预后因素,更容易出现术后复发,但MELF 浸润对子宫内膜样癌患者总体生存率无影响。与之相反,也有部分研究表明MELF 浸润模式并不能成为子宫内膜样癌低生存率的独立相关因素[5]。
综上所述,MELF浸润模式作为子宫内膜样癌一种特殊的浸润方式,其发生可能与多种基因协作机制有关。病理医师应熟练掌握其特殊的形态学特征,当发现MELF 浸润时,应仔细评估肌层浸润深度、脉管癌栓及淋巴结转移情况,必要时行免疫组化检测辅助诊断,同时建议将其临床病理学特征与分子分型相结合,共同用于子宫内膜癌的风险评估中,以更有效的明确对预后的影响,也有望为临床提供更精确和个体化的治疗方案,因本研究病例数和随访时间有限,MELF 浸润对患者总体生存率是否有影响,还需大样本量的研究及长期随访。
利益冲突:作者已申明文章无相关利益冲突。
